Назовите ученых которые внесли особый вклад в дело изучения ферментов кратко
Обновлено: 04.07.2024
История ферментов
В середине 17ого века голландский учёный, анатом и химик Франциск Сильвий сумел доказать, что поджелудочная железа человека выделяет особый сок, который затем смешивается с пищей. Так было положено начало долгого пути к понимаю сути и роли ферментов в организме человека. 19 век оказался куда более щедрым на открытия:
Поколения ферментов
В конце 19 века было замечено, что панкреатин в желудке значительно теряет свою активность, так как ферменты разрушаются желудочным соком. Чтобы избежать этого, панкреатин начали производить в специальной оболочке из танина, назвав его Pankreon. Со временем оболочку усовершенствовали, сделали более устойчивой, так чтобы она растворялась уже в кишечнике – так появилось второе поколение ферментов.
Спустя время было доказано, что огромную роль играет размер частиц препарата. Меньший размер позволил бы ферментным препаратам быстрее попадать вместе с измельченной едой из желудка в двенадцатиперстную кишку. Ведь "проскальзывать" из желудка вместе с химусом (измельченной едой, перемешанной сжелудочным соком) дальше в кишечник могут лишь частички не более 1,5 мм в диаметре. Кроме того, чем мельче гранулы, тем быстрее должны были бы активироваться в кишечнике ферменты, содержащиеся в них. В 1963 г. ферментные препараты снова был модернизированы, вместо таблеток начали производить гранулы без оболочки.
Так постепенно "выросло" третье поколение ферментных препаратов. В 1983 году микросферы заключили в капсулу (для защиты ферментов от желудочного сока).
Однако, разработки не стояли на месте. Было обнаружено, что минимикросферы 1,0-1,2 мм в диаметре на четверть эффективнее микросфер диаметром 1,9-2,0 мм. Так в 1993 году был получен патент на производство панкреатина в виде минимикросфер (четвертое поколение ферментных препаратов). Минимикросферы имеют диаметр примерно 1,2 мм - и именно такой размер оказался практически идеальным для наибольшей эффективности препаратов. Именно такие ферментные препараты на сегодняшний день считаются оптимальными. И именно эта технология используется в производстве препарата Микразим.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Описание презентации по отдельным слайдам:


Модель фермента нуклеозид-фосфорилазы Ферме́нты, или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον – закваска) Наука о ферментах Энзимология Успехи энзимологии во второй половине XX века привели к тому, что в настоящее время выделено и очищено более 2000 ферментов, которые используются в различных отраслях человеческой деятельности.

Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции. Активность ферментов определяется их трёхмерной структурой

состав фермента простые ↓ белок сложные ↓ + ↓ белок кофактор (апофермент) (кофермент) ↓ ионы металлов; витамины

Внимание! Зачем нужны витамины? Витамины – вещества органической природы, поступающие извне или синтезирующиеся в организме, участвуют в построении ферментов и гормонов, которые в свою очередь, исполняют роль регуляторов различных биохимических процессов.



Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества - продуктами

субстрат активный центр комплекс (фермент/субстрат) комплекс (фермент/продукт) фермент+продукт продукт фермент+субстрат


Свойства ферментов Не расходуются в процессе катализа (Ферменты не входят в состав конечных продуктов реакции и выходят из неё в первоначальном виде – т.е. они не расходуются в процессе катализа.) Избирательно действуют на вещества, специфичны (Каждый фермент катализирует только одну или небольшую группу сходных реакций.) Имеют высокую каталитическую активность (Каталитическая активность ферментов в несколько раз выше, чем у неорганических катализаторов.) Проявляют активность при определённых условиях среды

Фермент лактаза расщепляет лактозу (молочный сахар) на глюкозу и галактозу

Активность фермента зависит от: давления кислотности среды температуры количества субстрата количества продукта количества фермента присутствия активаторов или ингибиторов

Пепсин (фермент желудочного сока) наиболее активен в сильнокислой среде, а трипсин (фермент поджелудочной железы) – в слабо-щелочной

Внимание! В столовой к обеду был приготовлен винегрет, обильно заправленный уксусом. Как будет перевариваться в ротовой полости картофель, имеющийся в винегрете? Ферменты слюны проявляют свою активность при pH 6,5-7,5, следовательно, уксус замедлит расщепление крахмала картофеля.

Внимание! Почему ферменты слюны активны в ротовой полости, но теряют свою активность в желудке? Для работы ферментов слюны нужна слабощелочная среда. В желудке же среда кислая. Кислая реакция желудочного сока тормозит ферментативную активность слюны.

Внимание! Почему температура выше 40°C опасна для жизни? Температурный оптимум для большинства ферментов человека составляет 37-38°С. При увеличении температуры выше 40°С происходит денатурация фермента, сопровождающаяся изменением конформации белка. Активность фермента снижается, а затем прекращается. Это приводит к нарушению всего обмена веществ.Кроме того происходит внутрисосудистое свёртывание белков крови


Вещества, которые оказывают влияние на активность ферментов, называют эффекторами Эффекторы активаторы вещества, ускоряющие каталитический процесс ингибиторы соединения, тормозящие каталитический процесс

Активирование ферментативных реакций

Ингибиторы взаимодействуют с ферментом в области активного центра, изменяют конформацию фермента, активного центра и снижают его активность. В зависимости от прочности взаимодействия ингибитора с ферментом различают Обратимые ингибиторы Связываются с ферментом посредством образования слабых нековалентных связей. Фермент восстанавливает свою нативную конформацию и активность после диссоциации ингибитора. Обратимые ингибиторы бывают двух типов: конкурентные и не конкурентные. Необратимые специфические ингибиторы ковалентно связываются или разрушают функциональную группу молекулы активного центра фермента, необходимую для проявления его каталитической активности

Ингибирование ферментативных реакций

Классификация ферментов Оксидоредуктазы - окисление или восстановление (например: каталаза, алкогольдегидрогеназа) Трансферазы - перенос химических групп с одной молекулы субстрата на другую Гидролазы - гидролиз химических связей (например, пепсин, трипсин, амилаза) Лиазы - разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. Изомеразы - структурные или геометрические изменения в молекуле субстрата. Лигазы - образование химических связей между субстратами за счет гидролиза АТФ (например, ДНК-полимераза)

Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза - фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному рН (щелочная фосфотаза) или локализации в клетке (мембранная АТФаза).



Внимание! Зачем в стиральные порошки добавляют энзимы? Энзимы (ферменты), входящие в состав средств для стирки, расщепляют различные молекулы загрязнений. Энзим протеаза – выводит белковые пятна. Липаза – жировые. Амилаза борется с крахмальными загрязнениями. Целлюлаза – удаляет ворсинки, приводящих к закатыванию ткани.

1. Что такое фермент? 2. Как ферменты работают? 3. Как ферменты получают имена? Назовите известные вам группы ферментов. 4. Назовите ученых, которые внесли особый вклад в дело изучения ферментов. Вспоминаем!

Закрепляем! Найдите предложения, в которых содержатся биологические ошибки. Запишите номера этих предложений, а затем сформулируйте их правильно. 1. Ферменты – это специфические белки. 2. Ферменты замедляют скорость течения биохимических реакций в клетке. 3. Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент. 4. Один и тот же фермент способен катализировать разные типы реакций с различными химическими веществами. 5. Активность ферментов не зависит от условий среды, в которой протекает реакция. 6. Ферменты локализуются в цитоплазме или в тех или иных органоидах клетки.

Ферменты – это жизнь! Любые действия живого организма независимо от того, какие они будут, обеспечиваются биохимическими реакциями, которые не могут протекать без участия в них ферментов!
Еще с глубокой древности человек использовал ферментативные процессы в хлебопечении, виноделии, обработке кож и т.д., но не понимал их сущности.
Т. Шванн в 1836 году открыл в желудочном соке фермент пепсин.
В 1913 году Л. Михаэлис и М. Ментен разработали теорию механизма действия ферментов и кинетику ферментативных реакций.
Важным шагом в изучении активности ферментов явилось их получение в кристаллическом виде - уреаза (Д. Самнер, 1926 г.); пепсин (1930), трипсин (1931, Д. Нортроп), что подтвердило белковую природу ферментов.
В 1960 году Д. Филлипс впервые расшифровал трехмерную структуру лизоцима с помощью рентгено-структурного анализа. В 1969 году была синтезирована рибонуклеаза (Р.Мерифилд).
Основными направлениями современной энзимологии являются:
-исследования механизмов синтеза ферментов и регуляция их активности;
-изучение более тонких деталей молекулярного механизма действия ферментов;
-создание синтетических аналогов ферментов, наделенных аналогично нативным ферментам высокой активностью и специфичностью действия.
Ферменты - это специфические белки, образующиеся в клетках живых организмов и катализирующие происходящие в них химические реакции.
Еще с глубокой древности человек использовал ферментативные процессы в хлебопечении, виноделии, обработке кож и т.д., но не понимал их сущности.

Т. Шванн в 1836 году открыл в желудочном соке фермент пепсин.
В 1913 году Л. Михаэлис и М. Ментен разработали теорию механизма действия ферментов и кинетику ферментативных реакций.
Важным шагом в изучении активности ферментов явилось их получение в кристаллическом виде - уреаза (Д. Самнер, 1926 г.); пепсин (1930), трипсин (1931, Д. Нортроп), что подтвердило белковую природу ферментов.
В 1960 году Д. Филлипс впервые расшифровал трехмерную структуру лизоцима с помощью рентгено-структурного анализа. В 1969 году была синтезирована рибонуклеаза (Р.Мерифилд).
Основными направлениями современной энзимологии являются:
-исследования механизмов синтеза ферментов и регуляция их активности;
-изучение более тонких деталей молекулярного механизма действия ферментов;
-создание синтетических аналогов ферментов, наделенных аналогично нативным ферментам высокой активностью и специфичностью действия.
Ферменты в естественных условиях работают в водной среде или на границе раздела фаз мембрана — водная среда. Развитие методов химической .
История открытия и исследования ферментов весьма интересна и поучительна. Вопросы о том, что же собой представляют живые системы, какова природа процессов в живом, каковы химические основы наблюдаемых превращений вещества, волновали всех великих химиков XIX столетия.
Современная химия многим обязана Йенсону Якобу Берцелиусу. Он в рамках атомистической теории Дальтона создал первую таблицу атомных масс, разработал номенклатуру соединений и усовершенствовал химическую символику, создал химический язык, которым мы пользуемся в настоящее время. Й. Берцелиус создал электрохимическую теорию химических реакций, ввел представление об изомерии, открыл ряд новых элементов, таких как церий, селен, торий, ванадий. Им же было введено в химию понятие катализа.
Таким образом, основоположники теории катализа изначально рассматривали ферментативный катализ как неотъемлемую составную часть катализа в целом.
Представления о том, что катализ в живых системах осуществляют химические вещества, также имеют свою историю.
Все великие химики первой половины XIX в. участвовали в дискуссии о природе процессов, происходящих в живых системах.
В качестве модели и главного объекта анализа и дискуссии рассматривался процесс конверсии сахара в спирт или уксусную кислоту (винное или уксуснокислое брожение).
Обоснованный ответ на этот вопрос был дан французским исследователем Шарлем Каньяр-Латуром (Ш. Каньяр де ла Тур) (1777—1859). Он экспериментально показал, что дрожжи, осуществляющие ферментацию, — не просто химические вещества, а живые организмы, способные расти и размножаться, причем исходные вещества и продукты реакции — простые химические соединения. Этот вывод был встречен в штыки Й. Берцелиусом, Ю.Либихом, Ф. Вёлером.
Вклад Юстуса фон Либиха в развитие органической химии и агрохимии сравним лишь со значением работ Й. Берцелиуса для общей и неорганической химии. Ю. Либихом создана теория радикалов, разработаны методы анализа и впервые осуществлен синтез многих органических соединений, показана роль фосфора и азота в развитии растений, впервые использованы минеральные удобрения — суперфосфат и сульфат аммония для повышения плодородия почв.
Великий Ю.Либих в школе имел много проблем. Он увлекался химией и пренебрегал традиционными школьными предметами. Отец устроил его практикантом в аптеку. Но Юстус больше интересовался химическими экспериментами, чем производством лекарств. Опасные опыты с серебром и ртутью он проводил тайно. Опыты закончились сильным взрывом, взлетела на воздух крыша аптеки. На этом карьера Либиха-аптекаря закончилась.
Фридрих Вёлер (1800— 1882) знаменит, прежде всего, своими работами по получению мочевины и щавелевой кислоты (простейших органических соединений) из неорганических веществ. Им также впервые получен в значительных количествах металлический алюминий, открыта практически важная реакция получения ацетилена из карбида кальция.
Й. Берцелиус, Ю. Либих и Ф. Вёлер представляли себе процесс брожения как истинный химический процесс, в котором осадок (дрожжи) обладает некоторой химической активностью. Фактически вопрос сводится к тому, что же представляет собой катализатор: химическое вещество неизвестной, возможно, очень сложной структуры или живой микроорганизм? Ю. Либих, Й. Берцелиус, Ф. Вёлер и многие другие химики не могли воспринять идею о том, что живые организмы при брожении осуществляют химическую реакцию, несмотря на то, что поток фактов, подтверждающих это, непрерывно рос.
Бурная дискуссия о природе химических реакций в живом развернулась между JI. Пастером, Ю. Либихом и М.Бертло.
Значительную роль в выяснении вопроса сыграла дискуссия между Л. Пастером и Марселеном Бертло. Работы М. Бертло внесли громадный вклад в развитие синтетической органической химии. Им были осуществлены реакции получения уксусной и муравьиной кислот, проведен синтез этанола из этилена, синтез жиров из глицерина и карбоновых кислот, синтез бензола из ацетилена, созданы основы газовой электрохимии и проведен синтез ацетилена в электрическом разряде.
На то, что брожение имеет характер каталитического процесса, указывал Эйхальд Митчерлих. В 1843 г. он отмечал, что для проведения процесса сбраживания сахара необходимо незначительное количество дрожжей (менее 1 %), несоизмеримое с количеством конвертированного субстрата, т. е. вкладом дрожжей как вещества в материальный баланс реакции можно пренебречь.
Дискуссия закончилась, но участники остались при своем мнении. Необходимо отметить: авторитет JI. Пастера был настолько высок, что его мнение, что лишь живые клетки микроорганизмов являются носителями процессов конверсии вещества, господствовало среди микробиологов длительное время. Его влияние на исследователей ощущалось и в XX в.
Эйхальд Митчерлих (1794-1863)
Особую роль в дискуссии сыграла неоднозначность в терминах, существовавшая в те годы. В течение многих лет дрожжи называли ферментом.
Точку в этом историческом споре поставили опыты Э. Бухнера (1897 г.), который продемонстрировал возможность проведения процесса брожения под действием бесклеточных экстрактов. Э. Бухнер механически разрушал клетки дрожжей, наблюдая за процессом под микроскопом, проводил экстракцию водой с отделением жидкости от твердых частиц фильтрованием под высоким давлением. Полученный раствор смеси ферментов был способен к интенсивному выделению спирта и СО2 при введении его в раствор сахарозы. На реакцию не действовали классические антисептики. Опыты показали, что брожение — результат действия ферментов, не зависящего от целостности клетки. В 1907 г. Э. Бухнеру была присуждена Нобелевская премия по химии.
Результатом работы большой группы исследователей, начиная с К. Кирхгофа, И. Берцелиуса, заканчивая В. Оствальдом и Э. Бухнером, явилось утверждение, что ферменты — это химические катализаторы и необходимо искать объяснения действия ферментов на химической основе.
Таким образом, стало ясно следующее.
В клетках микроорганизмов, растений, животных, человека имеются вещества, обладающие исключительно высокой каталитической активностью.
Биологические катализаторы способны ускорять как простейшие химические реакции (инверсию сахара, гидролиз белков, реакции окисления), так и сложные процессы, такие как диспропорционирование сахара в этанол и СО2.
Важным результатом была демонстрация того факта, что биокаталитической функцией обладают белки. Наиболее четко это было сформулировано немецким исследователем М. Траубе. В 1858 г. он в рамках своего представления о действии ферментов охарактеризовал ферменты как химические вещества белковой природы. Этому предшествовал этап накопления экспериментальных фактов.
В 1830 г. П. Робике и А. Бутрон-Шаляр исследовали гидролиз аминдалина под действием измельченного горького миндаля. В 1831 г. Э. Лейксом было обнаружено, что слюна обладает активностью диастазы. Впервые достаточно очищенный препарат фермента удалось получить А. Пайену и Ж. Персу в 1833 г. Они выделили амилазу из солода, осадив ферментный препарат спиртом. Аналогичными методами удалось получить ферментный препарат синигриназы (Ж. Форс, 1835 г.), пепсина (Т. Шванн, 1836 г.), трипсина (Л. Корвизар, 1857 г.). Заметную роль в развитии методологии выделения ферментов сыграли работы Э. Брюкке и А. Я. Данилевского, которые использовали явление адсорбции для разделения белков. В 1862 г. А. Я. Данилевскому впервые удалось разделить трипсин и панкреатическую амилазу. Эти работы стали основой современных методов получения белков.
Следующий этап исследования ферментов связан с осознанием того факта, что ферменты обладают способностью взаимодействовать лишь с избранными субстратами, т.е. обладают специфичностью. Также было доказано, что субстрат в процессе каталитической реакции образует лабильный комплекс с белком. Детальное исследование ряда систем позволило Эмилю Фишеру сформулировать представления о специфичности ферментативного катализа. Э. Фишер — выдающийся химик-органик. Он занимался изучением природы белков, сахаров, красителей, азотистых оснований, дубильных веществ. Э. Фишер гидролитически расщепил белки и показал, что все белки построены из аминокислот. Ряд аминокислот он получил встречным синтезом.
Э. Фишер синтезировал дипептиды и олигопептиды. В 1907 г. им синтезирован пептид, состоящий из восемнадцати различных аминокислот. В 1894 г. Э. Фишер начал цикл работ по изучению специфичности действия ферментов. Эти работы были продолжением его исследований структуры сахаров и пептидов. Для объяснения специфичности действия ферментов Э. Фишер сформулировал положение о том, что субстрат подходит к ферменту, как ключ к замку. Это положение не потеряло актуальности и сегодня лежит в основе представлений о стерическом соответствии между субстратом и ферментом.
Выдающиеся работы были выполнены Э. Фишером в области химии углеводов и красителей. Работы Э. Фишера заложили основы изучения нуклеиновых кислот. За исследования сахаров и пуриновых производных в 1902 г. Э. Фишер был удостоен Нобелевской премии по химии.
То, что фермент взаимодействует с субстратом и образует фермент-субстратный комплекс, следовало из анализа кинетики каталитической реакции. Изучение кинетических закономерностей действия ферментов начиналось на этапе развития химической кинетики.
Впервые скорость ферментативных реакций анализировал Г. Тамман. Он провел тщательное сравнительное исследование действия ферментов и химических катализаторов реакции гидролиза и показал, что ферментативный гидролиз гликозидов и дисахаридов аналогичен классическому кислотному, исследуемому со времен К. Кирхгофа. Г. Тамман впервые изучил температурные зависимости скорости ферментативной реакции. Результаты работы были опубликованы в 1892 г. в журнале русского физико-химического общества и впоследствии в журнале физической химии, издаваемом Я. Вант-Гоффом и В. Оствальдом.
Завершенную форму химико-кинетические исследования приобрели в работах Луи Анри (1834 — 1913) и Леона Михаэлиса. Из кинетических данных однозначно следовало, что в процессе каталитического действия фермент образует комплекс с субстратом. Интерпретация Л. Анри и Л. Михаэлисом роли этого комплекса была различной, однако оба подхода для объяснения экспериментальных данных постулировали образование фермент-субстратного комплекса.
Значительный вклад в фундамент кинетики ферментативного катализа внесли работы Э. Армстронга (1904 г.), обнаружившего эффекты ингибирования ферментативных реакций аналогами субстрата, и С. Соренсена (1868 — 1939), продемонстрировавшего зависимость скоростей ферментативных реакций от концентрации ионов водорода.
Явления брожения и переваривания известны с незапамятных времен, однако зарождение учения о ферментах (энзимология) относится к первой половине XIX в. Первое научное представление о ферментах было дано еще в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты, в частности пепсин и трипсин, вызывающие распад (гидролиз) белков в пищеварительном тракте.
Наибольшее внимание исследователей привлекали процессы окисления в организме. Уже был известен феномен химического катализа, означающий, что многие реакции in vitro протекают быстро и энергично в присутствии ничтожных количеств примесей, как будто не участвующих в реакции. Так, была установлена большая каталитическая роль ряда неорганических веществ. Горение глюкозы на воздухе, например, протекает очень медленно, а если добавить немного солей лития (или золы, также содержащей ничтожные количества лития), то горение идет весьма интенсивно:
Биологические катализаторы, т.е. ферменты, как оказалось, не вызывают в отличие от неорганических катализаторов каких-либо побочных реакций и не участвуют в реакциях, невозможных по термодинамическим условиям; и те, и другие катализаторы только ускоряют химические реакции, обычно протекающие очень медленно. Примером может служить реакция расщепления перекиси водорода на кислород и воду, медленно протекающая в отсутствие катализатора. При добавлении мелкораздробленной платины скорость этой реакции резко возрастает:
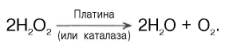
Эта же реакция будет протекать намного быстрее в присутствии фермента каталазы, содержащейся, в частности, в эритроцитах, причем образуются те же конечные продукты распада перекиси водорода.
Таким образом, можно считать установленным, что ферменты катализируют ряд химических реакций, аналогичных химическим реакциям, катализируемым неорганическими веществами. Более того, считается установленным, что любую из протекающих в живых организмах (или клетках) химическую реакцию можно в принципе осуществить вне организма (или вне клетки), если экспериментатору удается выделить соответствующий фермент (или систему ферментов), катализирующий данную реакцию, и создать оптимальные условия для его действия.
Читайте также:

