Набухание и растворение высокомолекулярных соединений кратко
Обновлено: 04.07.2024
Высокомолекулярные соединения (ВМС) — вещества, молекулы которых состоят из большого числа химически связанных атомов.
Выделяют следующие виды:
- Природного происхождения — белки, пектины, полисахариды
- Синтетические — пластмасса
Природные ВМС являются структурной основой всех живых организмов.
Растворы ВМС: определение
Растворы ВМС — это гомогенные, термодинамически — равновесные, агрегативно-устойчивые соединения. Одним словом, истинные растворы.
Описание лекарственной формы — сложная, жидкая, для наружного/внутреннего применения, раствор ВМС.
Отличительные свойства ВМС от НМС
ВМС от НМС отличаются следующим:
- растворы ВМС имеют малую скорость диффузии
- малое осмотическое давление
- большая вязкость
- фильтрация через бумажный фильтр возможна для невязких растворов ВМС; под воздействием электролитов, спирта, глицерина возможно явление высаливания (дегидратация)
- растворы ВМС имеют специфические свойства: светорассеивание и тиксотропия (способность в изотермических условиях самопроизвольно восстанавливать свою структуру после механического разрушения)
- растворение ВМС происходит самопроизвольно, но через стадию набухания, при этом объем и масса полимера увеличивается, за счет растворения части растворителя. Процесс происходит достаточно медленно.
Процесс набухания ВМС
Процесс набухания различен:
- ограниченным (желатин в воде при комнатной температуре)
- неограниченным (набухание проходит максимально и затем полимер растворяется — желатин в горячей воде)
Ограниченно набухший полимер — студень.
Факторы, влияющие на процесс набухания и растворения:
- Степень полярности
- Гибкость цепей полимера
- Молярная масса полимера
- Температура
- рН среды
- Присоединение электролитов
Растворы ВМС — устойчивые системы, но может происходить высаливание, коацервация (расслоение коллоидной системы с образованием коллоидных скоплений) и застудневание.
Для разрушения раствора ВМС концентрация электролита должна быть достаточно большая.
Коацерват — новая жидкая фаза, обогащенная полимером. Как явление характерна для белков.
В результате коацервации раствор ВМС делится на 2 фазы:
- раствор ВМС в растворителе
- раствор растворителя в ВМС
Внешне выглядит в виде капель. Может наступить при низкой температуре, введении в раствор электролитов в большом количестве, изменении рН среды. Используют при микрокапсулировании.
Примеры приготовления растворов ВМС
Пример №1:
Rp.: Acidi hydrochlorici 4ml
Aq. purificatae 150 ml
Пепсин — неограниченно набухающее ВМС, устойчив в слабокислой среде, в аптеках с 1-2% раствором НСL готовится неограниченным методом, т.к. пепсин инактивируется в сильных кислотах, то большое значение имеет порядок смешивания.
Сначала готовят раствор HCL и затем в нем растворяют пепсин. Фильтруют через стеклянный фильтр (бумажные фильтры не берут, т.к. на них пепсин адгезируется).
V(общий) = 150+4мл = 154 мл
Пример №2:
Желатин — ограниченно набухающий раствор ВМС.
В тарированную чашку насыпают рассчитанное количество желатина. Затем добавляют воду очищенную комнатной температуры. Оставляют на 40 минут, добавляют оставшуюся часть воды, нагревают на водяной бане до растворения желатина. Охлажденный раствор фильтруют через двойной слой марли в отпускной флакон.
Пример №3:
Крахмал — ограниченно набухающее ВМС.
Растворы крахмала готовят по массе. Если концентрация раствора не указана, то готовят по прописи ГФ 7 (2% крахмал). Берут 1 часть крахмала, 4 части холодной воды, 45 частей горячей воды (всего должно получится 50 частей). Готовим как 10% крахмальный клейстер.
Технология: На весах отвешивают 1,0 г крахмала и смешивают с 4 мл воды очищенной холодной. В фарфоровую чашку отмеривают 45 мл воды очищенной, доводят ее до кипения и тонкой струйкой, при помешивании, добавляют весь крахмал в воде очищенной. Раствор доводят до кипения, кипятят 1-2 минуты до осветления и загустения жидкости.
Коллоидные растворы
Характеристика:
Растворы защищенных коллоидов — это гетерогенные дисперсные системы (состоят из агрегатов атомов и молекул (мицелл)).
Коллоидные растворы характеризуются феноменом Тидаля (кажутся, особенно в отраженном свете, опалесцирующими, мутноватыми или мути). В отличие от истинных растворов из-за относительно большой массы частиц обладают очень малым осмолярным давлением. Легко проходят через стандартные фильтры, но не проникают через фильтры с очень малыми порами.
При добавлении необходимого количества электролитов коллоидные частицы выпадают в осадок.
Увеличение температуры способствует коагуляции (частицы укрупняются и осаждаются).
Характерная особенность коллоидных растворов: под влиянием ничтожных причин (добавления незначительного количества электролитов, увеличение температуры, механической обработки, света), а иногда самопроизвольно, коллоидные растворы разрушаются. При этом раствор мутнеет, превращается в суспензию, в результате выпадает в осадок или застывает, превращаясь в студень.
Растворение происходит при непосредственном прикосновении частиц препарата с водой. Для некоторых коллоидных препаратов этот процесс ускоряют растиранием с частью растворителя (колларгол, ихтиол).
Для уменьшения длительности набухания некоторые коллоидные вещества (протаргол) насыпают тонким слоем на поверхность растворителя. Если коллоидный препарат прописан в растворе вместе с электролитом, то сначала растворяют коллоидное вещество, затем добавляют электролит,лучше в виде водного раствора.
Фильтрование коллоидных растворов:
Через бумажные фильтры не производят (бумага адсорбирует коллоидные частицы). Процеживают только при необходимости через ватные тампоны, марлю или стеклянные фильтры №1, 2.
Применение:
В фармацевтической практике используют растворы ихтиола, протаргола, колларгола. Применяют как:
- антисептические,
- противовоспалительные,
- вяжущие,
- для смазывания слизистых оболочек верхних дыхательных путей,
- спринцеваний,
- промывания гнойных ран,
- как капли в нос.
Растворы ихтиола
Ихтиол почти черная с буроватым оттенком жидкость, растворимая в воде, глицерине. Природный защищенный коллоид.
Rp.: Jchthyoli 5% — 150 ml
D.S. для компрессов.
Данная лекарственная форма — жидкая, сложная, для наружного применения, коллоидный раствор.
В фарфоровую чашку отвешиваем ихтиол 7,5 г (по приказу №308). Тщательно размешиваем пестиком с небольшим количеством воды и при непрерывном помешивании добавляем остаточную воду. Готовый раствор процеживаем через вату или марлю в отпускной флакон.
Оформление: по рецепту
Срок годности смотрим в приказе №214.
Растворы колларгола
Колларгол — препарат коллоидного серебра, содержит 70% серебро. При обработке водой он набухает и растворяется, образуя темные золи, быстро подвергающиеся старению, готовят экстемпоро. Легко коагулируют при действии кислот и солей тяжелых металлов, щелочи стабилизируют растворы (удлиняют срок действия).
В некоторых случаях для ускорения процесса колларгол растирают в ступке с водой до растворения, если концентрация > 0,5%.
Rp.: Collargoli 1% — 150 ml
D.S. Для спринцеваний (готовим в асептических условиях)
Cмах = 3/0,61 = 4,92
Смах (4,92%) > Cвып. (1%), поэтому объем не изменяем
В фарфоровую ступку отвешиваем 1,5 грамма колларгола, добавляем небольшое количество воды очищенной. Оставляем на несколько минут для набухания, растираем пестиком, при помешивании добавляем частями оставшуюся воду, при необходимости раствор процеживаем через ватный тампон, обработанный крутым кипятком, т.к. содержит серебро — сильный окислитель. Переливаем во флакон из оранжевого стекла.
Растворение высокомолекулярных веществ принято рассматривать как процесс, аналогичный смешению двух жидкостей, в котором имеет значение как энергетическое взаимодействие между молекулами растворяемого вещества и растворителя (энергетический фактор), так и действие фактора, обусловливающего равномерное распределение молекул растворенного вещества в растворе (энтропийный фактор).
Самопроизвольное растворение ВМС, равно как и всяких других веществ, должно сопровождаться уменьшением изобарного термодинамического потенциала. Согласно химической термодинамике
G = H - T S ,
где G - изобарно-изотермический потенциал; Н - теплосодержание или энтальпия; Т - абсолютная температура; S - энтропия.
Очевидно, чтобы уменьшился термодинамический потенциал и произошло самопроизвольное растворение высокополимера, изобарно-изотермический потенциал должен иметь отрицательное значение. Это возможно в двух случаях: а) Н S > 0. Первое условие (Н
Второе условие ( S > 0) при растворении выполняется всегда, так как энтропия смешения, как правило, положительна. Исследования, произведенные в последние годы, показали, что при растворении высокополимеров энтропия смешения обычно значительно превышает идеальную энтропию. Это объясняется тем, что при растворении высокополимеров возрастает возможность движения в растворе отдельных участков (сегментов) гибких цепных молекул, причем, каждая может осуществлять большое число конфигураций. В предельно разбавленном растворе, когда макромолекулы будут находиться на значительном расстояниях друг от друга, они могут практически принимать любые конфигурации. Таким образом, при растворении ВМС система переходит из менее вероятного в более вероятное состояние и соответственно вероятностная функция, характеризующая процесс (энтропия), должна возрастать.
Благодаря аномально большим значениям энтропии, при растворении многих высокополимеров энтропийный фактор играет решающую роль, особенно при растворении полимеров с неполярными молекулами, когда растворение сопровождается поглощением тепла (Н > 0).
Первой стадией растворения высокомолекулярных веществ с линейными молекулами, в отличие от растворения низкомолекулярных веществ, является набухание. При набухании высокополимер поглощает низкомолекулярный растворитель, значительно увеличивается в весе и в объеме без потери микроскопической однородности. Объем ВМС при набухании может увеличиваться до 1000-1500 %.
С набуханием не следует смешивать процесс капиллярного поглощения растворителя, при котором жидкость заполняет микропустоты, имеющиеся в твердом теле. Размеры твердого тела при этом обычно не увеличиваются.
Например, такие вещества с жесткой пространственной структурой, пронизанные большим числом капилляров, как силикагели (туф, пемза, искусственные пермутиты и т.п.) поглощают большое количество воды, но этот процесс называют не набуханием, а оводнением. Механизм этого явления ничего общего с набуханием не имеет.
Причиной набухания является диффузия молекул растворяемого вещества и, наоборот, молекул растворителя в высокомолекулярное вещество. Последнее связано с тем, что молекулы аморфных ВМС обычно упакованы неплотно, расстояния между ними в результате теплового движения увеличиваются и в пустоты могут проникнуть маленькие молекулы растворителя. Так как последние более подвижны, то сначала происходит, главным образом, диффузия молекул растворителя в высокополимер; это сопровождается увеличением объема последнего и когда связь между макромолекулами будет ослаблена, они также начинают диффундировать в среду и образуется однородный истинный раствор. Так набухают каучуки в бензоле, нитроцеллюлоза в ацетоне, белок в воде. Чем больше молекулярный вес ВМС, тем медленнее идет процесс набухания и растворения. Имеет значение форма и размеры молекулы. Например, высокополимеры со сферическими молекулами при растворении не набухают или набухают очень слабо. Это указывает, что диффузия не может рассматриваться как единственный фактор, управляющий набуханием. В данном случае малая когезионная энергия ВМС со сферическими частицами облегчает их растворение.
Описанная картина набухания ВМС с линейными макромолекулами имеет место тогда, когда энергетическое взаимодействие между молекулами растворяемого вещества и растворителя незначительно или практически равно нулю, т.е. когда растворение и набухание носит чисто энтропийный характер (например при растворении каучуков в углеводах). Если же молекулы растворителя энергетически взаимодействуют с молекулами ВМС, как, например при растворении желатина в воде, то механизм растворения усложняется. В этом случае первой стадией является сольватация макромолекул в результате диффузии в ВМС растворителя. Эта стадия характеризуется выделением тепла и упорядоченным расположением молекул растворителя около макромолекул. В результате упорядоченного расположения молекул растворителя в первой стадии растворения энтропия системы обычно даже понижается. Значение этой стадии растворения сводится к разрушению связей между отдельными макромолекулами, вследствие чего цепи становятся свободными и способными совершать тепловое движение в целом.
Второй стадией является набухание или растворение, обусловленное чисто энтропийными причинами.
Набухание не всегда завершается растворением. Во многих случаях после достижения известной степени набухания процесс прекращается. Причина такого явления заключается в том, что ВМС и растворитель способны смешиваться ограниченно. В результате после установления равновесия система будет состоять из двух фаз: насыщенного раствора высокополимера в растворителе (собственно раствор) и насыщенного раствора растворителя в (гель, студень). Этот случай ограниченного набухания имеет много общего с ограниченным растворением двух низкомолекулярных жидкостей. Примером ограниченного набухания является набухание при комнатной температуре поливинилхлорида а ацетоне, желатина и целлюлозы в воде.
Ограниченное набухание при изменении условий опыта часто переходит в неограниченное. Так, например, желатина и агар-агар, набухающие ограниченно в холодной воде, в теплой воде набухают неограниченно.
Набухание характеризуется степенью набухания, величина которой определяется количеством жидкости в граммах поглощаемой на данной стадии набухания и при данной температуре одним граммом высокополимера:
где m 1 масса полимера до набухания; m 2 - его масса после набухания.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ НАБУХАНИЕ
Скорость набухания с повышением температуры растет, а степень предельного набухания уменьшается, если процесс набухания сопровождается выделением тепла.
С ростом внешнего давления степень набухания всегда повышается, что вытекает из принципа Ле-Шателье, если учитывать, что суммарный объем системы из растворителя и растворяемого вещества при набухании уменьшается.
Влияние pH среды на набухание хорошо изучено для белков и целлюлозы: минимум набухания лежит в области изоэлектрической точки (например для желатины при pH =4,7), по ту и другую сторону, от которой степень набухания возрастает и, достигнув максимумов, вновь начинает уменьшаться.
Такое влияние pH на набухание связано с тем, что в изоэлектрической точке заряд макромолекул белков минимален, а вместе с этим минимальна и степень гидратации белковых ионов.
Влияние электролитов также хорошо изучено для белков и целлюлозы. На процесс набухания оказывают влияние, главным образом, анионы, причем влияние последних своеобразно. Одни из них усиливают набухание, другие ослабляют. Это дало возможность все анионы расположить в закономерный ряд, получивший название лиотропного ряда набухания, или ряда Гофмейстера (по имени ученого, впервые открывшего это явление в 1891 г .):
Роданид > иодид > бромид > нитрат > хлорат.
Хлорид > ацетат > цитрат > тартрат > сульфат.
В первом ряду все анионы усиливают набухание в нисходящем порядке, т. е. максимальное усиление (для желатины вплоть до перехода набухания в полное растворение даже при комнатной температуре) дают роданид CNS - и иодид I - , а наименьшее - хлорат CIO 3 . Во втором ряду первый анион - хлорид CI - занимает переходное положение, а последующие анионы не только не усиливают набухания, а наоборот, все более тормозят этот процесс, причем максимальное в этом смысле влияние оказывает сульфат - ион SO 4 2- .
Такое действие анионов на набухание в полной мере проявляется только тогда, когда растворы электролитов достаточно концентрированы, а среда является нейтральной или слабощелочной. В кислой среде все анионы уменьшают набухание.
Измельчение высокополимера, приводящее к увеличению его общей поверхности, увеличивает скорость набухания.
Набухание является процессом экзотермическим. Тепловой эффект процесса получил название теплоты набухания. Определение теплоты набухания имеет большое значение характеристики степени сольватации высокополимеров.
Представляет особый интерес вопрос о формах, в которых растворитель существует в набухших высокополимерах. Так, для воды, как растворителя, различают две основные формы ее существования в набухших полимерах: связанную, иначе - гидратационную воду и воду свободную (несвязанную) - капиллярную. Особую разновидность связанной воды представляет кристаллизационная вода в кристаллогидратах.
В зависимости от природы полимера, температуры, давления изменяется не только общее количество связанной воды при набухании, но связанная вода в полимерах обладает и особыми физическими свойствами, отличными от свойств обычной воды. Так, ее плотность достигает 2 г/см 3 , т. е. почти в два раза больше чем у обычной воды, диэлектрическая постоянная вместо 81 имеет значение около 2,2 что обусловливает ее пониженную способность растворять электролиты и полярные неэлектролиты; изменяются упругость пара и температура замерзания.
Набухание ВМВ всегда сопровождается характерным явлением - давлением набухания, которое в отдельных случаях достигает десятков и сотен атмосфер. Это давление эквивалентно внешней по отношению к системе силе, которую нужно приложить, чтобы задержать увеличение объема набухающего полимера. Разрушительное действие такого давления подтверждается следующим примером. Корни растений произрастающих горах и предгорьях проникая в трещины в породах, набухают под давлением попадающей сюда воды, в результате чего трещиноватость пород увеличивается и горные породы разрушаются.
Набухание играет исключительно важную роль как в повседневной жизни человека, так и во многих технологических процессах. Например, перевод пищевых продуктов в усвояемое организмом состояние сводится в основном к процессам набухания.
В физиологических процессах, протекающих в растительных и животных организмах, набухание так же имеет большое значение. Зерно, прежде чем взойдет, должно набухнуть. Благодаря набуханию поддерживается определенное состояние клеток в организме.
Нельзя себе представить без набухания производство клеящих веществ, обуви и кожгалантереи, процесс изготовления пироксилиновых порохов, затвердевание (схватывание) цемента и т.д.
НАРУШЕНИЕ УСТОЙЧИВОСТИ В РАСТВОРАХ ВЫСОКОМОЛЕКУЛЯРНЫХ ВЕЩЕСТВ
Растворы высокомолекулярных веществ, если они находятся в термодинамически равновесном состоянии, обладают, как и истинные растворы, абсолютной агрегативной устойчивостью. Поэтому теории устойчивости лиофильных коллоидных систем (растворов высокополимеров), например, теория Кройта, в которой агрегативную устойчивость желатина, агар-агара и некоторых других веществ объясняли либо электрическим зарядом, либо сольватацией, или, наконец, действием того и другого фактора одновременно, имеет в данное время только историческое значение.
Под влиянием ряда факторов - введения электролитов, изменения температуры - в растворах полимеров может происходить помутнение, уменьшение осмотического давления, изменение вязкости, т. е. явления, сходные с теми, которые наблюдаются при скрытой коагуляции типичных коллоидных систем. Однако эти явления не следует отождествлять с коагуляцией, так как природа указанных изменений высокополимеров совершенно иная.
Коагуляция лиофобных золей происходит при введении сравнительно небольших количеств электролита и представляет собой необратимое явление. Выделение же из раствора ВМС происходит при добавлении относительно больших количеств электролита и является, как правило, вполне обратимым процессом, - после удаления из осадка электролита промыванием или диализом ВМВ снова становится способным к растворению.
Коагуляция лиофобных систем обычно происходит в результате сжатия двойного электрического слоя и уменьшения или полного исчезновения электрического заряда, являющегося для данных систем основным фактором устойчивости. Выделение из раствора высокополимера при добавлении большого количества электролита объясняется уменьшением растворимости высокомолекулярного вещества в концентрированном растворе электролита.
Подобные явления имеют место и в растворах низкомолекулярных веществ. Ранее было отмечено, что при введении в водноспиртовой раствор поташа гомогенная система разделяется на два жидких слоя. Это явление называется высаливанием. По аналогии выделение из раствора ВМВ под действием электролитов следует называть не коагуляцией, а высаливанием.
Высаливающее действие соответствует тому положению иона, которое он занимает в лиотропном ряду. Так, катионы и анионы по мере уменьшения их высаливающего действия могут быть расположены в следующие ряды:
Ряд катионов Li + > Na + > K + > Rb + > Cs +
Ряд анионов SO4 2- > CI - > NO3 - > Br - > I - > CNS -
Положение ионов в рядах обратно тому, которое они занимают в лиотропных рядах для набухания. Чем больше ион способен связывать растворитель, тем больше он будет уменьшать способность среды растворять высокомолекулярное вещество, т. е. лучше высаливать.
Электролиты обычно способствуют процессам ассоциации макромолекул и структурообразования в растворах высокополимеров. За счет слипания макромолекул в отдельных местах могут образоваться сетки, превращающие раствор в студень. Этот вопрос будет рассмотрен в дальнейшем.
В растворах высокомолекулярных веществ при изменении температуры или pH или при введении низкомолекулярных веществ иногда наблюдается так называемая коацервация. Это явление, присущее только неравновесным системам, заключается в разделении системы на две фазы, из которых одна представляет собой раствор высокомолекулярного вещества в растворителе, а другая - раствор растворителя в высокомолекулярном веществе. Раствор более богатый высокомолекулярным веществом обычно выделяется в виде мельчайших капелек, которые в дальнейшем могут образовать сплошной слой. Когда растворителем является полярная жидкость, например вода, капельки могут при определенных условиях приобретать заряд, что доказывается их способностью к электрофорезу.
Если мельчайшие капельки коацерватов не обладают достаточной агрегативной устойчивостью, то они могут соединяться друг с другом, образуя флокулы, способные всплывать или опускаться на дно в виде рыхлого осадка. Флокуляция имеет большое значение в биологии и медицине.
Явление старения. Это явление в основном проявляется в самопроизвольном изменении вязкости растворов высокомолекулярных веществ. Ранее, когда к растворам ВМС подходили с тех же позиций, как и к типичным коллоидным растворам, изменения вязкости объясняли медленно протекающими процессами пептизации или наоборот, агрегирования. В настоящее время, когда доказана гомогенность растворов ВМС, такое объяснение не может быть признано обоснованным. В данное время изменения вязкости растворов ВМС при стоянии объясняют воздействием на молекулярные цепи присутствующего в системе кислорода. Кислород может вызывать деструкцию макромолекул, либо приводить к связыванию отдельных нитевидных молекул в большие образования. В первом случае будет происходить уменьшение вязкости, во втором - увеличение.
Аналогично действовать на вязкость растворов высокомолекулярных соединений способны и некоторые другие примеси.
Растворение высокомолекулярных соединений представляет собой сложный процесс, отличающийся от растворения низкомолекулярных веществ. Так, при растворении последних происходит взаимное смешение растворителя и растворяемого вещества, т.к. они имеют близкие по размерам и по скорости диффузии молекулы.
Подробно этот процесс рассматривался нами выше.
При растворении полимеров вначале происходит процесс их набухания, т.е. одностороннее проникновение небольших и подвижных молекул растворителя в полимер. Набухание сопровождается увеличением массы и размеров твердого образца полимера и является начальным этапом растворения высокомолекулярных веществ. Различаютограниченное и неограниченное набухание.
При ограниченном набуханииобъем и масса растворяемого образца полимера увеличивается до определенных пределов и дальнейший его контакт с растворителем не приводит к каким-либо изменениям. В результате ограниченного набухания полимер превращается в студень.
При неограниченном набуханииотсутствует предел набухания. Со временем образец полимера поглощает все большее количество жидкости и в результате в конечном итоге происходит его постепенное растворение.
Ограниченное набухание происходит, например, при помещении резины в гексан. Каучук в этом же растворителе набухает неограниченно.
Причиной набухания является, как уже было сказано выше, односторонняя диффузия низкомолекулярного растворителя в полимер.
Между его макромолекулами в твердом образце всегда имеются небольшие промежутки (полости или пустоты), размеры которых соизмеримы с размером молекул растворителя. Благодаря этому, последние достаточно быстро проникают в них, раздвигая молекулярные цепи. Происходит этот процесс постепенно, соседние макромолекулы удаляются друг от друга не сразу, а небольшими участками. Если макромолекулы полимера гибкие, то, благодаря их тепловому движению, диффузия растворителя облегчается. Полимеры с жесткими молекулярными цепями набухают значительно хуже.
Для многих веществ набухание включает не только диффузию жидкости в полимер, но и сольватацию его молекул. Обычно при этом сольватируется не вся макромолекула, а отдельные ее участки.
У биополимеров, макромолекулы которых состоят из полярных и неполярных групп, сольватируются полярные группы, если растворитель полярен. В неполярном растворителе, соответственно, сольватируются неполярные участки макромолекул.
В зависимости от того, каких групп в молекуле больше, полимер будет лучше набухать в том или ином растворителе. Обычно он хорошо набухает в жидкости, близкой к нему по химическому строению. Так, углеводородные полимеры типа каучуков набухают в неполярных жидкостях: гексане, бензоле. Биополимеры, в состав молекул которых входит большое количество полярных функциональных групп, например, белки, полисахариды, лучше набухают в полярных растворителях: воде, спиртах и т.д.
Процесс сольватации сопровождается разрывом межмолекулярных связей соседних макромолекул, что, в свою очередь, способствует их удалению друг от друга при набухании.
Образование сольватной оболочки молекулы полимера сопровождается выделением энергии, которая называется теплотой набухания.
Теплота набуханиязависит от природы веществ. Она максимальна при набухании в полярном растворителе ВМС, содержащего большое количество полярных групп и минимальна при набухании в неполярном растворителе углеводородного полимера.
Молекулы растворителя в сольватной оболочке более плотно упакованы (благодаря ориентации их около сольватируемых групп макромолекул) чем в самой жидкости. В результате сжатия растворителя в сольватных оболочках на первой стадии набухания, наряду с увеличение объема полимера, наблюдается уменьшение суммарного объема всей системы (рис. 73б). Данное явление называется внутренним сжатием или контракцией. В принципе оно наблюдается и в растворах низкомолекулярных соединений (особенно в концентрированных растворах).

Рис. 73. Стадии ограниченного набухания: а – система полимер – растворитель до набухания;б – первая стадия набухания;в – вторая стадия набухания;г– вторая стадия набухания с частичным растворением полимера
После сольватации полимера процесс его набухания протекает быстрее, т.к. сольватированые макромолекулы легче отодвинуть друг от друга. На этой второй стадии набухания происходит основное увеличение объема твердого образца.
В конце этой стадии может происходить переход некоторого числа макромолекул полимера в растворитель (рис. 73г). Обычно на этой стадии заканчивается ограниченное набухание. Неограниченное набухание идет дальше и приводит к полному растворению полимера и образованию гомогенной системы (рис. 74).

Рис. 74. Образование истинного раствора ВМС при неограниченном набухании
Процесс набухания количественно характеризуется степенью набухания, α:
= ;=
где m0, V0 – соответственно, масса и объем образца полимера до набухания; m и V – масса и объем образца полимера после набухания.
Степень и, соответственно, вид набухания зависят от многих факторов. Главными из них являются прочность межмолекулярных связей в полимере и энергия его сольватации. Если для линейного полимера на разрыв межмолекулярных связей затрачивается энергии значительно меньше, чем выделяется при сольватации, то его набухание, как правило, будет неограниченным, в противном случае полимер будет набухать ограниченно.
Поперечные (мостичные) связи между молекулами полимера приводят к ограниченному набуханию, т.к. энергии сольватации обычно недостаточно для их разрыва. Так, натуральный каучук (линейный полимер) неограниченно набухает (растворяется) в гексане, резина (вулканизированный каучук) набухает ограниченно, эбонит совершенно не набухает (т.к. в нем присутствует особенно много мостичных связей).
На степень набухания влияет также разветвленность макромолекул и их масса. Значительное воздействие оказывает температура. При ее повышении степень набухания, как правило, увеличивается. Так, желатин и агар-агар в холодной воде набухают до определенного предела, т.е. ограниченно. При нагревании они же набухают неограниченно и образуют истинные растворы.
На набухание могут влиять также такие факторы, как рН среды, присутствие в растворителе электролитов. Влияние данных факторов особенно усиливается, если их воздействие приводит к образованию или исчезновению на макромолекуле ВМС электрического заряда. Причем в первом случае интенсивность и степень набухания возрастают пропорционально заряду макромолекулы, а во втором, наоборот, – уменьшаются.
Особенно чувствительны к изменению рН среды и концентрации в растворе электролитов полимеры, содержащие в своем составе ионогенные функциональные группы. Из природных биополимеров к ним относятся белки, нуклеиновые кислоты, некоторые полисахариды.
Растворимость и степень набухания в значительной мере зависят от гибкости цепи полимера и от его молекулярной массы.
Наибольшей гибкостью обладают углеводородные цепи, не содержащие полярных группировок атомов. В неполярных растворителях многие такие вещества способны растворяться практически неограниченно.
Макромолекулы, содержащие большое число полярных групп, вследствие возникновения межмолекулярных водородных связей являются жесткими, способны образовывать небольшое число конформаций и очень часто в полярных растворителях могут только ограниченно набухать, несмотря на то, что при их сольватации выделяется значительное количество энергии.
Увеличение молекулярной массы негативно сказывается на процессе набухания и растворения полимера, т.к. при этом увеличиваются Ван-дер-Ваальсовые силы притяжения между макромолекулами. Следовательно, возрастает и энергия, затрачиваемая на их расталкивание друг от друга.
Технологии и оборудование для изготовления красок, ЛКМ
Набухание и растворение высокомолекулярных соединений
2 ноября, 2012 admin
Взаимодействие полимеров с растворителем имеет большое значение при переработке полимеров, их применении, в биологических процессах и др. Например, белки и полисахариды в живых организмах и растениях находятся в набухшем состоянии. Многие синтетические волокна и пленки получают из растворов полимеров. Растворами полимеров являются лаки и клеи. Определение свойств макромолекул, в том числе молекулярных масс, проводят, как правило, в растворах. Пластификация полимеров, осуществляемая в производстве изделий, основана на набухании полимеров в растворителях — пластификаторах. Вместе с тем для практического применения полимеров^ важным свойством является устойчивость их в растворителях. Для решения вопросов о возможном набухании, растворении: полимера в данном растворителе или об его устойчивости по — отношению к этим процессам необходимо знать закономерности взаимодействия полимеров с растворителями.
Взаимодействие полимеров с растворителями обычно начинается с набухания. Процесс набухания состоит в поглощении растворителя веществом, объем и масса которого при этом Увеличиваются. Набухание наиболее характерно ДЛЯ высокомоЛекулярных соединений. В результате набухания их объем и
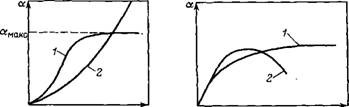
Рис. VI.9. Изотермы ограниченного (/) и неограниченного (2) набухания-
Р и Ps — давление насыщенного пара растаорнтеля соответственно над набухшим полимером и над чистым растворителем
Рис. VI.10. Кинетические кривые ограниченного (/) и неограниченного (2) набухания
Масса могут увеличиваться в 10—15 раз. Неорганические материалы, обладающие жесткой структурой, мало «способны к набуханию. Они могут удерживать жидкости в порах в основном вследствие адсорбции и капиллярных явлений; при этом их структура, а следовательно, и объем не изменяются.
Масса жидкости, поглощенная единицей массы вещества прис данной температуре, называется степенью набухания:
О = (га2— гаї) /ті (VI.58);*
Где тх и тг — масса вещества до и после набухания соответствеиио.
Характеристики набухания аналогичны характеристикам сорбции. Основной из них является изотерма набухания, которая показывает зависимость степени набухания от термодинамической активности растворителя (от давления его пара) при: данной температуре. Типичные изотермы набухания представлены на рис. VI.9. Как видно, с ростом давления пара растворителя степень набухания увеличивается. Изотерма процесса набухания, переходящего в растворение (неограниченное набухание), круто поднимается вверх вплоть до активности растворителя, равной единице (P=ps)■ Степень набухания может достигать определенного предельного значения и далее с ростом давления пара растворителя не увеличиваться (ограниченное набухание). При ограниченном набухании система переходит в состояние геля (гели ВМС называют студнями).
В состоянии ограниченного набухания система состоит из двух фаз, находящихся в равновесии: насыщенный раствор растворителя в веществе (ВМС), т. е. гель, и насыщенный раствор вещества (ВМС) в растворителе, как правило, небольшой концентрации. Такое двухфазное равновесие аналогично равновесию при ограниченном растворении низкомолекулярных веществ. Неограниченное набухание характерно для линейных полимеров. Сшитые полимеры набухают в растворителях, но не растворяются. При изменении условий ограниченное набухание может перейти в неограниченное. Например, при повышении температуры такой переход наблюдается при набухании желатины и агара в воде.
Набухание — осмотический процесс, при котором происходит диффузия молекул растворителя в высокомолекулярное вещество. Такой односторонний процесс объясняется тем, что макромолекулы ВМС очень большие и разветвленные, благодаря чему они переплетены между собой и слабо подвержены действию теплового движения. В противоположность молекулам ВМС небольшие молекулы растворителя очень подвижны, они легко проникают в высокомолекулярное соединение, увеличивая его объем.
Различают межструктурное и внутриструктурное набухание. При межструктурном набухании молекулы растворителя, диффундируя в аморфный полимер, занимают свободное пространство прежде всего между элементами надмолекулярных структур. Если полимер и растворитель близки по природе, молекулы растворителя проникают также внутрь надмолекулярных образований, раздвигая сначала отдельные участки макромолекул, а затем и целиком длинные полимерные цепи (внутриструктурное набухание). Внутриструктурное набухание сопровождается значительным увеличением объема полимера. При этом расстояние между макромолекулами увеличивается, связи между ними ослабляются, и если эти связи становятся меньше осмотических сил, то макромолекулы будут диффундировать в растворитель, т. е. набухание перейдет в растворение.
Типичные кинетические кривые набухания, характеризующие зависимость степени набухания от времени при данной активности растворителя (давлении пара), представлены на рис. VI.10. При неограниченном набухании в определенный момент времени растворение приводит к уменьшению массы образца. Кинетические кривые для ограниченного набухания часто представляют аналитически в виде следующего дифференциального уравнения:
Da/dx=K tap — cst) (VI.59)
Где K — константа скорости набухания; ар и а% — степень набухания при достижении равновесия и ко времени т соответственно.
В результате интегрирования в пределах от а=0 до а=ат сполучим уравнение кинетики набухания, подобное уравнению для кинетики ленгмюровской адсорбции (III.51):
Скорость набухания в данный момент времени определяется тангенсом угла наклона касательной к кинетической кривой набухания в соответствующей точке. Она уменьшается с ростом «степени набухания.
Важными характеристиками ограниченного набухания являются максимальная степень набухания (предельное набухание) Амакс и время ее ДОСТИЖЄНИЯ Тмакс, ОПрЄДЄЛЯЮЩИЄ СПОСОбнОСТЬ полимера поглощать низкомолекулярную жидкость при данной температуре. Чем больше молекулярная масса полимера, тем медленнее происходит процесс набухания.
Набухание всегда сопровождается возникновением давления набухания, которое Может достигать очень больших значений (десятков и даже сотен1 мегапаскалей). Давление набухания эквивалентно внешнему давлению, которое нужно приложить, чтобы остановить процесс увеличения объема набухающего вещества. Оно аналогично осмотическому давлению [см. уравнение (IV.45)]:
^ RT RT О
Где VM — парциальный мольный объем растворителя; а — активность растворителя; р и р, — давление насыщенного пара растворителя соответственно над набухшим полимером и чистым растворителем.
Уравнение (VI.61) позволяет по давлению пара растворителя рассчитать давление набухания. Давление набухания сильно понижается с ростом давления пара растворителя или, что то — же самое, с ростом степени набухания. С повышением концентрации набухающего вещества в геле (величины, обратной степени набухания) давление набухания увеличивается. Фрейндлих и Поздняк установили следующую эмпирическую зависимость между давлением набухания и концентрацией сухого ВМС в набухшем геле:
Я=ксп или 1п я= In fe+ra In с (VI.62)
Тде кип — константы, значение которых определяется только природой набухающего вещества и растворителя.
Указанная зависимость соблюдается довольно часто.
Давление набухания зависит от степени поперечной связанности полимера (степени сшивки), что заметно проявляется лишь при достаточно большой степени набухания. Для полностью набухших ВМС (при предельном набухании) давление набухания почти линейно зависит от степени сшивки.
Смешение полимера с низкомолекулярным растворителем (набухание и растворение)—самопроизвольный процесс и поэтому протекает с уменьшением энергии Гиббса системы (VI.23):
DG =dH — TdS 0.
Рис. VI.11. Зависимость интегральной qt и диффе реициальной qd теплот набухания от степени на бухания
Важными термодинамическими характе ристиками набухания являются дифферен циальная работа, интегральная и диффе ренциальная теплоты набухания. Диффе ренциальная работа набухания определя ется по уравнению
Ги=ЯТ In (р,/р)
Она уменьшается с ростом степени набухания. Часто процесс набухания сопровождается выделением теплоты. Интегральная и дифференциальная теплоты набухания определяются аналогично соответствующим теплотам в сорбционных процессах. Различие состоит в том, что вместо степени заполнения поверхности при набухании используют степень набухания. Абсолютное значение интегральной теплоты набухания увеличивается с ростом степени набухания. Дифференциальную теплоту набухания получают дифференцированием интегральной теплоты по степени набухания. На рис. VI. 11 представлены зависимости интегральной и дифференциальной теплот набухания от степени набухания. Из них следует, что дифференциальная теплота (ее абсолютное значение), как и дифференциальная работа набухания, уменьшается с ростом степени набухания и становится равной нулю при предельном набухании. Следует отметить, что если дифференциальная работа набухания снижается относительно плавно вплоть до предельного набухания, то дифференциальная теплота резко уменьшается уже при малых значениях степени набухания. Характер изменения интегральной теплоты набухания аналогичен изменению теплоты адсорбции. Было установлено, что зависимость интегральной теплоты набухания от степени набухания следует эмпирическому уравнению
Все права защищены © 2022 Лако-красочные материалы — производство. Технологии и оборудование для изготовления красок, ЛКМ
Карта сайта
Читайте также:

