Молекулярно кинетическая теория теплоемкости кратко
Обновлено: 05.07.2024
Теплоёмкостью какого либо тела называется величина равная количеству тепла, необходимого для того, чтобы изменить температуру тела на 1К. Cтела=dQ/dT (Джоуль/К). Теплоёмкость моля вещества называется молярной теплоёмкостью C (Джоуль/(Моль× К)).
Теплоёмкость единицы массы вещества называется удельной теплоёмкостью c (Джоуль/(кг×К)). c=C/M. Величина теплоёмкости зависит от условий, при которых происходит нагревание тела. 1. При постоянном объёме Cv=dU/dT. 2. При постоянном давлении:
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует: Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
где R – универсальная газовая постоянная. При p = const Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
16. Изопроцессы идеального газа. Зависимость теплоемкости от вида процесса. Адиабатический процесс. Изопроцессы идеального газа. У идеального газа есть три изопроцесса. 1. Изотермический процесс. T=const, pV=const, const=(m/M)RT. 2. Изобарный процесс. p=const, V/T=const, const=(m/M)R/p. 3. Изохорный процесс. V=const, p/T=const, const=(m/M)R/V. Зависимость теплоёмкости от вида процесса. 1. Для изотермического процесса C=¥. 2. Для адиабатного процесса C=0. Адиабатный процесс. Адиабатным называется процесс, протекающий без теплообмена с окружающей средой. Q=0 Þ газ при расширении совершает работ за счёт уменьшения его внутренней энергии. Þ газ охлаждается A'=DU. Кривая, изображающая адиабатический процесс называется адиабатой. 17. Тепловые двигатели и холодильные машины. КПД. Обратимые и необратимые процесы. Круговой процесс. Цикл Карно для идеального газа и его КПД. Тепловой двигатель и холодильная машина. Тепловой двигатель это периодически действующий двигатель, совершающий работу за счёт поступающего из вне тепла. К.П.Д. тепловой машины это отношение совершённой работы за цикл к полученному теплу. Q1 - это количество получаемого тепла, Q2 это количество отдаваемого тепла. h=A/Q1=(Q1-Q2)/Q1, если обратить этот процесс, то получится цикл холодильной машины. Она отбирает за цикл от тела с температурой T2 количество теплоты Q2 и отдаёт телу с более высокой температурой T1 количество тепла Q1. К.П.Д. холодильной машины. Холодильный коэффициент=Q2/A'=Q2/(Q1'-Q2) - работа, которая затрачивается на приведение машины в действие. К.П.Д. h=1-(T2/T1)=(T1-T)/T1 Коэффициент полезного действия всех обратимых машин, работающих в идентичных условиях, одинаков и определяется только температурами нагревателей и холодильников. Обратимые и необратимы процессы. Обратимыми процессами называются такие процессы, которые могут быть проведены в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, только в обратной последовательности. Необратимыми процессами называются такие процессы, которые не могут проходить в обратном направлении. Круговой процесс. Круговыми процессами называются такие процессы, при которых система после ряда изменений возвращается в обратное состояние. Задачи и функции аптечной организации: Аптеки классифицируют на обслуживающие население; они могут быть. Романтизм как литературное направление: В России романтизм, как литературное направление, впервые появился . Что входит в перечень работ по подготовке дома к зиме: При подготовке дома к зиме проводят следующие мероприятия. Величина С имеет размерность [С]=Дж/К. Теплоемкость моля (или киломоля) вещества называется молярной теплоемкостью. Обозначим ее буквой С. Размерность ее [С]=Дж/кмоль×К. Между молярной и удельной теплоемкостями имеется соотношение Величина теплоемкости зависит от условий, при которых происходит нагревание тела. Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. Если нагревание происходит при постоянном объеме, тело не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики все тепло идет на приращение внутренней энергии Отсюда вытекает, что теплоемкость любого тела при постоянном объеме равна Следовательно, чтобы получить молярную теплоемкость идеального газа при постоянном объеме, нужно продифференцировать по температуре выражение для внутренней энергии. Для одного моля газа Молярная теплоемкость при постоянном объеме Из этого выражения следует, что теплоемкость идеального газа при постоянном объеме оказывается постоянной величиной, не зависящей от параметров состояния газа, в частности, от температуры. Введя понятие молярной теплоемкости при V=const, можно записать следующее выражение для внутренней энергии идеального газа: Если нагревание газа происходит при постоянном давлении, то газ будет расширяться, совершая над внешними телами положительную работу. Следовательно, для повышения температуры газа на один градус в этом случае понадобится больше тепла, чем при нагревании при постоянном объеме – часть тепла будет затрачиваться на совершение газом работы. Напишем уравнение первого начала термодинамики для моля газа: Разделив на dT, получим выражение для молярной теплоемкости при постоянном давлении: Слагаемое - молярная теплоемкость при постоянном объеме, поэтому Из уравнения Менделеева-Клайперона для одного моля газа следует, что Дифференцируя это выражение по Т, находим, что Учитывая, что , получим Для идеального газа молярная теплоемкость при постоянном давлении превышает молярную теплоемкость при постоянном объеме на величину R - универсальную газовую постоянную. Из выражения (8.2) следует, что работа, которую совершает моль идеального газа при повышении его температуры на один градус при постоянном давлении, оказывается равной универсальной газовой постоянной. В этом и заключается ее физический смысл. Величина отношения , обозначаемая g, называется коэффициентом Пуассона: т.е. величина g определяется числом степеней свободы молекул. Рассмотренная теория теплоемкости является классической. Ее результаты приблизительно верны для отдельных температурных интервалов, причем каждому интервалу соответствует свое число степеней свободы молекулы.
различных интервалах теплоемкость имеет значения, соответствующие различному числу степеней свободы молекулы. Так на участке 1-1¢ . Это означает, что молекула ведет себя как cистема, обладающая только поступательными степенями свободы. На участке 2-2¢ , следовательно, при температурах, соответствующих этому участку, у молекулы, в дополнение к проявляющимся при более низких температурах, трем поступательным степеням свободы, добавляются еще две – вращательные. Наконец, при достаточно больших температурах , что свидетельствует о наличии при этих температурах колебаний молекулы. В промежутках между указанными интервалами теплоемкость монотонно растет с ростом температуры, т.е. соответствует как бы переменному числу степеней свободы. Объяснение такого поведения дается квантовой механикой. Как устанавливает квантовая теория, энергия вращательного и колебательного движения молекул оказывается квантованной. Это означает, что энергия вращения и энергия колебания молекулы могут иметь не любые значения, а только дискретные (т.е. отдельные, отличающиеся друг от друга на конечную величину) значения. Следовательно, энергия, связанная с этими видами движения, может меняться только скачками. Что и наблюдается на опыте. 8.4. Применение первого начала термодинамики к изопроцессам в газах Изохорный процесс Процесс, протекающий при V=const, называется изохорным. Поскольку при изохорном процессе V=const, а dV=0, то dA=pdV=0, т.е. при изохорном процессе газ работу не совершает. Первое начало термодинамики запишется в этом случае в виде соотношения Количество теплоты, которое необходимо сообщить системе для того, чтобы при постоянном объеме повысить его температуру на величину dT, можно выразить, если известна теплоемкость вещества при постоянном объеме dQ=CVdT и, следовательно, dU=CVdT. Принимая, что CV - теплоемкость идеального газа не зависит от температуры, для внутренней энергии идеального одноатомного газа получим выражение т.е. при изохорном изменении состояния газа вся подведенная к системе теплота идет на увеличение внутренней энергии системы. Изотермический процесс Процесс, происходящий при постоянной температуре, называется изотермическим процессом. При T = const, U = const, dU = 0. Уравнение первого начала термодинамики при изотермическом состоянии газа запишется в следующей форме: Из этого выражения следует, что при изотермическом процессе все подводимое к системе количество теплоты превращается в работу. Для подсчета работы, совершенной газом при изотермическом расширении от объема V1 до V2, необходимо проинтегрировать выражение для элементарной работы: Выразив давление из уравнения Менделеева-Клайперона для одного моля газа и подставив в уравнение для определения работы, получим Работа, совершаемая при расширении -молей газа, будет в раз больше, т.е. Графически вычисленная работа (рис.8.6) выражается на диаграмме с координатами pV площадью аbcd, заштрихованной на графике. Вместо отношения , можно воспользоваться равным ему обратным отношением давлений, исходя из закона Бойля-Мариотта, тогда
Изобарный процесс Изобарный процесс – процесс, происходящий при постоянном давлении p=const. Работа в этом случае равна Работа изображается на диаграмме (рис.8.7.) площадью прямо-угольника abcd.
Таким образом, при изобарном процессе подводимое к газу тепло частично тратится на увеличение его внутренней энергии и частично на совершение работы. При изобарном сжатии направление процесса меняется на обратное и работа, совершенная газом становится отрицательной dA g = const. (8.4) Это выражение называется уравнением Пуассона или уравнением адиабаты. Его можно записать в ином виде, учитывая, что 8.6. Круговые, необратимые и обратимые процессы В термодинамических рассуждениях большое значение имеет рассмотрение различных круговых процессов. Круговым процессом и циклом называется такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, вновь в него возвращается. На диаграмме состояния круговой процесс изображается замкнутой кривой (рис.8.9). Круговой процесс на графике с координатами р и V распадается на два процесса: процесс расширения системы abc и процесс сжатия cda. Процесс расширения системы связан с совершением ею работы, в то время как сжатие системы вызывается работой внешних сил.
равная площади фигуры abcd, соответствует разнице между работой, полученной при расширении системы, и работой, затраченной при возвращении системы в исходное состояние. Различают обратимые и необратимые круговые процессы. Процесс называется обратимым, если система возвращается в исходное состояние, не вызывая изменения в окружающих телах. Чисто механические процессы всегда обратимы. Например, шар, поднятый над землей на высоту h, обладает запасом потенциальной энергии mgh. Cвободно падая, он в конце движения приобретает скорость u, которая может быть найдена из закона сохранения энергии Ударившись о преграду (удар абсолютно упругий), шар изменит свою скорость на обратную и начнет подниматься. При возвращении шара в исходное положение его потенциальная энергия примет первоначальное значение mgh и, следовательно, во всей системе не произойдет никаких изменений, кроме изменений знака скорости. Процесс обратимый. При наличии теплового движения наблюдаются, как правило, процессы необратимые. Пуля в результате трения о воздух теряет свою скорость, происходит превращение механической энергии в тепловую (пуля и воздух нагреваются). Известно, что повернуть этот процесс так, чтобы рассеянное тепло превратилось опять в энергию механического движения невозможно, т.е. процесс необратим. С практической точки зрения интересны циклические процессы, сопровождающиеся превращением теплоты в работу. Наиболее совершенным в отношении коэффициента полезного действия является циклический процесс, рассмотренный впервые французским физиком Сади Карно и носящий его имя. Цикл Карно Цикл Карно состоит из двух изотерм (1-2) и (3-4) и двух адиабат (2-3) и (4-1), изображенных на рис.8.10. Для того, чтобы упростить вычисления, предположим, что рассматриваемая система есть один моль идеального газа, хотя полученный вывод будет справедлив для любой системы. Допустим, что начальное (1) состояние системы определяется значением параметров p1V1T1. Предоставим газу возможность расширяться изотермически при температуре Т1 до объема V2. Давление при этом уменьшилось до величины р2 и система придет в состояние (2), характеризуемое p2V2T1. Расширяясь, газ совершает работу
температура газа понизится до величины Т2, а давление до р3. Система перейдет в состояние (3) с параметрами p3V3T2. При этом за счет изменения внутренней энергии будет совершена работа Для возвращения системы в исходное состояние подвергаем газ, находящийся в результате адиабатного расширения при температуре Т2 изотермическому сжатию до объема V4. Давление при этом возрастает до р4. При этом необходимо совершить работу Для того, чтобы температура оставалась постоянной, необходимо от газа отвести количество теплоты, эквивалентное затраченной работе Q2=A3-4. Замыкание процесса можно осуществить адиабатическим сжатием газа и его давление принимает первоначальное значение Т1 и р1, и система возвращается в исходное состояние. Сжатие газа при переходе из состояния (4®1) потребует затраты работы, эквивалентной возрастанию внутренней энергии системы Работа, совершенная системой при расширении, равна сумме Работа, затраченная на возвращение системы в исходное состояние, равна сумме Их разность является полезной во всем цикле Для характеристики эффективности циклического процесса в отношении превращения теплоты в работу, вводится физическая величина, называемая коэффициентом полезного действия цикла. Коэффициент полезного действия цикла (h) равен отношению работы Аполезн=А1-2-А3-4, практически используемой в данном цикле, к работе, которую можно было бы получить при превращении в нее всего количества тепла, подведенного к системе или, учитывая эквивалентность теплоты и работы, Подставляя (8.5) и (8.6) в формулу (8.7), получим Для того, чтобы упростить это выражение, заметим, что объемы V2 и V3, так же как объемы V4 и V1, лежат попарно на соответствующих адиабатах и поэтому, согласно уравнению Пуассона, для них справедливы следующие соотношения: Извлекая корень (g-1) степени, находим, что . Учитывая это, равенство (8.8) можно переписать в виде Таким образом, коэффициент полезного действия цикла Карно равен отношению разности между абсолютной температурой Т1, при которой происходит изотермическое расширение газа, и абсолютной температурой изотермического сжатия газа Т2 к абсолютной температуре расширения газа Т1. Подобные круговые процессы могут лежать в основе действия как тепловой машины, так и холодильной машины. Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q , необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c . Во многих случаях удобно использовать молярную теплоемкость C : Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: C V – молярная теплоемкость в изохорном процессе ( V = const) и C p – молярная теплоемкость в изобарном процессе ( p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует Изменение Δ U внутренней энергии газа прямо пропорционально изменению Δ T его температуры. Для процесса при постоянном давлении первый закон термодинамики дает: Отношение Δ V / Δ T может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
Поэтому молярная теплоемкость вещества в твердом состоянии равна: Это соотношение называется законом Дюлонга–Пти . Для твердых тел практически не существует различия между C p и C V из-за ничтожно малой работы при расширении или сжатии. Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3 R . Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений. Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. Во многих случаях удобно использовать молярную теплоемкость C: где M – молярная масса вещества. Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает: где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля: где R – универсальная газовая постоянная. При p = const
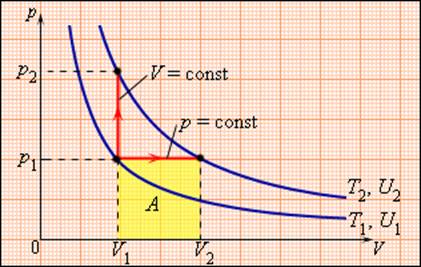
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера): Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом (рис. 3.10.1).
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
В частности, это отношение входит в формулу для адиабатического процесса. Между двумя изотермами с температурами T1 и T2 на диаграмме (p, V) возможны различные пути перехода. Поскольку для всех таких переходов изменение температуры ΔT = T2 – T1 одинаково, следовательно, одинаково изменение ΔU внутренней энергии. Однако, совершенные при этом работы A и полученные в результате теплообмена количества теплоты Q окажутся различными для разных путей перехода. Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей. Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса ΔT = 0, поэтому CT = ∞. В адиабатическом процессе ΔQ = 0, следовательно, Cад = 0.
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией поступательного движения молекул и абсолютной температурой T:
Внутренняя энергия 1 моля идеального газа равна произведению на число Авогадро NА: При изменении температуры на ΔT внутренняя энергия изменяется на величину
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.
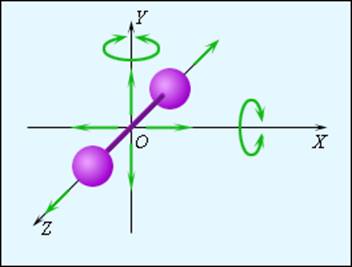
Модель двухатомной молекулы. Точка O совпадает с центром масс молекулы В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
где i – число степеней свободы газа. Для газа, состоящего из одноатомных молекул (i = 3)
Для газа, состоящего из двухатомных молекул (i = 5)
Для газа, состоящего из многоатомных молекул (i = 6)
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле. Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени свободы. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна: Поэтому молярная теплоемкость вещества в твердом состоянии равна: Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии. Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений. Читайте также:
|