Молекула это в химии кратко
Обновлено: 02.07.2024
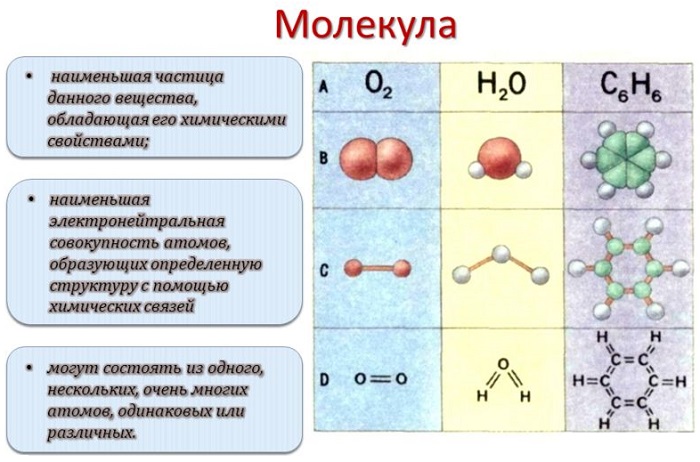
Молекула — это электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями, имеющая определенную пространственную структуру и массу, а также обладающая всеми химическими свойствами этого вещества и способная к самостоятельному существованию.
В некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь молекулярное строение — например, все инертные газы. Для инертных газов понятия атом и молекула, можно условно назвать равносильными понятиями.
Так из определения можно сказать, что молекула характеризуется качественным и количественным составом. Качественный состав показывает, из каких атомов состоит молекула.
Молекулы воды или пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает сколько атомов каждого вида содержится в молекуле. Этот параметр при записи молекулярной формулы отражается в индексах химических элементов, из которых она составлена.
Молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула углекислого газа — из одного атома углерода и двух атомов кислорода.
Особенности строения, масса молекулы
Особенности строения молекулы
Центральным положением классической теории является положение о химической связи. Природа химической связи в классической теории не рассматривается — учитываются лишь такие характеристики, как валентные углы, углы между плоскостями, образованными тройками ядер, длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки. В данной системе атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения.
Молекула состоит из атомов, а если точнее — из атомных ядер, окруженных определенным числом внутренних электронов, и из внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами — краткой записью, которая устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в молекуле. Размер электронной оболочки молекулы является условной величиной.
Молекулы состоят из электронов и атомных ядер. Расположение последних в молекуле передает структурная формула (для передачи состава используется брутто-формула).
К веществам, сохраняющим молекулярную структуру в твердом состоянии, относятся: вода, оксид углерода (IV), многие органические вещества. Они характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т. д.).
Рис.1. Модель молекулы воды.
Масса молекулы
Масса молекулы (Mr) — относительная молекулярная (атомная) масса вещества — это отношение массы молекулы (или атомов) данного вещества к 1 / 12 массы атома углерода.
Молярная масса (M) — это масса вещества, взятого в количестве одного моля.
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Состав и виды молекул
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Макромолекулы чаще всего встречаются в биологии. Рассмотрим некоторые примеры таких молекул.
Молекула может иметь совсем другие свойства, чем атомы, из которых она состоит. Например, сахар (глюкоза или сахароза) представляет собой комбинацию атомов. В него входят кислород, углерод и водород. Углерод в отдельности может представлять собой серое твердое вещество, а кислород и водород — оба газы.
Образуя между собой ковалентные связи, эти атомы создают сладкое питательное вещество, богатое энергией, которое многим животным помогает выжить.
В биологии много других примеров макромолекул, например, РНК, ДНК, ферменты, иммуноглобулин, гемоглобин и др.
Также макромолекулами называют полимерные соединения, которые могут быть синтезированы из множества мономеров и составлять большие и длинные цепи.
Типы химических связей в молекуле
Химическая связь — это связь между атомами в молекуле, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Металлическая — это связь, образованная между ядрами атомов металлов, расположенных в узлах кристаллических решеток, объединенных общим облаком электронов.
Водородная — это вид химической связи, образованной между некоторыми молекулами, содержащими водород, и другим, более электроотрицательным атомом (кислородом, азотом, фтором, реже серой).
Ионная — имеет электрическую природу, то есть это один из видов химической связи, в основе которого лежат электростатические взаимодействия между заряженными ионами: катионом (положительно заряженным ионом) и анионом (отрицательно заряженным ионом).
Обычно ионная связь образуется между типичными металлом и неметаллом, например: поверенная соль (хлорид натрия), оксид бария и т.д.
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам, либо по обменному механизму (обобществление пары электронов), либо по донорно-акцепторному механизму (из электронов донора и свободной орбитали акцептора). Отличается наибольшей устойчивостью и энергетической емкостью.
Ковалентной связью связаны атомы в молекулах простых веществ (хлор, бром, кислород и др.), органических веществ. То есть ковалентная связь образуется между атомами неметаллов. Если неметаллы одинаковые, то образуется ковалентная неполярная связь, а если связь образуется между разными неметаллами — то это ковалентная полярная связь (Рис.2).
Рис.2. Образование ковалентной полярной связи (на примере соляной кислоты).
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.

Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
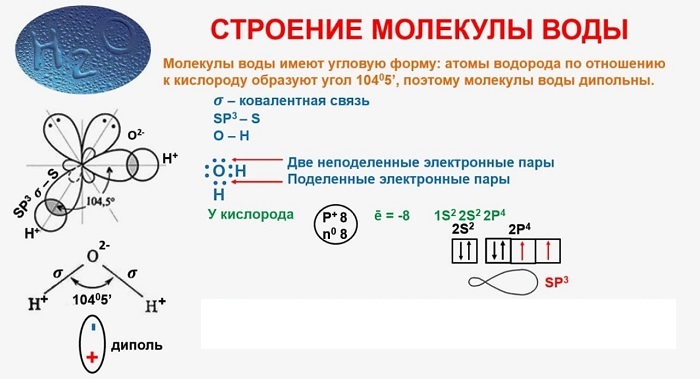
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая - ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная - основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная - имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная - может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
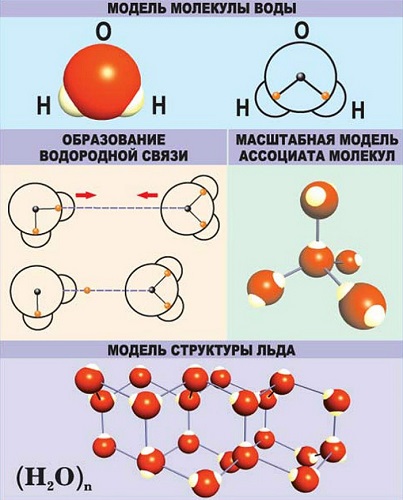
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
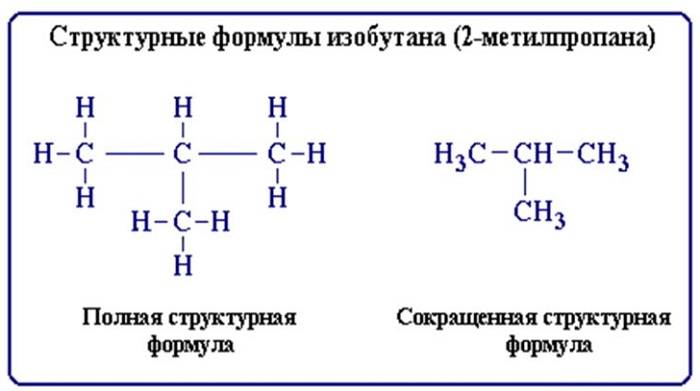
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим - расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
Электрические - этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические - дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные - объясняются распределением электронов в атомах.
диамагнитные - парных электронов нет;
парамагнитные - имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.

Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены); заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (то есть с неспаренными электронами и ненасыщенными валентностями) — радикалами.
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами.
С точки зрения квантовой механики молекула представляет собой систему не из атомов, а из электронов и атомных ядер, взаимодействующих между собой.
К веществам, сохраняющим молекулярную структуру в твердом состоянии, относятся, например, вода, оксид углерода (IV), многие органические вещества. Они характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т. д.).
Каждый раз, когда два атома соединяются вместе, они образуют молекулу. На самом деле все, что нас окружает – да и мы сами – состоит из триллионов различных типов молекул. Понятие молекулы было принято в 1860 году на международном съезде химиков в Карлсруэ. Согласно принятому определению молекула – это наименьшая частица химического вещества, которая обладает всеми его химическими свойствами (растворимость, вкус, способность вступать в соединения и пр). Введение понятия молекулы подтолкнуло развитие физики, химии и других естественных наук. В более общем понимании молекулой называют частицу, образованную из двух или более атомов, соединенных между собой ковалентными связями.

Молекула воды содержит 1 атом кислорода и 2 атома водорода
Атом – мельчайшая частица вещества, которая обладает всеми его физическими свойствами (цвет, твердость, плотность и пр.)
Когда атомы различных типов элементов соединяются вместе, они образуют молекулы, называемые соединениями. Так, вода состоит из сложных молекул, состоящих из 2 атомов водорода и 1 атома кислорода. Вот почему она называется H2O: у молекулы воды всегда будет в 2 раза больше атомов водорода, чем атомов кислорода. Существует чуть более 100 типов атомов, но типов различных веществ миллионы. Причина такого неравенства кроется в том, что они состоят из различных типов молекул.
Важно понимать, что молекулы состоят не только из различных типов атомов, но и из различных соотношений. Как и в приведенном выше примере с водой, молекула воды состоит из двух атома водорода и одного атома кислорода, что записывается как H2O. Другими примерами являются углекислый газ (C02), аммиак (NH3) и сахар или глюкоза (C6H12O6). Некоторые молекулярные формулы могут получиться довольно длинными и сложными. Давайте посмотрим на молекулу сахара:
- С6 — 6 атомов углерода
- H12 — 12 атомов водорода
- Атом кислорода O6 — 6
Чтобы она получилась, нужны определенные атомы в определенном количестве. Но молекулы могут быть гораздо больше. Одна молекула витамина С состоит из 20 атомов (6 атомов углерода, 8 атомов водорода и 6 атомов кислорода – C6H8O6). Если взять эти 20 атомов витамина С и смешать, соединяя их вместе в другом порядке, то получится совершенно другая молекула, которая не только выглядит по-другому, но и действует иначе.
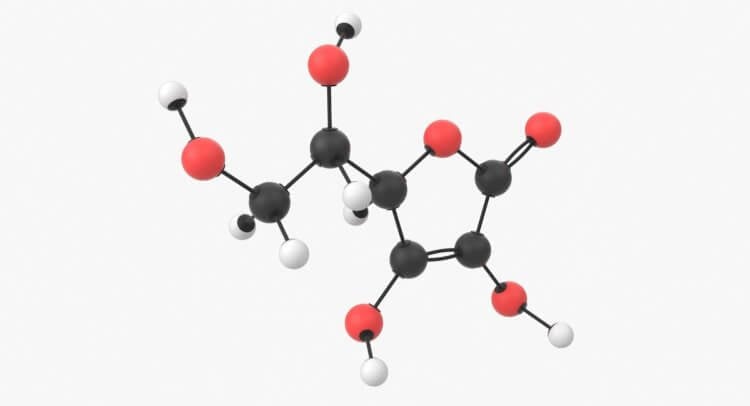
Молекула витамина С выглядит так
Некоторые молекулы, особенно некоторые белки, содержат сотни или даже тысячи атомов, которые соединяются вместе в цепи, которые могут достигать значительной длины. Жидкости, содержащие такие молекулы, иногда ведут себя странно. Например, жидкость может продолжать вытекать из колбы, из которой была вылита некоторая ее часть, даже после того, как колба будет возвращена в вертикальное положение.
Факты о молекулах
- Газообразный кислород обычно представляет собой молекулу O2, но это может быть и O3, который мы называем озоном.
- Молекулы могут иметь различную форму. Некоторые из них представляют собой длинные спирали, а другие могут иметь форму пирамиды.
- Идеальный алмаз — это единственная молекула, состоящая из атомов углерода.
- ДНК – это сверхдлинная молекула, которая обладает информацией, описывающей каждого человека.
- 66% массы человеческого тела состоит из атомов кислорода
Чтобы всегда быть в курсе последних научных открытий, подписывайтесь на наш новостной канал в Telegram
Химические связи
Ковалентные связи делят электроны между атомами. Это происходит, когда получается, что атомы делятся своими электронами, чтобы заполнить свои внешние оболочки. В свою очередь ионные связи образуются, когда один электрон передается другому. Это происходит, когда один атом отдает электрон другому, чтобы сформировать баланс и, следовательно, молекулу или соединение.
Еще больше увлекательных статей о том, как ученые дробят реальность на атомы, читайте на нашем канале в Яндекс.Дзен. Там выходят статьи, которых нет на сайте!

Знания о свойствах и строении молекул легли в основу современной науки и нашего понимания Вселенной
Немаловажным также является тот факт, что молекулы всегда находятся в движении. В твердых телах и жидкостях они находятся очень близко друг к другу, а их движение можно сравнить с быстрой вибрацией. В жидкостях молекулы могут свободно перемещаться между собой, как бы скользя. В газе плотность молекул обычно меньше, чем в жидкости или твердом теле того же химического соединения, а потому молекулы движутся даже более свободно, чем в жидкости. Для конкретного соединения в данном состоянии (твердом, жидком или газообразном) скорость молекулярного движения возрастает с увеличением абсолютной температуры.
Читайте также:

