Металлы химия 8 класс кратко
Обновлено: 30.06.2024

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов

Возможность отдавать электроны с внешнего энергетического уровня обуславливается восстановительными или металлическими свойствами металлов. Степень окисления металлов в соединениях всегда положительная.
Положение в таблице Менделеева
Металлы занимают левую часть периодической таблицы. В первой и второй группах находятся наиболее активные щелочные и щелочноземельные металлы. Наименее активны благородные металлы (золото, платина, серебро), находящиеся ближе к левому краю.
В периодах слева направо металлические свойства уменьшаются. Это связано с возрастанием количества электронов на внешнем энергетическом уровне и увеличением окислительных свойств.
В группах свойства металлов увеличиваются сверху вниз с увеличением числа энергетических уровней. При большом расстоянии от ядра электроны легче отделяются от атома металла.
Проследить активность металлов можно по электрохимическому ряду напряжений металлов. Стоящие слева от водорода элементы проявляют большую активность, чем металлы, стоящие справа. Наиболее активным металлом является литий.

Рис. 1. Ряд напряжений металлов.
Сравнение с неметаллами
Металлы существенно отличаются от неметаллов физическими и химическими свойствами. Сравнительная характеристика металлов и неметаллов представлена в таблице.
Признак
Металлы
Неметаллы
Есть. Самые блестящие – ртуть, серебро, палладий
Твёрдые (исключение – ртуть)
Газ, жидкость, твёрдое вещество
Являются электропроводниками. Наилучшая электропроводность у серебра, золота, меди, алюминия
Являются изоляторами (исключение – углерод, кремний)
Несмотря на то, что графит – модификация углерода, он имеет металлический блеск и обладает электропроводностью. Йод также напоминает металл характерным блеском.

Рис. 2. Графит.
Физические
Все металлы обладают физическими и механическими свойствами. К физическим свойствам относятся:
- плотность – содержание вещества в единице объёма;
- температура плавления – значение, при котором металл переходит из твёрдого состояния в жидкое;
- электропроводность – способность проводить электрический ток;
- теплопроводность – способность передавать тепло;
- удельная теплоёмкость – количество тепла, необходимое для повышения температуры 1 г металла на 1°С;
- тепловое расширение – увеличение объёма при нагревании;
- магнитные свойства – способность намагничиваться и притягивать другие металлы (свойством обладают железо, кобальт, никель, гадолиний).
В соответствии с температурой плавления все металлы делятся на два типа:
- легкоплавкие – приобретают жидкую форму при температуре в пределах 1000°С (цезий, галлий, ртуть);
- тугоплавкие – плавятся при температуре выше 1000°С (вольфрам, хром, ванадий).
К механическим свойствам относятся:
- пластичность;
- твёрдость;
- упругость;
- прочность.
Механические свойства металлов важны при создании сплавов – смесей металла и неметалла. Получившийся сплав проверяют на работоспособность и подвергают испытаниям – растяжению, ударам и т.д.
Сплавы, в состав которых входит железо, называются чёрными металлами. К цветным металлам относятся сплавы остальных металлов.

Рис. 3. Чёрные и цветные металлы.
Химические
Металлы – сильные восстановители. Элементы, стоящие левее водорода, реагируют с простыми и сложными веществами, образуя соли, кислоты, оксиды и гидроксиды:

Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:

оксид лития

пероксид натрия

надпероксид калия




- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:



- С серой реагируют все металлы, кроме золота и платины:

- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:


- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.


Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода















Известно, что все простые вещества условно можно разделить на простые вещества-металлы и простые вещества-неметаллы.
НЕМЕТАЛЛЫ, напротив, способны ПРИСОЕДИНЯТЬ электроны в химических процессах. Большинство неметаллов проявляют противоположные металлам свойства: не блестят, не проводят электрический ток, не куются. Являясь противоположными по свойствам, металлы и неметаллы легко реагируют друг с другом.
Эта часть Самоучителя посвящена краткому освещению свойств металлов и неметаллов. Описывая свойства элементов, желательно придерживаться следующей логической схемы:
1. Вначале описать строение атома (указать распределение валентных электронов), сделать вывод о принадлежности данного элемента к металлам или неметаллам, определить его валентные состояния (степени окисления) — см. урок 3;
2. Затем описать свойства простого вещества, составив уравнения реакций
- с кислородом;
- с водородом;
- с металлами (для неметаллов) или с неметаллами (для металлов);
- с водой;
- с кислотами или со щелочами (там, где это возможно);
- с растворами солей;
3. Затем нужно описать свойства важнейших соединений (водородных соединений, оксидов, гидроксидов, солей). При этом вначале следует определить характер (кислотный или основной) данного соединения, а затем, вспомнив свойства соединений этого класса, составить необходимые уравнения реакций;
4. И наконец нужно описать качественные реакции на катионы (анионы), содержащие этот элемент, способы получения простого вещества и важнейших соединений этого химического элемента, указать практическое применение изучаемых веществ этого элемента.
Так, если вы определите, что оксид кислотный, то он будет реагировать с водой, основными оксидами, основаниями (см. урок 2.1) и ему будет соответствовать кислотный гидроксид (кислота). При описании свойств этой кислоты также полезно заглядывать в соответствующий раздел: урок 2.2.
Внутреннее строение и физические свойства металлов
Металлы — это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, — тем активнее металл (ярче выражены его металлические свойства).
Задание 8.1. Какой металл активнее:

Назовите химические элементы А, Б, В, Г.
Металлы и неметаллы в Периодической системе химических элементов Менделеева (ПСМ) разделяет линия, проведённая от бора к астату. Выше этой линии в главных подгруппах находятся неметаллы (см. урок 3). Остальные химические элементы — металлы.
Задание 8.2. Какие из следующих элементов относятся к металлам: кремний, свинец, сурьма, мышьяк, селен, хром, полоний?
Вопрос. Как можно объяснить тот факт, что кремний — неметалл, а свинец — металл, хотя число внешних электронов у них одинаково?
Существенной особенностью атомов металлов является их большой радиус и наличие слабо связанных с ядром валентных электронов. Для таких атомов величина энергии ионизации* невелика.
* ЭНЕРГИЯ ИОНИЗАЦИИ равна работе, затрачиваемой на удаление одного внешнего электрона из атома (на ионизацию атома), находящегося в основном энергетическом состоянии.


Задание 8.4. Найдите дома металлические предметы.
Выполняя это задание, вы легко найдёте на кухне металлическую посуду: кастрюли, сковородки, вилки, ложки. Из металлов и их сплавов делают станки, самолёты, автомобили, тепловозы, инструменты. Без металлов невозможна современная цивилизация, так как электрические провода также делают из металлов — Cu и Al. Только металлы годятся для получения антенн для радио- и телеприёмников, из металлов делают и лучшие зеркала. При этом чаще используют не чистые металлы, а их смеси (твёрдые растворы) — СПЛАВЫ.

Сплавы
Все перечисленные выше предметы — станки, самолёты, автомобили, сковородки, вилки, ложки, ювелирные изделия — делают из сплавов. Металлы-примеси (легирующие компоненты) очень часто изменяют свойства основного металла в лучшую, с точки зрения человека, сторону. Например, и железо и алюминий — довольно мягкие металлы. Но, соединяясь друг с другом или с другими компонентами, они превращаются в сталь, дуралюмин и другие прочные конструкционные материалы. Рассмотрим свойства самых распространённых сплавов.
Сталь — это сплавы железа с углеродом, содержащие последнего до 2 %. В состав легированных сталей входят и другие химические элементы — хром, ванадий, никель. Сталей производится гораздо больше, чем каких-либо других металлов и сплавов, и все виды их возможных применений трудно перечислить. Малоуглеродистая сталь (менее 0,25 % углерода) в больших количествах потребляется в качестве конструкционного материала, а сталь с более высоким содержанием углерода (более 0,55 %) идет на изготовление режущих инструментов: бритвенные лезвия, сверла и др.
Железо составляет основу чугуна. Чугуном называется сплав железа с 2–4 % углерода. Важным компонентом чугуна является также кремний. Из чугуна можно отливать самые разнообразные и очень полезные изделия, например крышки для люков, трубопроводную арматуру, блоки цилиндров двигателей и др.
Бронза — сплав меди, обычно с оловом как основным легирующим компонентом, а также с алюминием, кремнием, бериллием, свинцом и другими элементами, за исключением цинка. Оловянные бронзы знали и широко использовали ещё в древности. Большинство античных изделий из бронзы содержат 75–90 % меди и 25–10 % олова, что делает их внешне похожими на золотые, однако они более тугоплавкие. Это очень прочный сплав. Из него делали оружие до тех пор, пока не научились получать железные сплавы. С применением бронзы связана целая эпоха в истории человечества: Бронзовый век.
Латунь — это сплавы меди с Zn, Al, Mg. Это цветные сплавы с невысокой температурой плавления, их легко обрабатывать: резать, сваривать и паять.
Мельхиор — является сплавом меди с никелем, иногда с добавками железа и марганца. По внешним характеристикам мельхиор похож на серебро, но обладает большей механической прочностью. Сплав широко применяют для изготовления посуды и недорогих ювелирных изделий. Большинство современных монет серебристого цвета изготавливают из мельхиора (обычно 75 % меди и 25 % никеля с незначительными добавками марганца).
Дюралюминий, или дюраль — это сплав на основе алюминия с добавлением легирующих элементов — медь, марганец, магний и железо. Он характеризуется своей стальной прочностью и устойчивостью к возможным перегрузкам. Это основной конструкционный материал в авиации и космонавтике.

Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:

Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:

Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:

Таким образом, полученное соединение имеет состав:

В результате получаем уравнение реакции:

Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:

Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:

Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:


Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:

Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:

Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:

где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl – . А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:

Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:

А затем полученная щёлочь реагирует с солью:

Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:


Коррозия металлов
Коррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды.

а восстанавливаются компоненты атмосферной влаги:

В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину:

Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции.
Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой.

Выводы
Металлы — это простые вещества, которые всегда являются восстановителями. Восстановительная активность металла убывает в ряду напряжений от лития к золоту. По положению металла в ряду напряжений можно определить, как металл реагирует с растворами кислот, с водой, с растворами солей.

Видеофрагмент помогает учащимся вспомнить особенности металлической связи, кроме этого, интересной для учеников станет историческая справка о металлах и их использовании. Большая часть урока посвящена физическим свойствам металлов, где наглядно и подробно с помощью иллюстраций показана особенность строения металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Простые вещества -- металлы"
Всего известно 114 химических элементов. Из них 92 относится к металлам.
С металлами люди знакомы очень давно. На смену каменному веку, пришел медный век, затем бронзовый, который сменился железным веком. Люди постоянно использовали металлы: для изготовления наконечников стрел и копий, из металлов делали мечи и щиты, посуду, плуги и многое другое. В древности для письма и рисования использовали свинцовые или серебряные палочки.

До наших дней сохранились серебряные рисунки Л. Да Винчи и других художников эпохи Возрождения.

Кроме того, металлам приписывалось множество чудодейственных свойств. Еще в Древнем Египте семь металлов считались представителями семи планет на Земле.
Золото наши предки связывали с Солнцем, серебро – с Луной, медь с Венерой, железо – с Марсом, олово – с Юпитером, свинец с Сатурном, ртуть – с Меркурием.
Поэтому алхимики, обозначения химических элементов металлов связывали с обозначениями планет.

В настоящее время металлы и их сплавы широко используются человеком при изготовлении монет, памятников, титан используют как заменитель костной ткани; тантал – для сшивания нервов, ниобий используется для сшивания сухожилия и кровеносных сосудов.
Использование металлов

Для металлов характерна металлическая химическая связь. Эта связь обуславливает ряд свойств, характерных для металлов. Прежде всего, все металлы – твердые вещества, за исключением ртути. Это единственный металл, который находится в жидком состоянии.
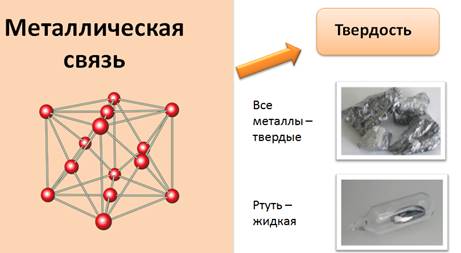
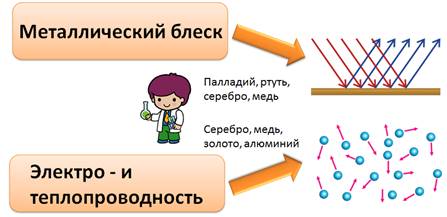
Металлы обладают металлическим блеском. Свет поглощается поверхностью металла, и электроны начинают испускать свое излучение, которое мы воспринимаем как металлический блеск. Палладий, ртуть, серебро и медь лучше других отражают свет.
Наличие свободных электронов в металлах объясняет и такое их свойство, как электро- и теплопроводность. Лучшими проводниками электрического тока являются: серебро, медь, золото, алюминий.
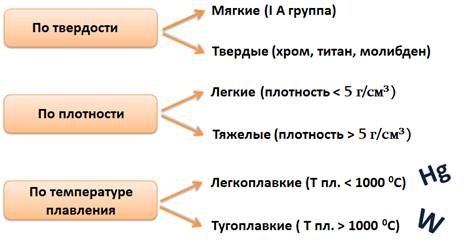
Металлы различают и по твёрдости: самые мягкие это щелочные металлы (IА группа), самые твёрдые: хром, титан, молибден.
По плотности различают лёгкие металлы, у которых плотность меньше 5 г/см 3 . К таким относятся щелочные металлы. Тяжелыми считаются металлы, у которых плотность больше 5 г/см 3 . Самым тяжелым является осмий.
По температуре плавления металлы делятся на легкоплавкие, у которых эта температура меньше 1000 0 С, и тугоплавкие, у которых она больше 1000 0 С. Самым легкоплавким металлом является ртуть, а самым тугоплавким – вольфрам, из которого изготавливают нити накаливания для лампочек.
Это основные свойства металлов. Все их свойства зависят от строения, о котором вы узнаете в дальнейшем при изучении химии.
Читайте также:

