Метаболизм кетоновых тел биохимия кратко
Обновлено: 18.05.2024
Историческая справка о возникновении кетоновых тел (ацетона) в печени. Метаболизм кетоновых тел: их содержание в плазме крови человека. Альтернативный путь синтеза кетоновых тел. Их биологическая роль в организме человека и лабораторная диагностика.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 08.03.2015 |
| Размер файла | 58,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Государственное бюджетное образовательное учреждение высшего профессионального образования Рязанский государственный медицинский университет им. Акад. И.П. Павлова
Министерства здравоохранения РФ
Реферат на тему:
Кетоновые тела
Выполнила: студентка 3 курса 6 группы,
План
1. Историческая справка
2. Метаболизм кетоновых тел
2.1 Альтернативный путь
3. Биологическая роль кетоновых тел
4. Лабораторная диагностика
Введение
Кетоновые тела(синоним: ацетомновые тела, ацетомн [распростанённый медицинский жаргонизм]) -- группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА [2] :
· ацетоуксусная кислота (ацетоацетат)
· бета-гидроксимасляная кислота (в-гидроксибутират)
1. Историческая справка
Прежние представления о том, что кетоновые тела являются промежуточными продуктами бета-окисления жирных кислот, оказались ошибочными:
· во-первых, в обычных условиях промежуточными продуктами бета-окисления жирных кислот являются КоА-эфиры этих кислот: в-оксибутирил-КоА или ацетоацетил-КоА;
· во-вторых, в-оксибутирил-КоА, образующийся в печени при бета-окислении жирных китслот, имеет L-конфигурацию, в то время как в-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно в-оксибутират D-конфигурации образуется в ходе метаболического пути синтеза в-окси-в-метилглутарил-КоА.
кетоновый тело метаболизм лабораторный2. Метаболизм кетоновых тел
Ацетон в плазме крови в норме присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоуксусной кислоты и не имеет определённого физиологического значения (в сущности являясь токсическим веществом для головного мозга, циркулирует в мизерной концентрации).
Нормальное содержание кетоновых тел в плазме крови человека и большинства млекопитающих (за исключением жвачных) составлет 1-2 мг (по ацетону). При увеличении их концентрации свыше 10-15 мг они преодолевают почечный порог и определяются в моче. Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния.
Кетоновые тела синтезируются в печени из ацетил-КоА:
На первом этапе из двух молекул ацетил-КоА синтезируется ацетоацетил-КоА. Данная реакция катализируется ферментом ацетоацетил-КоА-тиолазой.
Ac--КоА + Ac--КоА > H3C--CO--CH2--CO--S--КоА
Затем под влиянием фермента оксиметилглутарил-КоА-синтазы присоединяется ещё одна молекула ацетил-КоА.
H3C--CO--CH2--CO--S--КоА + Ac--КоА > HOOC--CH2--COH(CH3)--CH2--CO--S--КоА
Образовавшийся в-окси-в-метилглутарил-КоА (OMG-KoA) способен под действием фермента оксиметилглутарил-КоА-лиазырасщепляться на ацетоуксусную кислоту (ацетоацетат) и ацетил-КоА.
HOOC--CH2--COH(CH3)--CH2--CO--S--КоА > H3C--CO--CH2--COOH + Ac--КоА
Ацетоуксусная кислота способна восстанавливаться при участии НАД-зависимой D-в-оксибутиратдегидрогеназы; при этом образуется D-в-оксимасляная кислота (D-в-оксибутират). Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры.
H3C--CO--CH2--COOH + NADH > H3C--CHOH--CH2--COOH
Ацетоуксусная кислота в процессе метаболизма способна окисляться до ацетона с выделением молекулы углекислого газа:
H3C--CO--CH2--COOH > CO2 + H3C--CO--CH3
Существует второй путь синтеза кетоновых тел:
образовавшийся путём конденсации двух молекул ацетил-КоА ацетоацетил-КоА способен отщеплять Кофермент A с образованием свободной ацетоуксусной кислоты. Процесс катализирует фермент ацетоацетил-КоА-гидролаза (деацилаза), однако данный путь не имеет существенного значения в синтезе ацетоуксусной кислоты, так как активность деацилазы в печени низкая.
H3C--CO--CH2--CO--S-КоА + H2O > H3C--CO--CH2--COOH + КоА-SH
3. Биологическая роль кетоновых тел
В плазме крови здорового человека кетоновые тела содержатся в весьма незначительных концентрациях. Однако при патологических состояниях (длительное голодание, тяжёлая физическая нагрузка, тяжёлая форма сахарного диабета) концентрация кетоновых тел может значительно повышаться и достигать 20 ммоль/л (кетонемия). Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия -- скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма.
За последние десятилетия накопились сведения, указывающие на важное значение кетоновых тел в поддержании энергетического баланса. Кетоновые тела -- топливо для мышечной ткани, почек и действуют, вероятно, как часть регуляторного механизма с обратной связью, предотвращая излишнюю мобилизацию жирных кислот из жировых депо. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга. Печень, синтезируя кетоновые тела, не способна использовать их в качестве энергетического материала (не располагает соответствующими ферментами).
В периферических тканях в-оксимасляная кислота окисляется до ацетоуксусной кислоты, которая активируется с образованием соответствующего КоА-эфира (ацетоацетил-КоА). Существует два ферментативных механизма активации:
· первый путь -- с использованием АТФ и HS-КоА, аналогичный пути активации жирных кислот:
H3C--CO--CH2--COOH (Ацетоуксусная кислота)
+ АТФ + HS-КоА Ацил-КоА-синтетаза > АМФ + ФФн
H3C--CO--CH2--CO--S-КоА (Ацетоацетил-КоА)
· второй путь -- перенос Коэнзима А от сукцинил-КоА на ацетоуксусную кислоту:
HOOC--CH2--CH2--CO--S-КоА (Сукцинил-КоА) + H3C--CO--CH2--COOH (Ацетоуксусная кислота)
HOOC--CH2--CH2--COOH (Сукцинат) + H3C--CO--CH2--CO--S-КоА (Ацетоацетил-КоА)
Образовавшийся в ходе этих реакций ацетоацетил-КоА в дальнейшем подвергается тиолитическому расщеплению в митохондриях с образованием двух молекул ацетил-КоА, которые, в свою очередь, являются сырьём для цикла Кребса (цикл трикарбоновых кислот), где окисляются до CO2 и H2O.
H3C--CO--CH2--CO--S-КоА (Ацетоацетил-КоА)
+ HS-КоА > H3C--CO--S-КоА
H3C--CO--S-КоА ( Ацетил-КоА)
Повышение содержания кетоновых тел в организме связано прежде всего с дефицитом углеводов в обеспечении организма энергией: перегрузка белками и жирами на фоне недостка легкопереваримых углеводов в рационе, истощение, ожирение, нарушение эндокринной регуляции (сахарный диабет, тиреотоксикоз), отравления, травма черепа и т. д.
4. Лабораторная диагностика
Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде и Герхарда.
Список литературы
1. Тюкавкина Н. А., Бауков Ю. И. Биоорганическая химия. М.: Медицина, 1985.
2. Березов Т. Т., Коровкин Б. Ф. Биологическая химия . М.: Медицина,-- 1990.
Подобные документы
Диагностика наличия белка, глюкозы, крови в моче сверх величин, составляющих физиологическую норму. Измерение наличия индикана в моче с помощью пробы Обермайера. Обнаружение кетоновых тел при нарушениях баланса между употребляемыми жирами и углеводами.
презентация [252,6 K], добавлен 11.09.2016
Характеристика железа, его физические, химические и биологические свойства. Железо в составе гемоглобина и миоглобина человека. Количество гемоглобина в крови человека. Уровень железа в плазме крови. Процессы разрушения и образования эритроцитов.
реферат [36,1 K], добавлен 13.02.2014
Роль и значение печени в организме человека. Схема гликолиза и глюконеогенеза. Желтуха - синдром, развивающийся вследствие накопления в крови избыточного количества билирубина. Дифференциальная диагностика желтух. Лабораторные показатели при желтухе.
презентация [3,0 M], добавлен 01.12.2016
Особенности печеночного кровотока при проведении операции. Метаболизм лекарственных препаратов. Образование и экскреция желчи. Дисфункция печени, ассоциированная с галогенизированными анестетиками, и ее лабораторная оценка. Заболевания желчных путей.
реферат [21,4 K], добавлен 27.12.2009
Формирование биологических ритмов. Фосфорно-кальциевый обмен в организме человека. Амплитуда суточных колебаний циркадианного ритма кальция в плазме крови. Хронобиологический анализ влияния корня солодки на организацию ритма концентрации кальция.
статья [226,7 K], добавлен 02.08.2013
Свинец как самый токсичный тяжелый металл. Токсикокинетика и токсикодинамика поведения этого металла в организме человека. Симптомы и опасность хронической интоксикации свинцом. Лабораторная диагностика и специфика клинических проявлений этого синдрома.
реферат [124,9 K], добавлен 04.03.2012
Роль активных форм кислорода и инициируемых ими свободнорадикальных процессов при различных патологических процессах, а так же при беременности. Содержание диеновых конъюгатов и малонового диальдегида в плазме крови у женщин в разные периоды беременности.
В здоровом организме ацетон в крови присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоацетата и, по-видимому, не имеет определенного физиологического значения.
Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными.
Во-первых, в обычных условиях промежуточными продуктами β-окис-ления жирных кислот являются КоА-эфиры этих кислот, например β-окси-бутирил-КоА, ацетоацетил-КоА.
Во-вторых, β-оксибутирил-КоА, образующийся в печени при β-окисле-нии жирных кислот, имеет L-конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно β-окси-бутират D-конфигурации образуется в ходе метаболического пути синтеза β-окси-β-метилглутарил-КоА (3-гидрокси-3-метилглутарил-КоА):
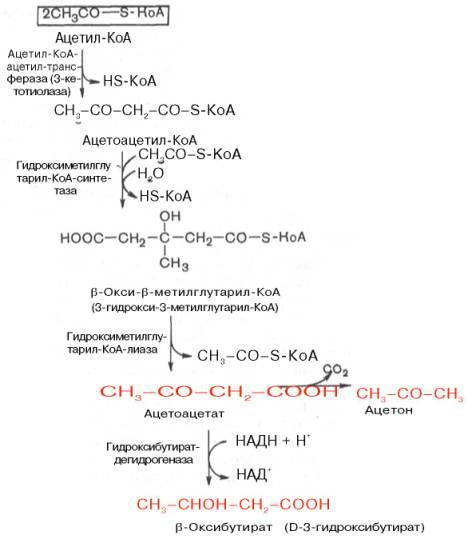
На первом этапе из 2 молекул ацетил-КоА образуется ацетоацетил-КоА. Реакция катализируется ферментом ацетил-КоА-ацетилтрансферазой (3-ке-тотиолазой). Затем ацетоацетил-КоА взаимодействует еще с одной молекулой ацетил-КоА. Реакция протекает под влиянием фермента гидро-ксиметилглутарил-КоА-синтетазы. Образовавшийся β-окси-β-метилглута-рил-КоА способен под действием гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоацетат и ацетил-КоА.
Ацетоацетат восстанавливается при участии НАД-зависимой D-3-гид-роксибутиратдегидрогеназы, при этом образуется D-β-оксимасляная кислота (D-3-гидроксибутират). Следует подчеркнуть, что фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры.
Существует второй путь синтеза кетоновых тел. Образовавшийся путем конденсации 2 молекул ацетил-КоА ацетоацетил-КоА способен отщеплять коэнзим А и превращаться в ацетоацетат. Этот процесс катализируется ферментом ацетоацетил-КоА-гидролазой (деацилазой):
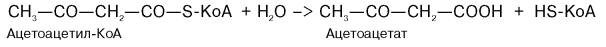
Однако второй путь образования ацетоуксусной кислоты (ацетоацетата) не имеет существенного значения, так как активность деацилазы в печени низкая.
В крови здорового человека кетоновые тела содержатся лишь в очень небольших концентрациях (в сыворотке крови 0,03–0,2 ммоль/л). При патологических состояниях (у лиц с тяжелой формой сахарного диабета, при голодании, а также у животных с экспериментальным острым стрептозотоциновым или аллоксановым диабетом) концентрация кетоновых тел в сыворотке крови увеличивается и может достигать 16–20 ммоль/л.
Как отмечалось, основным местом образования ацетоацетата и 3-гид-роксибутирата служит печень. Из митохондрий печени эти соединения диффундируют в кровь и переносятся к периферическим тканям.
Известно, что в периферических тканях 3-гидроксибутират (β-оксимас-ляная кислота) способен окисляться до ацетоацетата, а последний активируется с образованием соответствующего КоА-эфира (ацетоацетил-КоА). Ацетоацетат может быть активирован путем переноса КоА с сукцинил-КоА в реакции, катализируемой специфической КоА-трансферазой. Образовавшийся ацетоацетил-КоА далее расщепляется тиолазой с образованием 2 молекул ацетил-КоА, которые затем включаются в цикл Кребса:
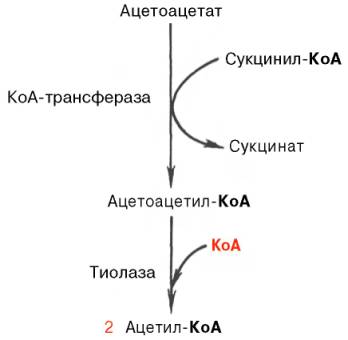
Не исключено, что существует и второй путь активации ацетоацетата – это использование АТФ и HS-KoA аналогично тому, как при активации жирных кислот:

Кето́новые тела́ (синоним: ацето́новые тела, ацето́н [распространённый медицинский жаргонизм]) — группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА [2] :
-
(пропанон) [H3C—CO—CH3]
- ацетоуксусная кислота (ацетоацетат) [H3C—CO—CH2—COOH]
- бета-гидроксимасляная кислота (β-гидроксибутират) [H3C—CHOH—CH2—COOH]
Содержание
Историческая справка
Прежние представления о том, что кетоновые тела являются промежуточными продуктами бета-окисления жирных кислот, оказались ошибочными [2] :
- во-первых, в обычных условиях промежуточными продуктами бета-окисления жирных кислот являются КоА-эфиры этих кислот: β-оксибутирил-КоА или ацетоацетил-КоА;
- во-вторых, β-оксибутирил-КоА, образующийся в печени при бета-окислении жирных кислот, имеет L-конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно β-оксибутират D-конфигурации образуется в ходе метаболического пути синтеза β-окси-β-метилглутарил-КоА.
Метаболизм кетоновых тел

Ацетон в плазме крови в норме присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоуксусной кислоты и не имеет определённого физиологического значения [2] (в сущности являясь токсическим веществом для головного мозга, циркулирует в мизе́рной концентрации).
Нормальное содержание кетоновых тел в плазме крови человека и большинства млекопитающих (за исключением жвачных) составлет 1…2 мг% (по ацетону). При увеличении их концентрации свыше 10…15 мг% они преодолевают почечный порог и определяются в моче. Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния.
Кетоновые тела синтезируются в печени из ацетил-КоА: [2]
На первом этапе из двух молекул ацетил-КоА синтезируется ацетоацетил-КоА. Данная реакция катализируется ферментом ацетоацетил-КоА-тиолазой. Ac—КоА + Ac—КоА → H3C—CO—CH2—CO—S—КоА Затем под влиянием фермента гидроксиметилглутарил-КоА-синтазы присоединяется ещё одна молекула ацетил-КоА. H3C—CO—CH2—CO—S—КоА + Ac—КоА → HOOC—CH2—COH(CH3)—CH2—CO—S—КоА Образовавшийся β-гидрокси-β-метилглутарил-КоА (OMG-KoA) способен под действием фермента гидроксиметилглутарил-КоА-лиазы расщепляться на ацетоуксусную кислоту (ацетоацетат) и ацетил-КоА. HOOC—CH2—COH(CH3)—CH2—CO—S—КоА → H3C—CO—CH2—COOH + Ac—КоА Ацетоуксусная кислота способна восстанавливаться при участии НАД-зависимой D-β-оксибутиратдегидрогеназы; при этом образуется D-β-оксимасляная кислота (D-β-оксибутират). Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры. [2] H3C—CO—CH2—COOH + NADH → H3C—CHOH—CH2—COOH Ацетоуксусная кислота в процессе метаболизма способна окисляться до ацетона с выделением молекулы углекислого газа: [1] H3C—CO—CH2—COOH → CO2 + H3C—CO—CH3
Альтернативный путь
Существует второй путь синтеза кетоновых тел:
образовавшийся путём конденсации двух молекул ацетил-КоА ацетоацетил-КоА способен отщеплять Кофермент A с образованием свободной ацетоуксусной кислоты [3] . Процесс катализирует фермент ацетоацетил-КоА-гидролаза (деацилаза), однако данный путь не имеет существенного значения в синтезе ацетоуксусной кислоты, так как активность деацилазы в печени низкая. [2] H3C—CO—CH2—CO—S-КоА + H2O → H3C—CO—CH2—COOH + КоА-SH
Биологическая роль кетоновых тел
В плазме крови здорового человека кетоновые тела содержатся в весьма незначительных концентрациях. Однако при патологических состояниях (длительное голодание, тяжёлая физическая нагрузка, тяжёлая форма сахарного диабета) концентрация кетоновых тел может значительно повышаться и достигать 20 ммоль/л (кетонемия). Кетонемия (повышение концентрации кетоновых тел в крови) возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма. [2]
За последние десятилетия накопились сведения, указывающие на важное значение кетоновых тел в поддержании энергетического баланса. Кетоновые тела — топливо для мышечной ткани, почек и действуют, вероятно, как часть регуляторного механизма с обратной связью, предотвращая излишнюю мобилизацию жирных кислот из жировых депо. [2] Во время голодания кетоновые тела являются одним из основных источников энергии для мозга. [4] [5] Печень, синтезируя кетоновые тела, не способна использовать их в качестве энергетического материала (не располагает соответствующими ферментами).
В периферических тканях β-оксимасляная кислота окисляется до ацетоуксусной кислоты, которая активируется с образованием соответствующего КоА-эфира (ацетоацетил-КоА). Существует два ферментативных механизма активации: [2]
- первый путь — с использованием АТФ и HS-КоА, аналогичный пути активации жирных кислот:
H3C—CO—CH2—COOH ( Ацетоуксусная кислота )
+ АТФ + HS-КоА Ацил-КоА-синтетаза → АМФ + ФФн
H3C—CO—CH2—CO—S-КоА ( Ацетоацетил-КоА )
- второй путь — перенос Коэнзима А от сукцинил-КоА на ацетоуксусную кислоту:
HOOC—CH2—CH2—CO—S-КоА ( Сукцинил-КоА ) + H3C—CO—CH2—COOH ( Ацетоуксусная кислота )
HOOC—CH2—CH2—COOH ( Сукцинат ) + H3C—CO—CH2—CO—S-КоА ( Ацетоацетил-КоА )
Образовавшийся в ходе этих реакций ацетоацетил-КоА в дальнейшем подвергается тиолитическому расщеплению в митохондриях с образованием двух молекул ацетил-КоА, которые, в свою очередь, являются сырьём для цикла Кребса (цикл трикарбоновых кислот), где окисляются до CO2 и H2O.
H3C—CO—CH2—CO—S-КоА ( Ацетоацетил-КоА )
+ HS-КоА → H3C—CO—S-КоА
H3C—CO—S-КоА ( Ацетил-КоА )
Повышение содержания кетоновых тел в организме связано прежде всего с дефицитом углеводов в обеспечении организма энергией: перегрузка белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощение, ожирение, нарушение эндокринной регуляции (сахарный диабет, тиреотоксикоз), отравления, травма черепа и т. д.
Лабораторная диагностика
Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде и Герхарда.
1. Пути использования высших жирных кислот в клетках. Биосинтез триацилглицеролов и их мобилизация, биологическая роль. Факторы, способствующие развитию ожирения.
2. Общие этапы биосинтеза ацилглицеролов и фосфолипидов. Последовательность реакций синтеза фосфатидилхолина и его роль в организме. Понятие о липотропном эффекте фосфолипидов и липотропных факторах.
3. Биосинтез холестерола: локализация, основные этапы синтеза, регуляторный фермент. Последовательность реакций образования мевалоновой кислоты, ферменты. Основные пути использования холестерола в организме.
4. Клинико-диагностическое значение определения содержания холестерола в сыворотке крови.
5. Кетоновые тела: реакции их биосинтеза и утилизации в тканях, биологическая роль. Клинико-диагностическое значение обнаружения кетоновых тел в моче.
Синтез кетоновых тел и их утилизация .

Рисунок 19.1. Реакции синтеза кетоновых тел.
19.1.2. Синтез кетоновых тел в организме усиливается при ускоренном катаболизме жирных кислот (голодание, сахарный диабет). В этих условиях в печени имеется дефицит оксалоацетата, образующегося преимущественно в реакциях углеводного обмена. Поэтому затрудняется взаимодействие ацетил-КоА с оксалоацетатом и все последующие реакции цикла трикарбоновых кислот Кребса.
Ацетоуксусная и β-гидроксимасляная кислоты, которые относятся к кетоновым телам, являются сильными кислотами. Поэтому накопление их в крови приводит к сдвигу рН в кислую сторону (метаболический ацидоз) .
19.1.3. Кетоновые тела как источник энергии используют миокард, лёгкие, почки, скелетные мышцы, даже головной мозг (при длительном голодании). Утилизация кетоновых тел осуществляется следующим образом (рисунок 19.2).

Рисунок 19.2. Реакции утилизации кетоновых тел.
Образующийся ацетил-КоА окисляется в цикле Кребса. Энергетический баланс окисления ацетоацетата до конечных продуктов составляет 23 молекулы АТФ, полного окисления β-гидроксибутирата - 26 молекул АТФ.
Печень не использует кетоновые тела в качестве энергетического материала.
Занятие 19 (6 – 11 февраля 2012 г.)
Тема: «БИОСИНТЕЗ КЕТОНОВЫХ ТЕЛ, ТРИАЦИЛГЛИЦЕРОЛОВ И ФОСФОЛИПИДОВ. МЕТАБОЛИЗМ
1. Пути использования высших жирных кислот в клетках. Биосинтез триацилглицеролов и их мобилизация, биологическая роль. Факторы, способствующие развитию ожирения.
2. Общие этапы биосинтеза ацилглицеролов и фосфолипидов. Последовательность реакций синтеза фосфатидилхолина и его роль в организме. Понятие о липотропном эффекте фосфолипидов и липотропных факторах.
3. Биосинтез холестерола: локализация, основные этапы синтеза, регуляторный фермент. Последовательность реакций образования мевалоновой кислоты, ферменты. Основные пути использования холестерола в организме.
4. Клинико-диагностическое значение определения содержания холестерола в сыворотке крови.
5. Кетоновые тела: реакции их биосинтеза и утилизации в тканях, биологическая роль. Клинико-диагностическое значение обнаружения кетоновых тел в моче.
Синтез кетоновых тел и их утилизация .

Рисунок 19.1. Реакции синтеза кетоновых тел.
19.1.2. Синтез кетоновых тел в организме усиливается при ускоренном катаболизме жирных кислот (голодание, сахарный диабет). В этих условиях в печени имеется дефицит оксалоацетата, образующегося преимущественно в реакциях углеводного обмена. Поэтому затрудняется взаимодействие ацетил-КоА с оксалоацетатом и все последующие реакции цикла трикарбоновых кислот Кребса.

Ацетоуксусная и β-гидроксимасляная кислоты, которые относятся к кетоновым телам, являются сильными кислотами. Поэтому накопление их в крови приводит к сдвигу рН в кислую сторону (метаболический ацидоз) .
19.1.3. Кетоновые тела как источник энергии используют миокард, лёгкие, почки, скелетные мышцы, даже головной мозг (при длительном голодании). Утилизация кетоновых тел осуществляется следующим образом (рисунок 19.2).

Рисунок 19.2. Реакции утилизации кетоновых тел.
Образующийся ацетил-КоА окисляется в цикле Кребса. Энергетический баланс окисления ацетоацетата до конечных продуктов составляет 23 молекулы АТФ, полного окисления β-гидроксибутирата - 26 молекул АТФ.
Печень не использует кетоновые тела в качестве энергетического материала.
При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс "трудоемкий", а нервные клетки вообще неспособны окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела .
К кетоновым телам относят три соединения близкой структуры – ацетоацетат , 3-гидроксибутират и ацетон .
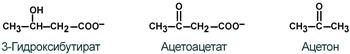
Строение кетоновых тел
Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание , сахарный диабет I типа , длительные физические нагрузки . Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетоновых тел.
Для понимания причин развития кетонемии при различных ситуациях необходимо понимать роль оксалоацетата для регуляции цикла трикарбоновых кислот. При голодании соотношение инсулин/глюкагон низкое и поэтому в печени активно идет глюконеогенез, для которого используется оксалоацетат. Поэтому при голодании жирные кислоты, поступающие в большом количестве в печень, не сгорают в ЦТК, а уходят в синтез кетоновых тел. При длительной мышечной нагрузке резервы гликогена в печени истощаются, развивается тенденция к гипогликемии и секретируется глюкагон, который усиливает глюконеогенез, при этом количество оксалоацетата снижается, и жирные кислоты, попавшие в печень, будут окисляться с образованием кетоновых тел.
Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете , особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола.
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
Для детей раннего возраста характерна неустойчивость жирового обмена, связанная с недостаточностью регуляторного влияния ЦНС и эндокринной системы. Поэтому кетонемия и кетонурия у грудных детей наблюдается чаще, чем у взрослых.
Уровень ацетоацетата быстро нарастает между 12 и 24 часами жизни и сохраняется высоким первую неделю жизни, что свидетельствует об активной мобилизации жира из депо, высокой утилизации свободных жирных кислот в печени и малом использовании кетоновых тел в тканях.
У детей до 7 лет под влиянием различных стимулов (краткое голодание, инфекции, эмоциональное возбуждение) ускоряется синтез кетоновых тел и может легко возникать кетоацидоз, сопровождающийся неукротимой рвотой ("ацетонемическая рвота"). Причиной этого служит неустойчивость углеводного обмена и малые запасы гликогена у детей, что усиливает липолиз в адипоцитах, накопление жирных кислот в крови и, следовательно, кетогенез в печени.
Синтез кетоновых тел (кетогенез)
Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо декарбоксилируется до ацетона. После синтеза все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой.
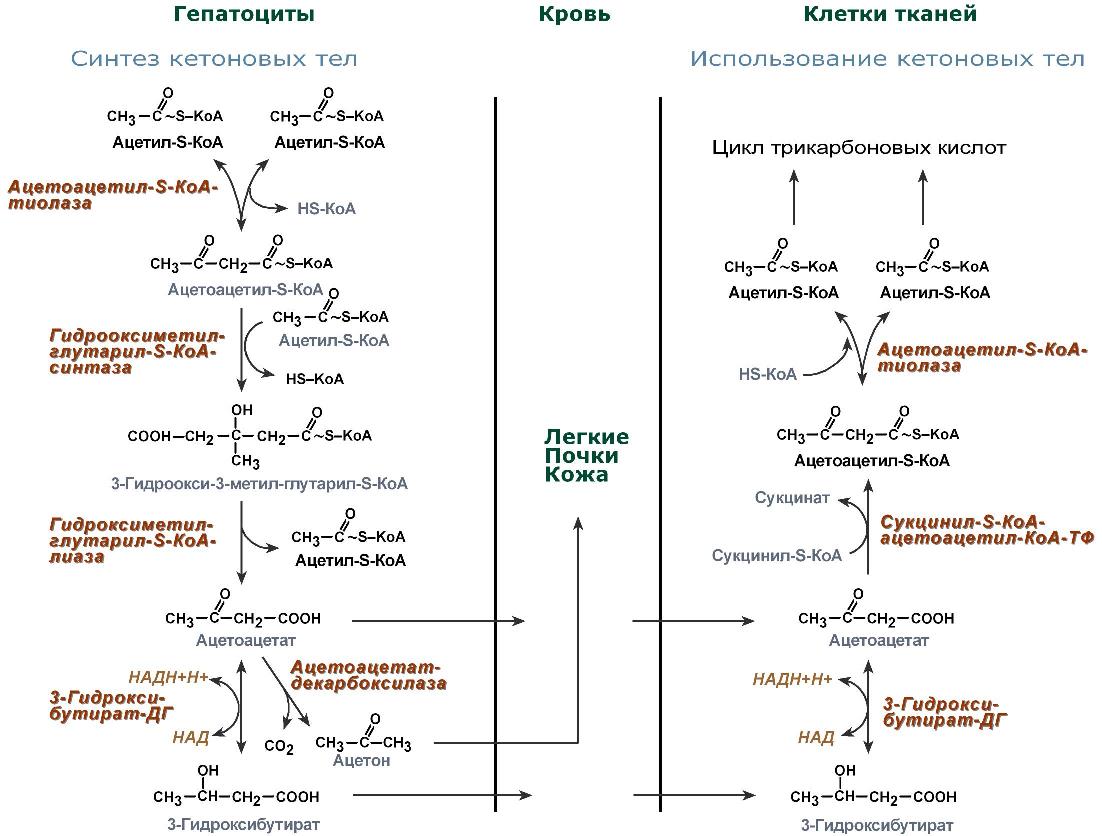
Реакции синтеза и утилизации кетоновых тел
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
При голодании синтез кетоновых тел ускоряется в 60 раз (повышение в крови до 0,6 г/л при норме менее 0,01 г/л), при сахарном диабете I типа – в 400 (!) раз (до 4 г/л).
При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел.
При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
Читайте также:

