Мембранная теория возникновения биопотенциалов в сердце кратко
Обновлено: 02.07.2024
Понятие равновесного мембранного потенциала. Механизмы прохождения ионов через поверхностную мембрану клетки. Принцип работы натрий-калиевого насоса. Характерные черты потенциалзависимых и рецепторуправляемых ионных каналов. Способы их активации.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 19.08.2015 |
| Размер файла | 413,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
ПРЕДСТАВЛЕНИЕ О МЕМБРАННОЙ ТЕОРИИ ПРОИСХОЖДЕНИЯ БИОПОТЕНЦИАЛОВ И ИОННЫХ КАНАЛАХ
Основные положения мембранной теории были сформулированы Бернштейном (1902), а затем развиты Бойлем и Конвеем (1941) и Ходжкиным, Катцем и Хаксли (1949, 1952). Современные электронно-микроскопические исследования говорят о том, что на поверхности клетки имеется двуслойная структура толщиной около 10 нм. Эта мембрана и обусловливает характер имеющих место электрофизиологических свойств нейронов. В покое только ионы калия способны проникать через мембрану. При этом концентрация ионов калия в цитоплазме значительно выше, чем в наружном растворе. Ионы калия, диффундируя через мембрану, выносят на поверхность нейрона положительный заряд до тех пор, пока не уравняются потоки калия внутрь и наружу. Следующее уравнение выражает равновесный мембранный потенциал:
где: V - разность потенциалов между наружной и внутренней поверхностями мембраны,
R - газовая постоянная,
Т - абсолютная температура,
F - число Фарадея,
[K]и [K] - соответственно внутренняя и наружная концентрации ионов калия.
Затем было обнаружено, что возбудимые мембраны хорошо проницаемы не только для ионов калия, но и для ионов хлора и, таким образом, мембранный потенциал является потенциалом равновесия не только для калия, но и для хлора, т.е.:
мембрана клетка ион насос
Таким образом, когда по обе стороны мембраны наблюдается такое соотношение концентраций, для ионов хлора создается устойчивое состояние, и тогда E, будет потенциалом равновесия для ионов хлора. Экспериментально показано, что для мотонейрона E= -70мВ, т.е. при нормальном потенциале покоя ионы хлора находятся в электрохимическом равновесии и при этом, согласно уравнению Нернста, существует 14-кратная разница в концентрациях ионов Cl снаружи (125мМ) и внутри (9мМ) клетки, что и создает разность потенциалов в -70мВ.
В отношении ионов калия экспериментально показано, что в нормевеличина E достигает примерно -90мВ. Таким образом, при потенциале покоя -70мВ электрохимический потенциал для ионов калия должен быть равен -20мВ. Внутренняя концентрация ионов калия (150мМ) приблизительно в 2 раза больше той, которая необходима для диффузионного равновесия при мембранном потенциале покоя. Следовательно, при потенциале покоя -70мВ выходящий из клетки диффузионный поток ионов калия должен быть вдвое больше потока, входящего в клетку. Устойчивое состояние для ионов калия может быть сохранено лишь в том случае, если недостаточность входящего потока будет компенсироваться работой какого-то механизма, нагнетающего ионы калия внутрь клетки и создающего ионный поток такой же интенсивности, какую имеет поток, обусловленный диффузией.
Что касается ионов натрия, то при мембранном потенциале покоя электрохимический потенциал для ионов натрия противоположен по направлению электрохимическому потенциалу для ионов калия и гораздо больше его по величине (составляя примерно 130мВ). Вследствие этого для ионов натрия входящий диффузионный поток превышает выходящий в 100 раз, и устойчивое равновесие достигается в том случае, когда выкачивание ионов натрия из клетки фактически равно диффузии этих ионов внутрь клетки.
Есть основание считать, что действие насоса, нагнетающего калий внутрь клетки, связано с действием насоса, выкачивающего натрий из клетки. При этом избыток анионов внутри клетки сохраняется, благодаря сочетанному действию Na-K насоса.
Значение потенциала покоя для разных возбудимых клеток составляет: в мотонейронах спинного мозга - -50-70мВ, в пирамидных клетках коры больших полушарий - -60мВ, в скелетно-мышечных волокнах - -90мВ.
Таким образом, выходящий калиевый ток преобладает над входящим натриевым током, что обусловливает образование на внутренней поверхности мембраны избытка отрицательных зарядов, представленных в основном крупными белковыми анионами, для которых мембрана непроницаема. Ионы калия, выходящие из клетки, удерживаются на наружной поверхности мембраны электростатическим полем, создаваемым отрицательным зарядом внутренней поверхности. Очевидно, что основную роль в формировании потенциала покоя играет мощный калиевый ток, выходящий из клетки по концентрационному градиенту (пассивный транспорт ионов). Эти отношения между входящим и выходящим током калия и натрия изображены на рис.1.
Под влиянием каких-либо воздействий может происходить либо уменьшение трансмембранной разности потенциалов (т.е. деполяризация мембраны), либо ее увеличение (т.е. гиперполяризация мембраны).
В основе описанных процессов лежат следующие мембранные механизмы. Деполяризация, достигшая критического уровня, приобретает регенеративный характер. При этом происходит лавинообразное открытие ворот натриевых каналов и формирование циклического взаимодействия с положительной обратной связью. Однако такой характер процесса сохраняется лишь до момента закрытия натриевых каналов (натриевая инактивация). Поскольку эта инактивация в каждом канале происходит со стабильной (но различной для разных возбудимых клеток) задержкой, то этот процесс закрытия натриевых ворот должен иметь такой же лавинообразный характер, как и открытия ворот. Инактивация предотвращает дальнейший рост внутриклеточной позитивности. Последующая быстрая реполяризация обусловлена не только продолжающейся натриевой инактивацией, но и активацией калиевых каналов, реагирующих на деполяризацию мембраны медленнее, чем натриевые каналы. Усиливающийся при этом выходящий ток ионов калия способствует негативизации внутренней поверхности мембраны. Описанная динамика ионных токов характерна для формирования ПД в нервных клетках и скелетно-мышечных волокнах. Следовые потенциалы, в тех случаях, когда они возникают, отражают соотношения деполязизующего натриевого и реполяризующего калиевого токов на этом этапе развития потенциала действия.
Механизм, поддерживающий разность вне- и внутриклеточных концентраций ионов натрия и калия возбудимых клеток посредством активного транспорта этих ионов против их концентрационного градиента, и представляет собой натрий-калиевый насос. Работа этого механизма требует затрат энергии, что принципиально отличает его от механизмов формирования потенциалов покоя и действия, в основе которых лежат пассивные ионные токи, обусловленные трансмембранными градиентами концентраций этих ионов. Активность натрий-калиевого насоса, по существу, компенсирует результаты пассивного трансмембранного транспорта ионов Na и K. Эффективность этой компенсации обнаруживается в том, что внутриклеточная концентрация этих ионов и их трансмембранные концентрационные градиенты поддерживаются на постоянном уровне, несмотря на то, что, во-первых, в процессе формирования мембранного потенциала покоя происходит мощный отток ионов калия из клетки и слабый, но непрерывный, приток в клетку ионов натрия, и, во-вторых, в процессе формирования каждого потенциала действия возникают кратковременные, но мощные входящие токи ионов натрия.
Внутренний механизм переноса ионов против концентрационного градиента окончательно не выяснен, однако известен общий принцип его работы. В качестве транспортного элемента выступает белковая макромолекула, фиксированная в плазматической мембране. Кроме транспортной функции она выполняет роль фермента Na-K-АТФазы, участвующего в энергетическом обеспечении активного транспорта ионов. Посредством своего натрий-селективного центра, расположенного на внутренней стороне мембраны, она связывает 3 иона натрия, который переносится на ее наружную сторону, где освобождается в межклеточную среду. Затем, в результате конформационных изменений, макромолекула приобретает сродство к калию и присоединяет 2 его иона. Образование этой связи стимулирует переход носителя на внутреннюю сторону мембраны и выделение ионов калия в цитоплазму. На этом этапе АТФазная активность макромолекулы, способствуя гидролизу АТФ до АДФ, энергетически обеспечивает процесс преобразования переносчика и приобретения им вновь сродства к натрию, на чем и заканчивается очередной транспортный цикл.
АТФазная активность и активность ионного насоса увеличивается при возрастании концентрации ионов калия во внешней среде и ионов натрия во внутренней. Эта зависимость имеет большое функциональное значение, т.к. указанные изменения концентрации ионов калия и натрия возникают как результат усиления активности нейронов, учащающих генерацию потенциалов действия.
Единичный ионный канал может быть в одном из двух состояний: либо открытым, либо закрытым. Эти изменения состояния происходят в результате конформационных изменений макромолекулы, открывающих или закрывающих канал на определенном его участке, называемом воротами. На рис.2 представлена клеточная мембрана и ионный канал.
Рис.2. Клеточная мембрана и ионный канал (А). Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковых молекул. Пронизывающие мембрану (трансмембранные) белки образуют ионные каналы ( B ). Схематичное представление ионного канала с центральной водной порой и воротным механизмом ( G ) (Из Николс и др., 2003)
Ионные каналы состоят из нескольких субъединиц. Каждая субъединица ионного канала представляет собой интегральный мембранный белок, содержащий трансмембранные сегменты, каждый из которых имеет альфа-спиральную конфигурацию в пределах мембраны. Несколько таких субъединиц формируют ионный канал.
Различают две группы ионных каналов - потенциалуправляемые (потенциалзависимые) и рецепторуправляемые. К последним относятся две подгруппы - лигандуправляемые (хемозависимые) и механоуправляемые.
За проведение ионов ответственны белковые компоненты мембраны. Одна субъединица интегрального мембранного белка содержит четыре трансмембранных сегмента. Некоторые белки имеют в составе одной субъединицы 12 трансмембранных сегментов. Среди ионных каналов есть селективные каналы (например, калиевый канал, натриевый канал) и неселективные (например, натрий-калиевый канал).
Характерной чертой потенциалуправляемых каналов является способность активироваться и инактивироваться только под влиянием трансмембранного электрического поля. Потенциалуправляемые ионные каналы состоят из устья, селективного фильтра, активационных и инактивационных ворот, состояние которых позволяет либо не позволяет ионам проходить через канал, и сенсора напряжения, управляющего работой ворот. Потенциалуправляемый канал может находиться в трех состояниях: покоя, активации и инактивации. Обычно он селективен для каждого сорта ионов.
В то же время лигандуправляемые каналы, как уже говорилось выше, меняют свою проницаемость в результате конформационных изменений белка канала после его связывания с лигандом.
Что же касается механоуправляемых каналов, то, как уже отмечалось выше, их состояние закрытия/открытия зависит от изменения натяжения мембраны, передающегося через мембранный бислой или цитоскелет, вследствие механического воздействия на клетку. Если вероятность открытого состояния механоуправляемого канала больше, чем закрытого, то этот канал называется stretch-activated channel, если же наоборот (т.е. вероятность закрытого состояния канала больше, чем открытого), то этот канал называется stretch-inactivated channel. Растяжение механоуправляемого ионного канала не изменяет ни его ионной селективности, ни его ионной проводимости. Изменения, вызванные растяжением, влияют лишь на вероятность того, будет ли канал открыт, либо закрыт. (рис. 3)
Рис.3. Способы активации ионных каналов. ( A ) Ионные каналы, активируемые изменением мембранного потенциала или растяжением мембраны. (В) Ионные каналы, активируемые химическими агентами, либо с внеклеточной, либо с внутриклеточной стороны. (Из Николс и др., 2003)
Потенциалзависимые натриевые каналы находятся в мембране нейронов (преимущественно аксонов) и мышечных волокон. В них имеются ворота двух видов: активационные, расположенные вблизи внеклеточного полюса макромолекулы, и ворота инактивационные, находящиеся в области ее внутриклеточного полюса. На уровне потенциала покоя у подавляющего большинства натриевых каналов активационные ворота закрыты, а инактивационные - открыты. Этим объясняется низкая натриевая проницаемость мембраны в покое.
Деполяризация мембраны приводит к открытию активационных ворот, благодаря чему повышается натриевая проницаемость мембраны. Однако такое состояние продолжается недолго, т.к. открытие активационных ворот автоматически включает инактивационный механизм, приводящий к закрытию инактивационных ворот. Таким образом, канал способен пропускать натрий лишь в течение определенного короткого времени (различного для мембран разных возбудимых клеток), после чего вновь резко снижается натриевая проницаемость мембраны. Это - состояние натриевой инактивации. При этом повторная деполяризация не способна при закрытых инактивационных воротах восстановить проницаемость этого канала. Возвращение мембранного потенциала к исходному уровню покоя, способствуя закрытию активационных и открытию инактивационных ворот, восстанавливает способность канала открываться под влиянием деполяризации мембраны.
Потенциалзависимые калиевые каналы также встроены в мембрану аксонов и мышечных волокон и обладают воротным механизмом. На уровне потенциала покоя большинство этих каналов открыты, чем обеспечивается высокая калиевая проницаемость. Деполяризация мембраны приводит к открытию дополнительных калиевых каналов, за счет чего увеличивается ее проницаемость для ионов калия. Однако активация калиевых каналов протекает медленнее, чем натриевых и, соответственно, усиление выходящего калиевого тока при деполяризации мембраны оказывается сдвинутым во времени по отношению к усилению натриевого тока. Инактивационных механизмов у калиевых каналов не обнаружено.
Потенциалзависимые кальциевые каналы расположены в мембране пресинаптических терминалей аксонов, оканчивающихся на других нейронах или клетках иннервируемых органов. Деполяризация мембраны этих терминалей, наступающая в результате прихода потенциала действия, открывает эти каналы, и кальций входит внутрь окончания по концентрационному градиенту (внеклеточная концентрация кальция больше, чем в 1000 раз, превышает концентрацию свободного кальция в цитоплазме). Этот входящий ток кальция играет ключевую роль в процессе выделения медиатора.
1. РАН, Отделение биологических наук. под ред. М.В. Угрюмова; рец.: Е.В. Гришин, А.А. Кубатеев: Нейродегенеративные заболевания - М.: Наука, 2010
2. Батуев А.С.: Физиология высшей нервной деятельности и сенсорных систем. - СПб.: Питер, 2009
3. Горелов А.А. Концепции современного естествознания. - М.: Юрайт, 2009
4. Горелов А.А. Концепции современного естествознания. - М.: Юрайт, 2009
5. Батуев А.С. Физиология высшей нервной деятельности и сенсорных систем. - СПб.: Питер, 2006
6. В.Н. Цыган, М.М. Богословский, В.Я. Апчел, И.В. Князькин: Физиология и патология сна. - СПб.: СпецЛит, 2006
7. Батуев А.С. Физиология высшей нервной деятельности и сенсорных систем. - СПб.: Питер, 2005
8. Под ред.: В.В. Гнездицкого, А.М. Шамшиновой: Опыт применения вызванных потенциалов в клинической практике. - М.: Научно-медицинская фирма "МБН", 2001
9. Смирнов В.М. Нейрофизиология и высшая нервная деятельность детей и подростков. - М.: Академия, 2000
Подобные документы
Ионные токи, протекающие через мембрану клетки. Мембранный потенциал для модели идеальной клетки. Формула потенциала покоя и постоянного поля. Равновесие ионов хлора. Электрическая модель мембраны. Участие ионных каналов в формировании потенциала покоя.
реферат [224,2 K], добавлен 24.10.2009
Изучение строения и определение биологических функций клеточных мембран. Разнообразие функций каналов и переносчиков ионов через мембрану. Роль (Na)-насоса в поддержании допустимого осмотического давления в клетке. Электрические характеристики мембран.
презентация [1,5 M], добавлен 05.03.2015
Эксперимент с фиксацией потенциала, понятие тока утечки. Токи ионов натрия и калия. Удобные фармакологические средства, позволяющие избирательно блокировать натриевые или калиевые токи. Зависимость ионных токов от мембранного потенциала, их инактивация.
контрольная работа [39,6 K], добавлен 26.10.2009
Потребление кислорода как основной показатель затраты энергии организмом. Возникновение потенциала покоя и энергия, которая на него затрачивается. Устройство и принцип действия внутренних "ионных насосов" и каналов, сферы их использования организмами.
реферат [19,6 K], добавлен 08.08.2009
Основные факты о строении клеточной мембраны. Общие представления о проницаемости. Перенос молекул через мембрану. Облегченная диффузия, пассивный и активный транспорт. Уравнение Фика. Сущность понятия "селективность". Строение и функции ионных каналов.
презентация [323,1 K], добавлен 19.10.2014
Кальциевые потенциалы действия. Описание процессов активации и инактивации каналов. Вклад открытых калиевых каналов в реполяризацию. Результаты экспериментов на аксоне кальмара с фиксацией потенциала. Роль кальция и натрия в возбуждении мембраны клетки.
контрольная работа [140,6 K], добавлен 26.10.2009
Особенности пассивного и активного транспорта веществ через мембрану, явления эндо- и экзоцитоза. Характеристика ионных каналов: ацетилхолиновый, натриевый, кальциевый. Функции поровых комплексов и поринов, молекулы используемые в качестве их моделей.
В основе возникновения электрических явлений в сердце лежит трансмембранное перемещение ионов К + , Na + , Ca 2+ , CI - в клетках миокарда. Внутри невозбужденной клетки находятся ионы К + , концентрация которого в 30 раз выше, чем во внеклеточной жидкости. Наоборот, во внеклеточной среде примерно в 25 раз больше Ca 2+ по сравнению с внутриклеточной средой. Такие высокие градиенты концентрации ионов по обе стороны мембраны поддерживаются благодаря функционированию в ней ионных насосов и требуют затраты энергии. В невозбужденной клетке мембрана более проницаема для К + и CI - .
Поэтому ионы К + в силу концентрационного градиента стремятся выйти из клетки, а ионы CI - , наоборот, входят внутрь клетки. Это приводит к поляризации клеточной мембраны: наружная ее поверхность становится положительной, а внутренняя – отрицательной. Возникающая разность потенциалов в такой ситуации ничтожно мала, тем не менее между наружной и внутренней поверхностью клеточной мембраны возникает трансмембранный потенциал покоя (ТМПП).
При возбуждении клетки резко изменяется проницаемость ее стенки для различных ионов. В частности, Na + устремляется внутрь клетки, а К + - из клетки. Происходит возникновение трансмембранного потенциала действия (ТМПД), который осуществляется в несколько фаз (фазы 0,1,2,3,4). Во время этих фаз благодаря меняющимся потокам основных ионов через мембрану клеток в сердечной мышце в целом осуществляются два основных процесса - деполяризации и реполяризации. Деполяризация происходит в фазу возбуждения клетки и характеризуется сменой заряда мембраны: внутренняя поверхность ее становится положительной, а наружная – отрицательной. Деполяризация осуществляется в фазу О, когда ТМПД достигает наибольшего значения, он несколько снижается в фазу 1, затем переходит в фазу 2, в течение которой величина ТМПД поддерживается примерно на одном уровне, что приводит к формированию на кривой ТМПД (плато). Во время деполяризации формируются зубцы Р, Q, R, S ЭКГ. Затем наступает процесс реполяризации: поляризация клетки возвращается к исходному состоянию (наружная поверхность ее оказывается снова заряженной положительно, а внутренняя – отрицательно). ТМПД падает и достигает величины ТМПП. Реполяризация захватывает фазы 2 и полностью 3 фазу ТМПД. В эту фазу формируется зубец Т электрокардиограммы.
Процессы деполяризации и реполяризации как отдельной клетки, так и в целом всего сердца происходят поэтапно. При этом возбужденный участок клетки заряжается отрицательно, невозбужденный – положительно. Таким образом, каждая клетка представляет своеобразный диполь со знаками минус (-) и плюс (+). В такой ситуации, как известно, возникает электродвижущая сила (ЭДС), вектор которой направлен от (–) к (+).
Если эти процессы рассматривать по отношению к работающему сердцу, то его можно рассматривать как один большой (суммированный) диполь, в котором есть отрицательный и положительный полюс. В частности, сердце возбуждается не все одновременно, а поэтапно. Импульс, приходящий из синусового узла возбуждает в первую очередь предсердия и они заряжаются отрицательно, в то же время желудочки остаются невозбужденными и они заряжены положительно. Формируется большой диполь со знаком минус у основания сердца и знаком плюс по направлению к желудочкам. Возникает суммированная ЭДС сердца, вектор которой почти совпадает с анатомической осью сердца и направлен сверху вниз, сзади наперед и справа налево.
Таким образом, работающее сердце – своеобразный генератор биотоков, вокруг которого, как известно, возникают электрические поля, которые пронизывают все тело и имеют разную полярность зарядов: вокруг отрицательно заряженных участков миокарда формируются отрицательные электрические поля, вокруг положительно заряженных – положительные электрические поля.
В такой ситуации не составляет трудностей присоединить в определенной последовательности электроды к участкам тела и при помощи специального прибора электрокардиографа зафиксировать биотоки в виде кривой электрокардиограммы.
МЕТОДИКА ЗАПИСИ ЭКГ.
Стандартные отведения в ЭКГ
Это двуполюсные отведения, когда оба электрода (отрицательный с правой руки и положительный – с левой) одинаково активны, поэтому могут частично нивелировать друг друга. В этом – один из недостатков стандартных отведений
Различают следующие три стандартные отведения (рис.41):
I отведение - правая рука - левая рука.
II отведение - правая рука - левая нога, суммационное;
III отведение - левая рука - левая нога.

Рис.41. Стандартные отведения (I,II,III)
Усиленные отведения от конечностей (по Гольдбергеру)
Это однополюсные отведения, где индифферентный электрод (О) присоединяется к отрицательному полюсу, активный - к положительному на одной из конечностей. Благодаря такой системе разность потенциалов между активным и индифферентным (нулевым) электродами увеличивается, что в целом улучшает качество записи и информативность этих отведений. Имеются 3 отведения от конечностей, их обозначают аббревиатурами аVR, аVL, аVF (рис.42). Первая буква а происходит от английского “augmented” (усиленный), буква V – “voltage” (вольтаж); последние буквы R, L, F указывают место локализации активного электрода: R (right) – на правой руке, L (left) – на левой руке, F (foot) – на левой ноге.

Рис.42. Усиленные отведения от конечностей (слева направо): аVR, аVL, аVF.
Грудные отведения (по Вильсону)
Это однополюсные отведения. Индифферентный электрод представляет соединенные электроды от конечностей. Активный электрод ставится в различные точки грудной клетки. 1-я точка (V1) помещается в 4-е межреберье справа от грудины, 2-я точка (V2) - 4-е межреберье слева от грудины, 3-я точка (VЗ) - на середине расстояния между V2 и V4. 4-я точка (V4) - в 5-м межреберье по левой среднеключичной линии. 5-я точка (V5) - по передней подмышечной линии на уровне V4, 6-я точка (V6) - по средней подмышечной линии на уровне V4. Основное назначение грудных отведений – топическая диагностика очаговых изменений в миокарде. В частности, при диагностике инфаркта миокарда отведения V1 - V2 отражают потенциалы межжелудочковой перегородки, VЗ – передней стенки левого желудочка, V4 – верхушки сердца, V5 - V6 – боковой стенки левого желудочка.
Грудные отведения позволяют также получить информацию о правых и левых камерах сердца. В частности, отведения V1 - V2 отражают потенциалы правого желудочка и правого предсердия, поэтому они называются правыми грудными отведениями; отведения V5 - V6 отражают, соответственно, потенциалы левого желудочка и называются левыми грудными отведениями. Отведения VЗ – V4 – переходная зона между правыми и левыми грудными отведениями.
Кроме вышеуказанных общепринятых 12 отведений могут применяться дополнительные грудные отведения (V7 – V9). Они позволяют лучше диагностировать инфаркты базальных отделов задней стенки левого желудочка. Электрод V7 устанавливается по задней подмышечной, V8 – по лопаточной, V9 – по паравентебральной линиям на уровне позиции V4, (т.е. в 5 межреберье).
Отведения по Небу: электроды с конечностей устанавливают на ограниченном участке передней грудной стенки: красный – во II межреберье у правого края грудины, желтый – в позицию V7, а зеленый – в позицию V4 (см. выше). Образуется своеобразный треугольник Эйнтховена, где I стандартное отведение будет соответствовать отведению Д (dorsalis) по Небу и отражает потенциалы заднебоковой стенки левого желудочка, II стандартное отведение будет соответствовать отведению А (anterior) по Небу и отражает потенциалы передней стенки левого желудочка, III стандартное отведение – отведение I (inferior) по Небу, отражает потенциалы нижних отделов левого желудочка. Особенно ценным является отведение Д, позволяющее лучше диагностировать инфаркт заднеебоковой стенки левого желудочка.
Прекордиальное картирование – методика, позволяющая выявить мелкие очаговые изменения в миокарде (в том числе и инфаркты), не доступные диагностике при рутинных отведениях. При этом на область сердца по определенной схеме накладывается от 35 до 60 электродов и с каждой точки записывается микро-ЭКГ. Последующий анализ по специальным картам-схемам позволяет выявить зоны очаговых изменений в миокарде.
НОРМАЛЬНАЯ ЭКГ.
На ЭКГ регистрируются зубцы, интервалы, сегменты и комплексы (рис.43).
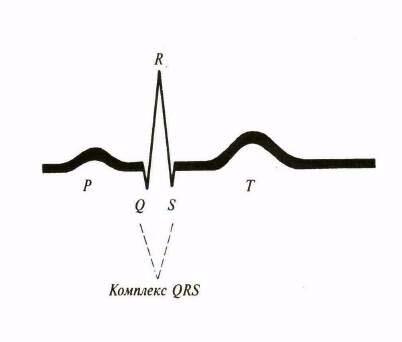
Рис.43. Графическое изображение нормальной электрокардиограммы
Интервал Р-Q (или Р-R) – атриовентрикулярная проводимость. Отражает время проведения импульса от синусового узла по предсердиям и А-В узлу к пучку Гиса и к мускулатуре желудочков. Измеряется от начала зубца Р до начала зубца Q (R). В норме его длительность составляет 0,12-0,18 сек (максимально до 0,20 сек).
Комплекс QRS - желудочковый комплекс. Ширина 0,06- 0,09 сек (до 0,1 сек). Отражает деполяризацию желудочков. 3убец Q отражает возбуждение передней части межжелудочковой перегородки. Он отрицательный, ширина не более 0,03 сек, глубина до ¼ зубца R. Зубец R отражает охват возбуждением основной массы миокарда желудочков, положительный. В стандартных отведениях он максимален во II отведении (высота 5-15 мм), в грудных – в V4. У здорового человека максимальная высота зубца R в стандартных отведениях допускается до 15-17мм, в грудных – до 20мм. Зубец S отражает конечное возбуждение желудочков. Он отрицательный, но в норме он может и отсутствовать. Наиболее глубокий в V1 и V2. По направлению к левым грудным отведениям он уменьшается. Его глубина в стандартных отведениях до 5 мм, в грудных - до 25 мм. В отведении V3 зубец R равен S – это соответствует переходной зоне.
Сегмент SТ - располагается между концом зубца S и началом Т. В норме он располагается на изолинии. Допустимые смещения вверх от изолинии не более 1 мм, вниз – не более 0,5 мм. Отражает отсутствие разности потенциалов в миокарде (или она слишком мала). Он соответствует периоду полного охвата возбуждением обоих желудочков или.
Зубец Т - отражает процесс реполяризации желудочков. Этот зубец положительный, отрицателен только в аVR. В III отведении у тучных лиц он может быть немного отрицательным, но становится положительным на ЭКГ, снятой во время глубокого вдоха. Амплитуда (высота) его находится в пределах 2-6 мм, она большая в тех отведениях, где выше зубец R и составляет до 1/3 от величины зубца R того же отведения. Продолжительность 0,12-0,16 сек., что существенного диагностического значения не имеет.
Интервал Q-Т - отражает электрическую систолу желудочков, включающую деполяризацию и реполяризацию. В норме его длительность 0,35 - 0,44 сек. Зависит от возраста и пола. Для оценки QT важны не его абсолютные значения, а сравнение с должными величинами (по специальным таблицам). При их отсутствии должный QT определяется по формуле Базетта: QT = К•R-R, где К – коэффициент, равный 0,37 для мужчин и 0,39 для женщин; R-R - длительность одного сердечного цикла.
Зубец U - происхождение его неизвестно. Конкретное диагностическое значение его не определено. Он положительный. На ЭКГ проявляется не всегда, располагается через 0,04сек после зубца Т.
Порядок расшифровки ЭКГ
1. Определяется правильность сердечного ритма. Анализируется форма и расположение зубца Р и одинаковость интервала R-R.
Признаки нормального синусового ритма:
Положительные зубцы Р во II стандартном отведении, отрицательные - в аVR.
Постоянная форма Р в каждом отведении.
Постоянная и нормальная величина интервала Р-Q.
Одинаковые расстояния R-R (разница не более 0,1 сек).
2. Подсчет частоты сердечного ритма.
Находят продолжительность интервала R-R в сек. ЧСС=60/(R-R).
3. Анализ вольтажа. Измеряют амплитуду зубцов R в стандартных отведениях. В норме она 5-15 мм. Если амплитуда самого большого зубца R не больше 5 мм или сумма всех зубцов R в трех стандартных отведениях меньше 15 мм, то вольтаж считается сниженным. Это бывает при экссудативных перикардитах, тяжелом поражении миокарда, выраженной эмфиземе легких, отеке мышц грудной клетки.
4. Определение положения электрической оси сердца.
Наконец, есть простой, но, к сожалению, не самый точный способ определения отклонения электрической оси сердца без определения величины угла α, визуально определяя соотношение зубцов R и S в трех стандартных отведениях (в порядке уменьшения их высоты, глубины). Здесь могут быть три классических варианта:
Нормограмма (нормальное положение эл. оси) - RII>RI>RIII.
Правограмма (отклонение электрической оси вправо) - RIII>RII>RI; SI>SII>SIII
При варианте RII=RI>RIII можно думать о тенденции к горизонтальной эл. оси, а при RII= RIII>RI – о тенденции к вертикальной электрической оси сердца.
5. Измерение продолжительности и величины отдельных зубцов, интервалов и комплексов по II стандартному отведению, а также оценка полярности и формы зубцов.
6. Расчет систолического показателя (СП). Систолический показатель – это продолжительность электрической систолы желудочков по отношению к продолжительности всего сердечного цикла, выраженная в процентах.
Он определяется по формуле: СП=QRST х100,
где QRST – продолжительность электрической систолы желудочков (в секундах), R-R – величина сердечного цикла (в секундах). Полученную величину сравнивают с должной величиной, приводимой в специальных таблицах. С другой стороны, если определить должную величину QRST по формуле Базетта, то не сложно определить и должные значения СП.
Если показатели СП отличаются от должных значений более чем на 1-2%, то это признак патологии. Увеличение СП свидетельствует об увеличении продолжительности систолы, что может быть при выраженных гипертрофиях миокарда, блокадах ножек пучка Гиса и др.
7. Общее заключение. Оно должно включать определение ритма, его правильность, ЧСС, вольтаж, электрическую ось сердца. При выявлении различных аритмий, очаговых изменений миокарда, они тоже должны быть отражены.
В основе возникновения электрических явлений в сердце лежит, как известно, проникновение ионов калия (К + ), натрия (Na + ), кальция (Са 2+ ), хлора (С1~) и других через мембрану мышечной клетки. В электрохимическом отношении клеточная мембрана представляет собой оболочку, обладающую разной проницаемостью для различных ионов. Она как бы разделяет два раствора электролитов, существенно отличающихся по своему составу. Внутри клетки, находящейся в невозбужденном состоянии, концентрация К + в 30 раз выше, чем во внеклеточной жидкости (рис. 1.1, а). Наоборот, во внеклеточной среде примерно в 20 раз выше концентрация Na + , в 13 раз выше концентрация С1~ и в 25 раз выше концентрация Са 2+ по сравнению с внутриклеточной средой. Такие высокие градиенты концентрации ионов по обе стороны мембраны поддерживаются благодаря функционированию в ней ионных насосов, с помощью которых ионы Na + , Ca 2+ и С1~ выводятся из клетки, а ионы К + входят внутрь клетки. Этот процесс осуществляется против концентрационных градиентов этих ионов и требует затраты энергии.
В не возбужден ной клетке мембрана более проницаема для К + и Сl - . Поэтому ионы К + в силу концентрационного градиента стремятся выйти из клетки, перенося свой положительный заряд во внеклеточную среду. Ионы СГ, наоборот, входят внутрь клетки, увеличивая тем самым отрицательный заряд внутриклеточной жидкости. Это перемещение ионов и приводит к поляризации клеточной мембраны невозбужденной клетки: наружная ее поверхность становится положительной, а внутренняя - отрицательной (рис. 1.1,6). Возникающая таким образом на мембране разность потенциалов препятствует дальнейшему перемещению ионов (К + — из клетки и Сl - — в клетку), и наступает стабильное состояние поляризации мембраны клеток сократительного миокарда в период диастолы. Если мы теперь с помощью микроэлектродов измерим разность потенциалов между наружной и внутренней поверхностью клеточной мембраны, как это показано на рисунке 1.1, в, то зарегистрируем так называемый трансмембранный потенциал покоя (ТМПП), имеющий отрицательную величину, в норме составляющую около -90 mV
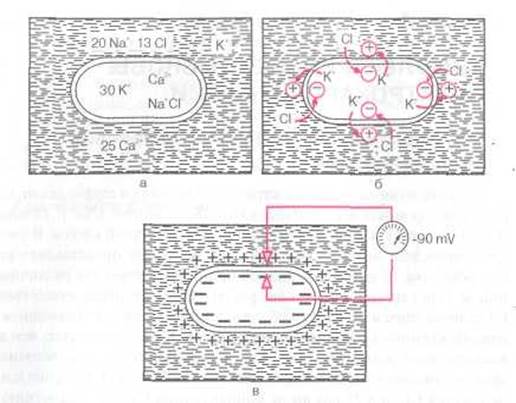 |
Рис. 1.1. Поляризация клеточной мембраны невозбужденной клетки: а - соотношение концентрации ионов Na + , K + , Сl- и Со 2+ внутри клетки и во внеклеточной жидкости; б — перемещение ионов K+ и С1- вследствие концентрационного градиента; в — регистрация трансмембранного потенциала покоя
При возбуждении клетки резко изменяется проницаемость ее стенки по отношению к ионам различных типов. Это приводит к изменению ионных потоков через клеточную мембрану и, следовательно, к изменению величины самого ТМПП. Кривая изменения трансмембранного потенциала во время возбуждения получила название трансмембранного потенциала действия (ТМПД). Различают несколько фаз ТМПД миокар-диальной клетки (рис. 1.2).
Фаза 0. Во время этой начальной фазы возбуждения — фазы деполяризации - резко увеличивается проницаемость мембраны клетки для ионов Na + , которые быстро устремляются внутрь клетки (быстрый натриевый ток). При этом, естественно, меняется заряд мембраны: внутренняя поверхность мембраны становится положительной, а наружная - отрицательной. Величина ТМПД изменяется от -90 mV до +20 mV, т.е. происходит реверсия заряда — перезарядка мембраны. Продолжительность этой фазы не превышает 10 мс.
 |
Рис. 1.2. Трансмембранный потенциал действия (ТМПД). Объяснение в тексте. АРП и ОРП — абсолютный и относительный рефрактерные периоды
Фаза 1. Как только величина ТМПД достигнет примерно +20 mV,проницаемость мембраны для Na + уменьшается, а для С1 - увеличивается. Это приводит к возникновению небольшого тока отрицательных ионов Сl- внутрь клетки, которые частично нейтрализуют избыток положительных ионов Na внутри клетки, что ведет к некоторому падению ТМПД примерно до 0 или ниже. Эта фаза носит название фазы начальной быстрой реполяризации.
Фаза 2. В течение этой фазы величина ТМПД поддерживается примерно на одном уровне, что приводит к формированию на кривой ТМПД своеобразного плато. Постоянный уровень величины ТМПД поддерживается при этом за счет медленного входящего тока Са 2+ и Na + , направленного внутрь клетки, и тока К + из клетки. Продолжительность этой фазы велика и составляет около 200 мс. В течение фазы 2 мышечная клетка остается в возбужденном состоянии, начало ее характеризуется деполяризацией, окончание - реполяризацией мембраны.
Фаза 3. К началу фазы 3 резко уменьшается проницаемость клеточной мембраны для Na + и Са 2+ и значительно возрастает проницаемость ее для К + . Поэтому вновь начинает преобладать перемещение ионов К + наружу из клетки, что приводит к восстановлению прежней поляризации клеточной мембраны, имевшей место в состоянии покоя: наружная ее поверхность вновь оказывается заряженной положительно, а внутренняя поверхность — отрицательно.
ТМПД достигает величины ТМПП. Эта фаза носит название фазы конечной быстрой рвполяризации.
| Запомните! Наружная поверхность клеточной мембраны заряжена: 1) положительно — в невозбужденной мышечной клетке, находящейся в состоянии покоя; 2) отрицательно — в клетке, находящейся в состоянии возбуждения в фазе 0 и 1 ТМПД |
Основные функции сердца
Сердце обладает рядом функций, определяющих особенности его работы.
Функция автоматизма
Функция автоматизма заключается в способности сердца вырабатывать электрические импульсы при отсутствии внешних раздражений.
Функцией автоматизма обладают клетки синоатриального узла (СА-узла) и проводящей системы сердца: атриовентрикуляркого соединения (АВ-соединения), проводящей системы предсердий и желудочков. Они получили название клеток водителей ритма — пейсмеке-ров (от англ. pacemaker — водитель). Сократительный миокард лишен функции автоматизма.
Если в норме ТМПД сократительных мышечных клеток в течение всей диастолической фазы (фазы 4 ТМПД) стабильно поддерживается на одном и том же уровне, равном примерно -90 mV, для волокон водителей ритма (пейсмекеров) характерно медленное спонтанное уменьшение 4 мембранного потенциала в диастолу, как это показано на рисунке 1.3. Этот процесс носит название медленной спонтанной диастолической деполяризации и возникает в результате особых свойств мембраны пейсмекеров — постепенного самопроизвольного увеличения в диастолу проницаемости мембраны для ионов Na + , медленно входящих в клетку. В результате скопления в клетке все большего количества положительных ионов отрицательный заряд внутренней поверхности клеточной мембраны частично нейтрализуется и разность потенциалов между наружной и внутренней поверхностью мембраны (ТМПП) постепенно уменьшается. Как только ТМПП достигнет критического уровня (примерно —60 mV), проницаемость мембраны для ионов Na+ резко и быстро возрастает, что приводит к возникновению быстрой лавинообразной деполяризации клетки (фаза 0 ТМПД) — ее возбуждению, которая является импульсом к возбуждению других клеток миокарда.
Понятно, что чем выше скорость спонтанной диастолической деполяризации, тем чаще в клетках водителя ритма возникают электрические импульсы. В норме максимальной скоростью диастолической деполяризации и максимальной автоматической активностью обладают клетки СА-узла, который вырабатывает электрические импульсы с частотой около 60-80 в минуту. Это центр автоматизма первого порядка (рис. 1.4).

Рис. 1.3. Спонтанная диастолическая деполяризация волокон водителей ритма — пейсмекеров. Объяснение в тексте.
а — ТМПД мышечных клеток; б — ТМПП клеток пейсмекеров
Функцией автоматизма обладают некоторые участки проводящей системы предсердий и АВ-соединение - зона перехода атрио-вентрикулярного узла (АВ-узла) в пучок Гиса 1 ( 1 По Международной анатомической номенклатуре - предсердно-желудочковый пучок.)(см. рис. 1.4). Эти участки проводящей системы сердца, являющиеся центрами автоматизма второго порядка, могут продуцировать электрические импульсы с частотой 40—60 в минуту. Следует подчеркнуть, что сам АВ-узел, также входящий в состав АВ-соединения, не обладает функцией автоматизма.
Наконец, центрами автоматизма третьего порядка, обладающими самой низкой способностью к автоматизму (25—45 импульсов в минуту), являются нижняя часть пучка Гиса, его ветви и волокна Пуркинье 2 ( 2 По Международной гистологической номенклатуре — сердечный проводящий миоцит). Однако в норме возбуждение сердца происходит только в результате импульсов, возникающих в волокнах СА-узла, который является единственным нормальным водителем ритма. Дело в том, что в условиях сравнительно частой импульсации СА-узла подавляется автоматизм клеток АВ-соединения, пучка Гиса и волокон Пуркинье. Последние являются только потенциальными, или латентными, водителями ритма. При поражениях СА-узла функцию водителя ритма могут взять на себя нижележащие отделы проводящей системы сердца - центры автоматизма II и даже III порядка.
| Запомните! 1.Все волокна проводящей системы сердца (кроме средней части АВ-узла) потенциально обладают функцией автоматизма. 2. В норме единственным водителем ритма является СА-узел, который подавляет автоматическую активность остальных (эктопических) водителей ритма сердца. На функцию СА-узла и других водителей ритма большое влияние оказывает симпатическая и парасимпатическая нервная система: активация симпатической системы ведет к увеличению автоматизма клеток СА-узла и проводящей системы, а парасимпатической системы — к уменьшению их автоматизма. |
Функция проводимости
Функция проводимости — это способность к проведению возбуждения, возникшего в каком-либо участке сердца, к другим отделам сердечной мышцы.
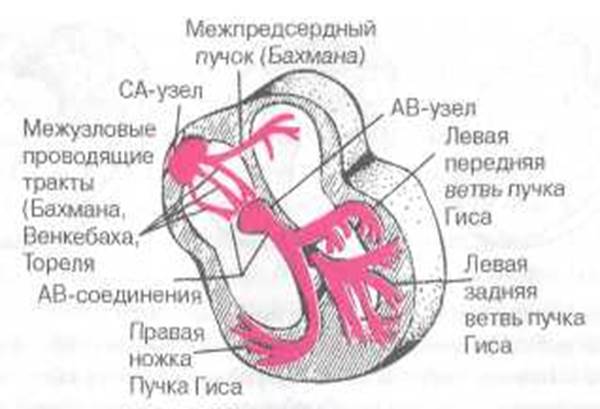
Рис. 1.4. Проводящая система сердца. Объяснение в тексте
Функцией проводимости обладают как волокна специализированной проводящей системы сердца, так и сократительный миокард, однако в последнем случае скорость проведения электрического импульса значительно меньше.
Следует хорошо усвоить последовательность и особенности распространения возбуждения по различным отделам проводящей системы сердца. В норме волна возбуждения, генерированного в клетках СА-узла, распространяется по короткому проводящему пути на правое предсердие, по трем межузловым трактам — Бахмана, Венкебаха и Торе-ля — к АВ-узлу и по межпредсердному пучку Бахмана — на левое предсердие (см. рис. 1.4). Возбуждение распространяется по этим проводящим трактам в 2-3 раза быстрее, чем по миокарду предсердий. Общее направление движения волны возбуждения — сверху вниз и несколько влево от области СА-узла к верхней части АВ-узла. Вначале возбуждается правое предсердие, затем присоединяется левое, в конце возбуждается только левое предсердие (рис. 1.5). Скорость распространения возбуждения здесь невелика и составляет в среднем около 30—80 см C -1 . Время охвата волной возбуждения обоих предсердий не превышает 0,1 с.
| Запомните! !. Направление распространения волны возбуждения по предсердиям — сверху вниз и немного влево. 2.Вначале возбуждается прапое, затем правое и левое предсердия, в конце — только левое предсердие. 3.Время охвата возбуждением предсердий не превышает в норме 0.1 с. |

Рис.1.5. Распространение возбуждения по предсердиям: а — начальное возбуждение правого предсердия; б — возбуждение правого и левого предсердий; в — конечное возбуждение левого предсердия. Красным цветом показаны возбужденные (заштрихованные) и возбуждающиеся в настоящий момент (сплошные) участки. Pı Рıı Рııı моментные векторы деполяризации предсердий
В АВ-узле и особенно в пограничных участках между АВ-узлом и пучком Гиса происходит значительная задержка волны возбуждения, скорость проведения не более 2—5 см с-1. Задержка возбуждения в АВ-узле способствует тому, что желудочки начинают возбуждаться только после окончания полноценного сокращения предсердий.
| Запомните! 1. В АВ-узле происходит физиологическая задержка волны возбуждения, определяющая нормальную временную последова тельность возбуждения предсердий и желудочков. 2.При учащении сердечных импульсов, исходящих из СА-узла или предсердий, более 180—220 в минуту даже у здорового челове ка может наступить частичная атриовентрикулярная блокада про- ведения электрического импульса от предсердий к желудочкам. |
От АВ-узла волна возбуждения передается на хорошо развитую внут-рижелудочковую проводящую систему, состоящую из предсердно-желу-дочкового пучка (пучка Гиса), основных ветвей (ножек) пучка Гиса и волокон Пуркинье. В норме скорость проведения по пучку Гиса и его ветвям составляет 100-150 см с- 1 , а по волокнам Пуркинье - 300-400 см с -1. Большая скорость проведения электрического импульса по проводящей системе желудочков способствует почти одновременному охвату желудочков волной возбуждения и наиболее оптимальному и эффективному выбросу крови в аорту и легочную артерию. В норме общая продолжительность деполяризации желудочков колеблется от 0,08 до 0,10 с.
Для правильного понимания генеза различных зубцов ЭКГ необходимо хорошо знать нормальную последовательность охвата возбуждением (деполяризацией) миокарда желудочков. Поскольку волокна Пуркинье преимущественно располагаются в субэндокардиальных отделах желудочков, именно эти отделы возбуждаются первыми, и отсюда волна деполяризации распространяется к субэпикардиальным участкам сердечной мышцы (рис. 1.6). Процесс возбуждения желудочков начинается с деполяризации левой части межжелудочковой перегородки в средней ее трети (рис. 1.6, а). Фронт возбуждения при этом движется слева направо и быстро охватывает среднюю и нижнюю части межжелудочковой перегородки. Почти одновременно происходит возбуждение апикальной (верхушечной) области, передней, задней и боковой стенок правого, а затем и левого желудочка. Здесь возбуждение распространяется от эндокарда к эпикарду и волна деполяризации преимущественно ориентирована сверху вниз и вначале направо, а затем начинает отклоняться влево.
Через 0,04-0,05 с волна возбуждения уже охватывает большую часть миокарда левого желудочка, а именно его апикальную область, переднюю, заднюю и боковые стенки. Волна деполяризации при этом ориентирована сверху вниз и справа налево (рис. 1.6, б).
Последними в период 0,06—0,08 с возбуждаются базальные отделы левого и правого желудочков, а также межжелудочковой перегородки. При этом фронт волны возбуждения направлен вверх и слегка направо, как это показано на рисунке 1.6, в.

Рис.1.6. Распространение возбуждения по сократительному миокарду желудочков:
а - возбуждение (деполяризация) межжелудочковой перегородки (0,02 с); б - деполяризация верхушек, передней, задней и боковой стенок желудочков (0,04—0,05с); в — деполяризация базальных отделов левого и правого желудочков и межжелудочковой перегородки (0,06—0,08с). Цветовые обозначения те же, что и на рисунке 1.5
Все клетки живого организма поляризованы. Между внутренней средой клетки и внешней средой существует разность потенциалов, которая носит название мембранного потенциала. В случае возбудимых тканей он называется потенциалом покоя. Его величина в разных тканях неодинакова.
Существование животного электричества открыл Л.Гальвани в 1791 г. Гипотеза, объясняющая происхождение мембранного потенциала была выдвинута Чаговцем в 1896 г, получила дальнейшее развитие в трудах Бернштейна ( 1902 г) и превратилась в теорию после экспериментальной проверки группой экспериментаторов ( Ходжкин, Катц, Хаксли 1949-1952 гг).
Согласно этой теории, потенциал покоя возникает вследствие неравномерного распределения ионов внутри клетки по от- ношению к внешней среде, а также селективных свойств мембраны.
Селективность мембраны обусловливает ее важнейшее свойство – полупроницаемость. В состоянии покоя проницаемость для калия, натрия и хлора неодинаковы:
Р калия : Р натрия : Р хлора = 1 : 0,04 : 0, 45
В связи с наилучшей проницаемостью мембраны и выраженным концентрационным градиентом, катионы калия выходят через калиевые каналы из клетки. При этом клетка теряет положительно заряженные ионы и приобретает отрицательный заряд. Силами электростатического взаимодействия катионы калия удерживаются на наружной стороне мембраны, являясь материальным носителем ее положительного заряда. Носителями отрицательного заряда внутренней стороны мембраны являются крупные органические анионы.

По мере выхода калия клетка все больше поляризуется. При этом все больше нарастает сила, обусловленная электрическим градиентом, препятствующая выходу положительно заряженных ионов калия. В со- стоянии покоя выходящий ток калия (по концентрационному градиенту) и входящий ток ( по электрохимическому градиенту ) уравновешиваются и мембранный потенциал становится стабильным от -60 до -80 мв.
В зависимости от его величины мембрана может быть поляризована (величина мембранного потенциала равна потенциалу покоя), деполяризована (мембранный потенциал меньше потенциала покоя), гиперполяризована (мембранный потенциал больше потенциала покоя).
Возможные изменения мембранного потенциала будут возникать или при нарушении градиентов, или при изменениях проницаемости мембраны ( наиболее распространенная ситуация ). Для катионов калия можно рассчитать по формуле Нернста равновесный калиевый потенциал:

Свой вклад в потенциал покоя вносят другие потенциалобразующие ионы ( натрий, хлор, кальций ). Для каждого из них можно рассчитать равновесный потенциал по формуле Нернста. Суммарная величина мембранного потенциала приближается к сумме равновесных протенциалов основных потенциалобразующих ионов.

В процессе поляризации мембраны клетка теряет катионы калия и получает ионы натрия и хлора, однако нарушения ионного градиента не происходит. Обеспечение постоянства последнего связано с деятельностью механизмов активного транспорта ионов ( ионных насосов). Перенос калия внутрь клетки и натрия наружу обеспечивается котранспортом этих ионов.
Основной перенос осуществляется калий- натриевым насосом (АТФазой) . Этот механизм является электрогенным, поскольку на 2 катиона калия, переносимого внутрь клетки, наружу переносится 3 катиона натрия. Тем самым происходит увеличение разности потенциалов клеточной мембраны (до 25% от общей величины потенциала покоя), рис. 10.
Читайте также:

