Механизм окислительного декарбоксилирования пировиноградной кислоты кратко
Обновлено: 02.07.2024
1. Окислительное декарбоксилирование пировиноградной кислоты
Локализация процесса, реакции, ферменты, коферменты,
биоэнергетика процесса, значение для организма.
Выполнила:
Студентка группы М-21-1-17
Глазкова Анастасия Николаевна
2. Пировиноградная кислота
3. Окислительное декарбоксилирование пировиноградной кислоты
Суммарное уравнение реакции отражает декарбоксилирование
пирувата, восстановление НАД до НАДН и образование ацетил-KoA.
Суммарный результат многостадийной реакции выглядит следующим
образом:
O
H 3C
C
Пируват
C
O
OH + NAD+
+ HS
KoA
H 3C
C
Ацетил-КоА
KoA
+ NADH + CO 2
O
Реакцию катализируют три фермента, работающие в
определенной последовательности и объединенные
в пируватдегидрогеназный комплекс
(ПДК), прикрепленным к внутренней митохондриальной
мембране со стороны матрикса, в состав которого входит 5
коферментов.
4. Окислительное декарбоксилирование пировиноградной кислоты
Пируватдегидрогеназный комплекс
Фермент
Кофермент
Витамин
Пируватдегидрогеназа (Е1)
Катализирует 1-ю реакцию.
ТДФ
(тиаминдифосфат)
В1
Дигидролипоилтрансацетилаза (Е2)
Катализирует 2-ю и 3-ю реакции.
Липоамид
HS-КоА
Липоевая кислота
Пантотеновая
кислота
ФАД
НАД+
В2
РР
Дигидролипоилдегидрогеназа (Е3)
Катализирует 4-ю и 5-ю реакции.
5. Окислительное декарбоксилирование пировиноградной кислоты
Пируватдекарбоксилаза (Е1). В качестве
кофермента в реакции участвует тиаминдифосфат
(ТДФ) — производное витамина В1. Фермент
катализирует отщепление карбоксильной группы в
виде СО2 и присоединение ацетильного остатка к
коферменту ТДФ.
Дигидролипоилтрансацетилаза (Е2) — второй
фермент комплекса. Катализирует окисление
гидроксиэтильной группы и перенос ацетильной
группы на липоевую кислоту, а затем на HS-КоАс
образованием ацетил-КоА.
6. Окислительное декарбоксилирование пировиноградной кислоты
7. Окислительное декарбоксилирование пировиноградной кислоты
Таким образом, в этой реакции участвуют два
кофермента: липоевая кислота, прочно соединенная с
ферментом, икофермент А, объединяющийся с ферментом в
момент реакции. Водород остается связанным с липоевой
кислотой, которая превращается в дигидролипоат.
Дигидролипоилдегидрогеназа (Е3) — FAD,
содержащий флавопротеин, катализирует дегидрирование
восстановленной формы липоевой кислоты и перенос
водорода на FAD (прочно связанный с ферментом), а затем
на свой второй кофермент NAD+, который включается в
состав комплекса только во время реакции.
8. Окислительное декарбоксилирование пировиноградной кислоты
S
NH
S
NH
CH2
CH2
CH2
CH2
CH2
C
( CH2 )4
O
Дегидролипоевая кислота
Строение липоильного остатка в составе
дигидролипоилтрансацетилазы
CH
C
O
Лизин
9. Окислительное декарбоксилирование пировиноградной кислоты
Реакции
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется
пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на
коэнзим А (катализируетсядигидролипоамид-ацетилтрансферазой,Е2).
Первую реакцию катализирует Е1, субстратами являются ПВК и
дегидролипоевая кислота, являющаяся простетической группой Е2. От ПВК
отщепляется карбоксильная группа и образуется СО2, а ацетильный остаток
соединяется с атомом серы липоевой кислоты в составе ацетилтрансферазы.
Образуется ацетиллипоат-Е2.
Во второй реакцииацетилтрансфераза (Е2) катализирует перенос ацетильного остатка,
соединенного с его простетической группой, на коэнзим А. Продукты этой реакции дигидролипоевая кислота в составе Е2 и ацетил-KоА.
В третьей реакции происходит дегидрирование дигидролипоевой кислоты в составе
ацетилтрансферазы при воздействии фермента Е3 (дегидрогеназа дигидролипоевой
кислоты), содержащего ФАД. ФАД передает водород на НАД+. Образуются НАДН+Н+ и
дегидролипоевая кислота в составе Е2. Последний фермент снова вступает в
окислительное декарбоксилирование ПВК.
Ацетил-KоА (продукт второй реакции) затем окисляется в цикле Кребса. Водород с НАДН
(продукт третьей реакции) поступает в дыхательную цепь, где образуется АТФ.
Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в
окисленное состояние (катализируются дигидролипоат-дегидрогеназой, Е3). При этом
образуется НАДН.
15. РЕГУЛЯЦИЯ ПИРУВАТДЕГИДРОГЕНАЗНОГО КОМПЛЕКСА
• РЕГУЛЯЦИЯ ПИРУВАТДЕГИДРОГЕНАЗНОГО КОМПЛЕКСА В
пируватдегидрогеназном комплексе имеются еще 2 вспомогательных фермента –
киназа и фосфатаза, участвующие регуляции активности пируватдегидрогеназы
(Е1) путем фосфорилирования и дефосфорилирования.
Киназа активируется при избытке
АТФ и продуктов реакции – НАДН
и ацетил-SКоА. При этом она
фосфорилирует
пируватдегидрогеназу,
инактивируя ее.
Фосфатаза, активируясь ионами
кальция или инсулином,
отщепляет фосфат и активирует
пируватдегидрогеназу.
16. Окислительное декарбоксилирование пировиноградной кислоты и биологическая роль
Биологическая роль
окислительного
декарбоксилирования пирувата
заключается в том, что оно
является важным этапом
катаболизма, позволяющим
включаться в цикл Кребса тем
веществам, при распаде которых
образуется ПВК.
Образовавшаяся молекула
НАДН2 окисляется в длинной
дыхательной цепи с
образованием 3-х молекул АТФ.
На I стадии этого процесса пируват (рис. 10.8) теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н + .
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-поамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД).
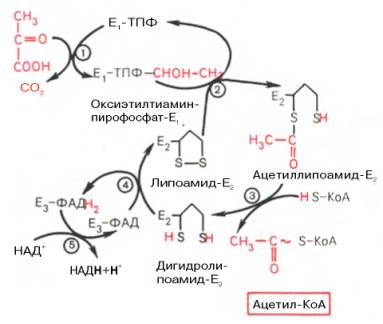
Рис. 10.8. Механизм действия пируватдегидрогеназного комплекса.
Е1 - пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3 -дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.
Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД + + HS-KoA –> Ацетил-КоА + НАДН + Н + + СO2.
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.
Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбо-ксилирование пирувата, происходит в митохондриях клеток.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
ЦЕНТРАЛЬНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ:
ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА,
ЦИКЛ ТИКАРБОНОВЫХ КИСЛОТ
ЦЕНТРАЛЬНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
Основными поставщиками восстановленных субстратов являются центральные метаболические пути, а именно, окислительное декарбоксилирование пировиноградной кислоты и цикл лимонной кислоты. Они локализованы в матриксе митохондрий, в ходе этих процессов происходят реакции декарбоксилирования (большая часть всей углекислоты, образующейся в клетках, образуется именно здесь). Кроме того, в ходе этих процессов происходят реакции дегидрирования субстратов, образуются восстановленные коферментные формы НАДН·Н + и ФАДН2, водород которых поступает в дыхательную цепь внутренней мембраны митохондрий, где происходит его окисление кислородом до воды и синтез АТФ.

ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА
Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается до молочной кислоты. В аэробных условиях происходит ее окислительное декарбоксилирование до уксусной кислоты, переносчиком которой служит коэнзим А.


Суммарное уравнение реакции отражает декарбоксилирование пирувата, восстановление НАД до НАДН Н + и образование ацетил-SKoA.
Окислительное декарбоксилирование пирувата состоит из пяти последовательных реакций и осуществляется при участии набора ферментов, объединенных в пируватдегидрогеназный комплекс (ПВДГК). Это мультиферментная система, которая включает 3 фермента и 5 коферментов (все они являются водорастворимыми витаминами).
Е1 — пируватдекарбоксилаза. Коферментом является активная форма витамина В1, тиамина — ТПФ (тиаминпирофосфат).
Е2 — дигидролипоилацетилтрансфераза. Коферментом является витаминоподобное вещество — липоевая кислота (липоил), которая может временно превращаться в дигидролипоил, присоединив 2 атома водорода. Липоил может также переносить ацетильные остатки.
С этим ферментом также работает активная форма пантотеновой кислоты — КоА-SH, которая принимает ацетильный остаток от липоевой кислоты.
Е3 — дигидролипоилдегидрогеназа. Коферментом является ФАД — активная форма витамина В2, рибофлавина. С работой этого фермента связан также кофермент НАД + — активная форма витамина РР, никотиновой кислоты.
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируется Е2).

Оставшиеся 2 реакции необходимы для возвращения липоевой кислоты и ФАД в окисленное состояние (катализируются Е3). При этом образуется


Таким образом, в результате образуются конечные продукты — СО2, атомы водорода для дыхательной цепи в составе НАДН·Н + и макроэргическое соединение ацетил- S КоА.
Лимитирующей реакцией в этом процессе является пируватдекарбоксилазная реакция. Поскольку фермент
Е1- пируватдекарбоксилаза в качестве кофермента использует ТПФ, при недостатке тиамина в пище нарушается окисление пирувата — процесса, который поставляет клеткам энергию. Возникает энергодефицит, что требует коррекции нарушения метаболизма с помощью тиамина. Схема регуляции работы пиуватдегидогеназного комплекса предствалена на рисунке (слайде).

ЛИМОННОКИСЛЫЙ ЦИКЛ КРЕБСА,
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦТК)
Цикл лимонной кислоты локализован в матриксе митохондрий. Это циклический процесс из восьми последовательных реакций, в результате которых происходит декарбоксилирование и дегидрирование ацетил-КоА (универсального клеточного топлива).
Цикл начинается с конденсации ацетил-КоА с 4-углеродной кетокислотой — щавелевоуксусной (ЩУК). В результате образуется трикарбоновая кислота – лимонная, или цитрат. Изомеризация цитрата ведет к образованию изоцитрата. В ходе последовательных реакций изоцитрат де-карбоксилируется и одновременно дегидрируется (фермент изоцитратДГ). Образовавшийся альфа-кетоглутарат также декарбоксилируется и дегидрируется. Образовавшийся макроэрг сукцинил-КоА служит источником энергии для синтеза АТФ (субстратное фосфорилирование в цикле Кребса). В результате еще двух дегидрирований (ферменты сукцинатДГ и малатДГ) ЩУК регенерирует и запускает новый оборот цикла Кребса.
Таким образом, наряду с конечным продуктом обмена — СО2, в четырех дегидрогеназных реакциях трижды восстанавливается НАД+ (изоцитратДГ, альфа-кетоглутаратДГ, малатДГ) и один раз восстанавливается ФАД (сукцинатДГ). Чтобы цикл мог функционировать, необходимо окислить эти коферменты, т. е. передать атомы водорода в дыхательную цепь, где происходит их окисление кислородом до воды.


Функции цикла Кребса
1. Интегративная функция. Цикл Кребса является связующим звеном между реакциями катаболизма и анаболизма.
2. Катаболическая функция. В ходе ЦТК окисляются до конечных продуктов обмена ацетильные остатки, образовавшиеся из топливных молекул (глюкоза, жирные кислоты, глицерол, аминокислоты).
3. Анаболическая функция. Субстраты ЦТК являются основой для синтеза многих молекул (кетокислоты — α-кетоглутарат и ЩУК — могут превращаться в аминокислоты глутамин и аспарагин; ЩУК может превращаться в глюкозу, сукцинил-КоА используется на синтез гема).
4. Водороддонорная функция. Цикл Кребса поставляет субстраты для дыхательной цепи (НАД-зависимые субстраты: изоцитрат, альфа-кетоглутарат, малат; ФАД-зависимый субстрат – сукцинат).
5. Энергетическая функция. На уровне сукцинил-КоА происходит субстратное фосфорилирование с образованием 1 молекулы макроэрга. Помимо этого, 4 дегидрогеназные реакции в цикле Кребса создают мощный поток электронов, богатых энергией. Эти электроны поступают в дыхательную цепь внутренней мембраны митохондрий. Конечным акцептором электронов является кислород. При последовательном переносе электронов на кислород выделяется энергия, достаточная для образования 9 молекул АТФ путем окислительного фосфорилирования.
Несмотря на постоянную убыль субстратов в результате анаболической функции, цикл Кребса не прерывается благодаря анаплеротическим реакциям, которые пополняют фонд его субстратов. Важнейшей анаплеротической реакцией является образование ЩУК (молекулы, запускающей цикл) путем карбоксилирования ПВК.
Регуляция ЦТК
1. Главным и основным регулятором ЦТК является доступность оксалоацетата. Наличие оксалоацетата вовлекает в ЦТК ацетил-SКоА и запускает процесс.
В клетке имеется баланс между образованием ацетил-SКоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является синтез из пирувата (анаплеротическая или пополняющая реакция), поступление из фруктовых кислот самого ЦТК (яблочной, лимонной), образование из аспарагиновой кислоты.

2. Ферменты ЦТК являются чувствительными к аллостерической регуляции метаболитами.
Например, первый фермент цитратсинтаза ингибируется АТФ, жирными кислотами. Лимитирующим ферментом (катализирует самую медленную реакцию) является изоцитратДГ. Он активируется АДФ, НАД+, ингибируется АТФ, НАДН·Н+. Когда в клетке достаточно АТФ (покой), скорость цикла снижается, при распаде же АТФ образуется АДФ, который активирует самую медленную реакцию и, следовательно, скорость всего цикла в целом.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н + (рис. 6-20).

Рис. 6-20. Транспорт пирувата через митохондриальную мембрану
Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD + + HSKoA ↔ СН3-СО-SKoA + NADH + Н + + СO2.
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СO2, а ацетильная группа включается в состав ацетил-КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н + поступает в среду. Реакция необратима, поскольку ΔG 0' -33,5 кДж/моль.
1. Строение пируватдегицрогеназного комплекса
Процесс окислительного декарбоксилиро-вания пирувата катализирует сложноорганизованный пируватдегидрогеназный комплекс.
В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота, FAD, NAD + и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфос-фатаза (табл. 6-5).
Таблица 6-5.
Пируватдегидрогеназный комплекс (ПДК) млекопитающих

Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6x10 6 .
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигид-ролипоилдегидрогеназы (Е3).
Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа — FAD.
2. Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА включает 5 стадий (рис. 6-21).

Рис. 6-21. Последовательность реакций, катализируемых ПДК. I — Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II — Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ПК); III — ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы пипоевой кислоты и ацетил-КоА; IV — окисленная форма трансацетипазы регенерируется при участии Е3; V — окисленная форма Е3 регенерируется при участии NAD +
Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е, и подвергается декар-боксилированию.
Пируват + Е1-ТДФ -> Гидроксиэтил-ТДФ + СO2.
В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце (рис. 6-22).

Рис. 6-22. Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоловое кольцо, к которому присоединяется продукт декарбоксилирования пирувата — гидроксиэтил
Стадия II. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием аце-тилтиоэфира липоевой кислоты (рис. 6-21).
Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е1, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, про-стетическая группа Е1 (рис. 6-23).

Рис. 6-23. Липоевая кислота в составе дигидролипоилтрансацетилазы (Е2). Липоевая кислота или липоильная группа могут существовать в окисленной (дисульфидной ЛК-SS) и восстановленной (ЛK-(SH)2) формах. В составе дигидролипоилтрансацетилазы липоевая кислота связана с белком через остаток лизина амидной связью. Липоевая кислота играет роль витамина или фактора роста у некоторых микроорганизмов, тогда как высшие животные способны её синтезировать
Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD — простетическую группу фермента Е3.
Стадия V. На стадии V восстановленный FADH2 передаёт водород на NAD + с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока, или шаперонов (см. раздел 1), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
3. Связь окислительного декарбоксилирования пирувата с ЦПЭ
Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
Читайте также:

