Люминесцентная микроскопия это кратко и понятно
Обновлено: 05.07.2024
Люминесцентная (флюоресцентная) микроскопия
Люминесцентная (флюоресцентная) микроскопия основана на способности некоторых веществ люминесцировать, т. е. светиться при освещении невидимым ультрафиолетовым или синим светом.
Цвет люминесценции смещен в более длинноволновую часть спектра по сравнению с возбуждающим ее светом (правило Стокса). При возбуждении люминесценции синим светом цвет ее может быть от зеленого до красного, если люминесценция возбуждается ультрафиолетовым излучением, то свечение может быть в любой части видимого спектра. Эта особенность люминесценции позволяет, используя специальные светофильтры, поглощающие возбуждающий свет, наблюдать сравнительно слабое люминесцентное свечение.
Устройство люминесцентного микроскопа и правила работы с ним отличаются от обычного светового микроскопа в основном следующим:
Наличие мощного источника света в осветителе, изучающего преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра (ртутно-кварцевая лампа сверхвысокого давления или галогенная кварцевая лампа).
*теплозащитный светофильтр защищает от перегрева другие светофильтры, препарат и оптику люминесцентного микроскопа. В некоторых отечественных люминесцентных микроскопах теплозащитную функцию кроме того выполняет плоскопараллельными стеклами, дистиллированной водой;
Препарат риккетсий,
окрашенный с помощью РИФ

Поскольку большинство микроорганизмов не обладают собственной люминесценцией существует несколько способов их обработки для наблюдения в люминесцентном микроскопе. Прежде всего это флюорохромирование - окрашивание сильно разведенными (до нескольких микрограмм/мл) растворами флюоресцирующих красителей (флюорохромов). Этот метод используется для бактериоскопического исследования возбудителей некоторых инфекций: туберкулеза (ауромин),, включений в клетках, образуемых некоторыми вирусами и др. Этот же способ может применяться для цитохимического изучения живых и фиксированных микроорганизмов: некоторые флюорохромы избирательно связываются с полимерами клетки (акридиновый оранжевый связываясь с ДНК флюоресцирует зеленым, а с РНК - красным.
В реакции иммуннофлюоресценции с помощью антител, меченных флюорохромами (ФИТЦ и др.), выявляются антигены микроорганизмов или антитела в сыворотке больных.
Люминесценция, т.е. свечение вещества, возникает в результате превращения энергии, поглощаемой веществом, в видимое излучение. Люминесценцией (или флуоресценцией) называют такое явление, когда некоторые вещества под влиянием падающего на них света испускают лучи с другой (обычно большей) длиной волны. Кроме того, вещества, имеющие определенный цвет при обычном освещении, при освещении ультрафиолетовыми лучами приобретают совершенно иной цвет. Объект, не видимый в ультрафиолетовом свете, может приобрести яркий блеск после обработки его флуоресцирующим веществом (флуорохромом). В таком препарате люминесцирующие объекты светятся различным цветом в темном поле зрения. Сила их света бывает различной, но чаще всего она невелика, поэтому люминесцентную микроскопию следует проводить в затемненном помещении.
Разница между микроскопией в проходящем свете и флуоресценцией заключается в том, что в последнем случае препарат рассматривается в излучаемом им свете. При этом химический состав клеток и тканей влияет на качество люминесценции и люминесцентная микроскопия в определенной мере является гистохимическим исследованием. Существует первичная и вторичная флуоресценция. При первичной флуоресценции в самом объекте находятся вещества, способные флуоресцировать. Вторичная флуоресценция – наведенная, возникает при специальной обработке объекта веществами, способными флуоресцировать. Эти вещества называются флуорохромами (акридин оранжевый, флуоресцеин, родамин и др.).
Для люминесцентной микроскопии применяется целый ряд устройств и микроскопов. Основной частью этих устройств является осветитель, имеющий лампу ультрафиолетового света, и система фильтров к нему. В зависимости от того, используется ли ультрафиолетовый или синий цвет для возбуждения люминесценции, между источником света и объектом помещаются соответствующие фильтры. Так как люминесценция микроскопического объекта энергетически слабее, чем возбуждающий свет, то она улавливается лишь в том случае, если излишек лучей, идущих от источника света, отсекается желто-зеленым фильтром, помещенным на окуляре микроскопа. Эффект люминесценции наиболее полно выражен в том случае, когда фильтр на окуляре микроскопа полностью отсекает лучи, идущие от источника света. При этом при отсутствии люминесцирующего препарата получается темное поле зрения.
Установка для люминесцентной микроскопии в видимых лучах состоит из яркого источника света и биологического микроскопа (рис. 7). Между зеркалом микроскопа и источником света устанавливается сине-фиолетовый светофильтр (УФС-3, ФС-1 и т. п.). Желтый светофильтр (ЖС-3 или ЖС-18) надевают на окуляр микроскопа. С помощью этих светофильтров на препарат падает сине-фиолетовый свет, возбуждающий люминесценцию. Однако этот свет мешает видеть возбуждаемое им свечение препарата и поэтому по пути к глазу наблюдателя отсекается желтым светофильтром.
Установку освещения производят по методу Келера, за одним исключением: диафрагма конденсора должна быть полностью открыта. Очень важно применение нефлуоресцирующего иммерсионного масла. С целью гашения собственной флуоресценции к кедровому или другому иммерсионному маслу добавляют на 1 г от 2 до 10 капель нитробензола.
Люминесцентная микроскопия находит широкое применение в микробиологии (рис. 8). Ее преимуществами являются: 1) цветное изображение; 2) высокая степень контрастности самосветящихся объектов на черном фоне; 3) возможность исследования как прозрачных, так и непрозрачных живых объектов; 4) возможность исследования различных жизненных процессов в динамике их развития; 5) обнаружение и установление локализации отдельных микробов и вирусов; 6) развитие тончайших методов цито- и гистохимии и экспресс-диагностика.
Люминесценция, т.е. свечение вещества, возникает в результате превращения энергии, поглощаемой веществом, в видимое излучение. Люминесценцией (или флуоресценцией) называют такое явление, когда некоторые вещества под влиянием падающего на них света испускают лучи с другой (обычно большей) длиной волны. Кроме того, вещества, имеющие определенный цвет при обычном освещении, при освещении ультрафиолетовыми лучами приобретают совершенно иной цвет. Объект, не видимый в ультрафиолетовом свете, может приобрести яркий блеск после обработки его флуоресцирующим веществом (флуорохромом). В таком препарате люминесцирующие объекты светятся различным цветом в темном поле зрения. Сила их света бывает различной, но чаще всего она невелика, поэтому люминесцентную микроскопию следует проводить в затемненном помещении.

Разница между микроскопией в проходящем свете и флуоресценцией заключается в том, что в последнем случае препарат рассматривается в излучаемом им свете. При этом химический состав клеток и тканей влияет на качество люминесценции и люминесцентная микроскопия в определенной мере является гистохимическим исследованием. Существует первичная и вторичная флуоресценция. При первичной флуоресценции в самом объекте находятся вещества, способные флуоресцировать. Вторичная флуоресценция – наведенная, возникает при специальной обработке объекта веществами, способными флуоресцировать. Эти вещества называются флуорохромами (акридин оранжевый, флуоресцеин, родамин и др.).
Для люминесцентной микроскопии применяется целый ряд устройств и микроскопов. Основной частью этих устройств является осветитель, имеющий лампу ультрафиолетового света, и система фильтров к нему. В зависимости от того, используется ли ультрафиолетовый или синий цвет для возбуждения люминесценции, между источником света и объектом помещаются соответствующие фильтры. Так как люминесценция микроскопического объекта энергетически слабее, чем возбуждающий свет, то она улавливается лишь в том случае, если излишек лучей, идущих от источника света, отсекается желто-зеленым фильтром, помещенным на окуляре микроскопа. Эффект люминесценции наиболее полно выражен в том случае, когда фильтр на окуляре микроскопа полностью отсекает лучи, идущие от источника света. При этом при отсутствии люминесцирующего препарата получается темное поле зрения.
Установка для люминесцентной микроскопии в видимых лучах состоит из яркого источника света и биологического микроскопа (рис. 7). Между зеркалом микроскопа и источником света устанавливается сине-фиолетовый светофильтр (УФС-3, ФС-1 и т. п.). Желтый светофильтр (ЖС-3 или ЖС-18) надевают на окуляр микроскопа. С помощью этих светофильтров на препарат падает сине-фиолетовый свет, возбуждающий люминесценцию. Однако этот свет мешает видеть возбуждаемое им свечение препарата и поэтому по пути к глазу наблюдателя отсекается желтым светофильтром.
Установку освещения производят по методу Келера, за одним исключением: диафрагма конденсора должна быть полностью открыта. Очень важно применение нефлуоресцирующего иммерсионного масла. С целью гашения собственной флуоресценции к кедровому или другому иммерсионному маслу добавляют на 1 г от 2 до 10 капель нитробензола.
Люминесцентная микроскопия находит широкое применение в микробиологии (рис. 8). Ее преимуществами являются: 1) цветное изображение; 2) высокая степень контрастности самосветящихся объектов на черном фоне; 3) возможность исследования как прозрачных, так и непрозрачных живых объектов; 4) возможность исследования различных жизненных процессов в динамике их развития; 5) обнаружение и установление локализации отдельных микробов и вирусов; 6) развитие тончайших методов цито- и гистохимии и экспресс-диагностика.
Люминесцентная микроскопия. Электронная микроскопия. Радиоавтография. Конфокальная микроскопия.
Люминесцентная, или флюоресцентная, микроскопия — метод гистологического анализа с помощью люминесцентного микроскопа, в котором используется явление люминесценции (свечения) веществ при действии на них коротковолновых лучей (ультрафиолетового света, рентгеновских лучей). Некоторые биологические соединения, присутствующие в клетках, характеризуются спонтанной флюоресценцией при попадании на клетку ультрафиолетовых лучей. Для выявления же большинства других соединений клетки обрабатываются специальными флюорохромами (флюо-ресцеином, акридином оранжевым, корифосфином). С помощью флюорохромов исследуют, например, содержание в клетках нуклеиновых кислот. При окраске акридином ДНК дает красно-зеленое свечение, а РНК — оранжевое.
Люминесцентный микроскоп широко используется также для изучения иммунофлюоресценции. Иммунофлюоресценция позволяет исследовать в клетке содержание очень малых количеств белка. Препарат предварительно обрабатывают антителами к исследуемому белку, меченными флюоресцирующим красителем.
Ультрафиолетовая микроскопия — метод изучения клеток с помощью микроскопов, в которых для освещения объекта используют ультрафиолетовые лучи (длина волны которых равна 210-275 нм). Такие микроскопы имеют большую, чем обычные световые микроскопы, разрешающую способность. Для наблюдения за объектом требуется специальная аппаратура — электронно-оптический преобразователь, который предохраняет орган зрения от действия ультрафиолетовых лучей.
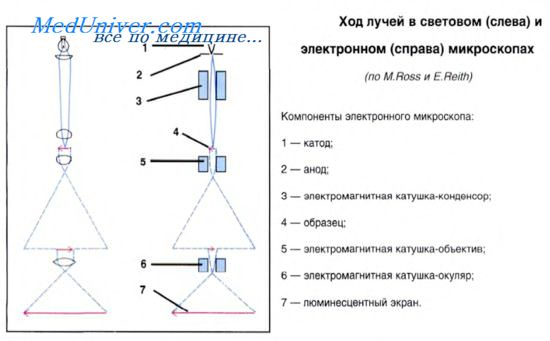
Электронная микроскопия. В электронных микроскопах используют пучок электронов, длина электромагнитной волны которых в 100 000 раз короче длины волны видимого света. Разрешающая способность электронного микроскопа в сотни и тысячи раз превышает обычные оптические приборы и равна 0,5-1 нм, а современные мегавольтные электронные микроскопы дают увеличение до 1 000 000 раз. С помощью электронных микроскопов получены многочисленные данные об ультраструктуре клеток. Разновидностью электронной микроскопии является сканирующая электронная микроскопия (СЭМ), при которой изучаются поверхностные структуры клеток.
Цитоспектрофотометрия — метод изучения химического состава клетки, основанный на избирательном поглощении теми или иными веществами лучей с определенной длиной волны. По интенсивности поглощения света, которая зависит от концентрации вещества, производится количественное определения его содержания в клетке.
Радиоавтография — важный информативный метод, позволяющий изучать распределение в клетках и тканях веществ, в состав которых искусственно введены радиоактивные изотопы (3Н, НС, 32Р и др.). Введенный в организм животного (или в среду культивирования клеток) изотоп включается в соответствующие структуры (например, меченый тимидин — в ядра клеток, синтезирующих ДНК). Метод основан на способности включенных в клетки изотопов восстанавливать бромистое серебро фотоэмульсии, которой покрывают срезы ткани или клетки. Образующиеся после проявления фотоэмульсии зерна серебра (треки) служат своего рода автографами, по локализации которых судят о включении в клетку примененных веществ. Применение меченных тритием предшественников нуклеиновых кислот (тимидина, аденина, цитидина, уридина) позволило выяснить многие важные аспекты синтеза ДНК, РНК и клеточных белков.
Гисто- и иммуноцитохимические методы. В их основе лежит применение химических реакций для выявления распределения химических веществ в структурах клеток, тканей и органов. Современные гистохимические методы позволяют обнаруживать аминокислоты, белки, нуклеиновые кислоты, различные виды углеводов, липидов и др. Для выявления специфических белков используют иммуноцитохимические реакции. Для этого получают специфические сыворотки, содержащие антитела (например, против белка микротрубочек — тубулина). Далее химическим путем соединяют эти антитела с флюорохромом (или другим маркером). Если меченые антитела нанести на гистологический срез, они вступают в соединение с соответствующими белками клетки и возникает специфическое свечение, видимое в люминесцентном микроскопе. Современные иммуноцитохимические методы, помимо флюорохромов, используют другие самые разнообразные специфические маркеры, позволяющие качественно и количественно оценивать содержание в клетке исследуемых соединений. Модификацией рассматриваемого метода является введение меченых антител в цитоплазму живых клеток с помощью микроманипуляторов.
Метод культуры клеток, тканей заключается в выращивании клеток и тканей вне организма в искусственных питательных средах (в условиях in vitro). Для получения изолированных клеток производят предварительную обработку материала ферментами трипсином или коллагеназой. Метод позволяет изучать реакции клеток на различные воздействия, механизмы регуляции пролиферации, дифференцировки и гибели. Особенно важное значение данный метод имеет для эмбриологических и цитофизиологических исследований, а также для трансплантации эмбриональных клеток при лечении врожденных и приобретенных дефектов обмена веществ.
Микроскопическая хирургия клетки — совокупность методических приемов, осуществляемых с помощью специального прибора — микроманипулятора. Этот прибор позволяет производить различного рода тончайшие операции на клетке (введение веществ, удаление или пересадка структурных компонентов клетки, нанесение уколов, разрезов и пр.) и нашел широкое применение в эмбриологии.
Цейтрафферная, или замедленная, микрокино- или видеосъемка — изучение живых клеток. Такой способ позволяет проследить за медленно протекающими изменениями клеток.
Метод фракционирования (дифференциального центрифугирования) клеток. Его суть заключается в получении из клеток изолированных структурных компонентов. Основан на разных скоростях осаждения этих компонентов при вращении гомогенатов клеток в ультрацентрифугах. Данный метод сыграл и играет очень важную роль в изучении химического состава и функциональных свойств субклеточных элементов — прежде всего, органелл.
Конфокальная микроскопия — современный метод, использующий в качестве осветителя лазерный луч, который последовательно сканирует всю толщину препарата. Информация о плотности объекта по каждой линии сканирования передается в компьютер, где специальная программа осуществляет трехмерную реконструкцию исследуемого объекта.
Следует отметить, что здесь приведены лишь самые основные, необходимые для гистологического образования врачей всех профилей методы гистологического анализа. Существуют многие десятки других методов, с которыми можно ознакомиться в специальной гистологической и цитологической литературе.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Люминесцентная микроскопия основана на способности многих веществ биологического происхождения и красителей светиться под действием падающего на них света.
Свечение объектов возникает в результате поглощения ими лучистой энергии. Свет люминесценции обладает большей длиной волны, чем поглощенный (правило Стокса). Поэтому люминесценцию выгодно возбуждать либо ультрафиолетовыми лучами, либо сине-фиолетвыми. Возникает люминесценция в цветовой гамме всего или большей части видимого спектра, что дает цветное изображение. Объект, не дающий явления люминесценции, окрашивают специальными красителями - флюорохромами. Люминесценция, свойственная самим микроорганизмам, называется первичной, а после обработки флюорохромами - наведенной или вторичной.
Borrelia burgdorferi. Люминесцентная микроскопия.
В осветителе люминесцентного микроскопа используется мощный источник света (ртутно-кварцевая лампа сверхвысокого давления или галогенная кварцевая лампа), излучающий преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра. Используется система светофильтров: возбуждающие светофильтры пропускают только ту часть спектра, которая возбуждает люминесценцию; теплозащитный светофильтр защищает от перегрева другие светофильтры, препарат и оптику люминесцентного микроскопа.
В медицинской микробиологии применяют два метода люминесцентной микроскопии: флюорохромирование (окрашивание флюорохромами) и флюоресцирующих антител (реакция иммунофлюоресценции - РИФ).
Люминесцентная микроскопия увеличивает контрастность изображения, дает возможность различить отдельные клеточные структуры. Люминесцентная микроскопия применяется для бактериоскопии инфекционных возбудителей, для цитохимического исследования живых и фиксированных микроорганизмов. В РИФ с помощью антител, меченных флюорохромами, выявляются антигены микроорганизмов или антитела в сыворотке больных. РИФ используется для экспресс-диагностики инфекционных заболеваний.
Читайте также:


