Лабораторный способ получения этилена кратко
Обновлено: 05.07.2024
Возможные способы получения этилена:
Промышленные способы
1. Крекинг и пиролиз нефти: наряду с алканами образуются алкены, в т. ч. и этилен
С7Н16 → С5Н12 + СН2 = СН2
2. Каталитическое дегидрирование этана (катализаторы – Ni, Cr2O3, t = 500oC)
CH3 – CH3 → CH2 = CH2 + H2
Лабораторные способы
3. Внутримолекулярная дегидратация этанола при нагревании (выше 150оС) с водоотнимающими средствами (H2SO4, H3PO4, Р4О10)
CH3 – CH2 – OH → CH2 = CH2 + H2O
4. Дегидрогалогенирование моногалогензамещённых этана при нагревании с концентрированным спиртовым раствором щёлочи
CH3 – CH2I + KOH(спирт. ) → CH2 = CH2 + KI + H2O
(при взаимодействии с водным раствором щёлочи образуется этанол)
Наиболее доступный и распространенный лабораторный способ получения этилена - нагревание смеси этилового спирта с концентрированной серной кислотой. Однако первоначально взаимодействие спирта с кислотой приводит к образованию сложного эфира, который затем при нагревании распадается на этилен и серную кислоту:
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Лабораторная работа № 3. Получение этилена и изучение его свойств.
Цель работы:
Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.

В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды , опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
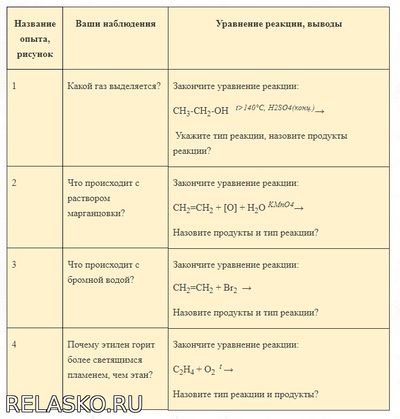
5. Оформите работу в тетради в виде таблицы:
Что делали. Ваши наблюдения
Уравнение реакции, выводы
1. Получение этилена дегидратацией этилового спирта.
Какой газ выделяется?
Закончите уравнение реакции:
Каким способом в лаборатории получают этилен?
Какую роль при этом играет серная кислота?
2. Окисление этилена кислородом перманганата калия.
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора перманганата калия?
3. Взаимодействие этилена с бромной водой.
Что происходит с бромной водой?
Закончите уравнение реакции:
О чем свидетельствует изменение окраски раствора бромной воды?
4. Окисление этилена кислородом воздуха (горение).
Почему этилен горит более светящимся пламенем, чем метан?
Закончите уравнение реакции:
Что можно сказать о содержании углерода в этилене?
6. Общий вывод о проделанной работе: (из цели)
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода
Урок химии проведённый в 10 классе с использованием компьютерных
Цели урока : знать свойства этилена, способы его получения ,правила техники безопасности. Уметь получать этилен в лабораторных условиях, доказывать его наличие, подтверждая химическими реакциями, пользоваться химическим оборудованием и реактивами; продолжить работу по воспитанию патриотических чувств, гордость за достижения отечественной науки.
Реактивы: этиловый спирт ,серная кислота –концентрированная, раствор перманганата калия, йодная вода, песок прокалённый.
Тип урока: практическая работа.
Организационная форма урока: комбинированный ( исследовательская работа)
Ход урока:
1. Организационный момент. 2. Основная часть:
Учащиеся делаю запись темы, цели оборудования и реактивов в тетрадь.)
2.2.На основе полученной карточке приступают к практической части.
2.3.Проделав практическую часть оформляют полученные данные в тетради на основе карточки- инструкции( карточка инструкция прилагается)
2.5.Второй слайд презентации (использование этилена.)
3.Подведение итогов: Делаем вывод о проделанной работе, исходя из цели.
Озвучивание результатов работы учащихся
Уборка рабочего места. Сдача тетрадей на проверку.
4. Третий слайд презентации( домашнее задание)
Егор Егорович Вагнер — родился в Казани в 1849 г. Первоначальное образование получил в частном пансионе в Лифляндии. В 1867 г. поступил в казанский университет, оставался 2 года на юридическом факультете, а затем перешел на физико-математический, который и окончил в 1874 г. со степенью кандидата. Через год был командирован в Петербург, где работал в лаборатории профессора А. М. Бутлерова. С 1882 г. по 1886 г. занимал кафедру химии в институте сельского хозяйства в Новой Александрии, а с 1886 г. ту же кафедру в варшавском университете. Его научная деятельность относится к вопросам органической химии. Один из наиболее выдающихся "химических внуков" А. М. Бутлерова, родоначальника целой школы русских химиков "структуристов". В первых своих работах рассматривал те вопросы, которые наметились общим направлением Бутлеровской школы. Однако, в своих позднейших исследованиях и, главным образом, в большом труде "О реакции окисления кетонов" и затем в работах "Об окислении непредельных соединений" и "Об окислении третичных спиртов", выдвинул на первый план вопрос о зависимости продуктов данной химической реакции от условий, в которых эта реакция происходит, и таким образом перешел к вопросам, имеющим важное значение в химической механике.
Имя Вагнера одно из выдающихся не только среди русских химиков, но и среди химиков других стран. Его диссертация "Синтез вторичных спиртов и их окисление" (1885) и докторская "К реакции окисления непредельных углеродистых соединений" (1888), из которых первая представляет свод целого ряда работ, начиная с 1874 г., являются классическими трудами и дают ряд блестящих, исчерпывающих затронутые вопросы страниц органической химии. Непосредственно вслед за этими работами он перешел к исследованию химического строения терпенов, одной из труднейших задач современной органической химии, долго не поддававшейся решению, несмотря на то, что над нею работали даже такие крупные научные силы, как Флавицкий, Канонников, Валлах, Бэйер, Бредт и др. Благодаря своему замечательному дару сразу находить верные пути исследования и воспользовавшись ранее им же разработанным методом окисления непредельных соединений марганцовокалиевой солью, он очень скоро, уже в 1894 г., успел разъяснить строение терпинеола, терпина, лимонена, карвона и дигидрокарвеола, благодаря чему "совершенно просто развязывался основной узел химического вопроса". В последующие годы ему при содействии его многочисленных учеников, работавших под непосредственным его руководством, удалось выяснить взаимные отношения между собою пинена, камфена и борнеолов и тем сильно подвинуть вопрос о строении этих соединений. Совместно с А. М. Зайцевым открыл (1875) реакцию получения вторичных и третичных спиртов действием на карбонильные соединения цинка и алкилгалогенидов. Используя эту реакцию, осуществил (1874—1884) синтез ряда спиртов. Уточнил (1885) правило окисления кетонов, сформулированное А.Н. Поповым. Открыл (1888) реакцию окисления органических соединений, содержащих этиленовую связь, действием на них 1% раствором перманганата калия. Используя этот способ, доказал непредельный характер ряда терпенов.
Егор Егорович умер в 1903 г. Последние годы жизни состоял профессором органической химии и деканом химического отделения Варшавского политехнического института. В качестве члена комитета он принимал деятельное участие в постройке этого института (1898) и устроил в нем образцовую химическую лабораторию. В 1899 г. Русское физико-химическое общество присудило Вагнеру за его ученые заслуги большую премию имени А. М. Бутлерова.

Ответы и вывод полученный в результате лабораторной работы
Научиться получать этилен в лаборатории путём нагревания смеси этилового спирта с концентрированной серной кислотой и проводить качественные реакции на непредельные углеводороды этиленового ряда, изучить свойства этилена.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
1. Получение этилена дегидратацией этилового спирта.
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
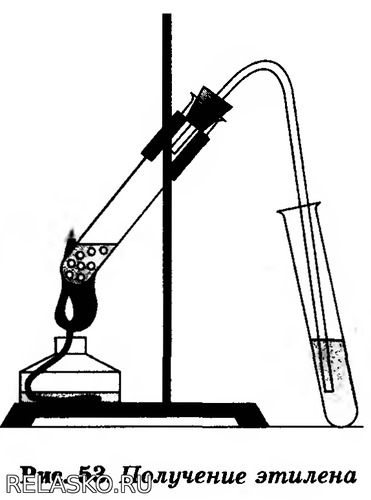
В пробирку налейте 2-3 мл этилового спирта и осторожно добавьте 6-9 мл концентрированной серной кислоты. Затем всыпьте немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении). Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки (рис.53). Что вы наблюдаете?
Осторожно, равномерно нагрейте смесь.
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
В другую пробирку налейте 2-3 мл разбавленного раствора перманганата калия, и пропустите через него газ. Что при этом наблюдаете?
3. Взаимодействие этилена с бромной водой.
В третью пробирку налейте 2-3 мл бромной воды, опустите газоотводную трубку до дна этой пробирки и пропустите через бромную воду выделяющийся газ. Что вы наблюдаете?
4. Окисление этилена кислородом воздуха (горение) Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ. Каким пламенем горит этилен? Почему?
5. Оформите работу в тетради в виде таблицы:
Вывод:
При взаимодействии этилена с бромной водой, красно-бурый раствор бромной воды обесцвечивается. Эта реакция является качественной на двойную связь.
При окислении этилена водным раствором перманганата калия образуется этиленгликоль. Заметно, что фиолетовая окраска раствора исчезает. Реакция является качественной на двойную связь.
В отличие от метана этилен горит светящимся пламенем, что обусловливается повышенным содержанием углерода
Видеоурок. Получение и изучение свойств этилена. Опыт
Получение этилена и его горение
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:
Гидрогалогенирование - присоединение галогеноводородов. Этилен взаимодействует с бромоводородом без особых условий, в результате чего получается бромэтан. Помните, что при присоединении реагента к несимметричному алкену действует правило Марковникова. Оно гласит о том, что атом водорода присоединяется к более гидрогенизированному углеродному атому, а галоген - к менее гидрогенизированному C.
Гидратация - присоединение H2O. C2H4 реагирует с водой в присутствии концентрированной серной кислоты и при температуре. Продуктом реакции является этанол - одноатомный первичный спирт. Катализатором в данном случае может быть и фосфорная кислота. Если бы мы проводили аналогичное взаимодействие с пропеном, то получили бы пропанол-2 - вторичный спирт.
Галогенирование - присоединение галогенов. В ходе этой реакции этен реагирует с хлором. Хлор присоединяется к C2H4, разрывая двойную связь, и на выходе получим 1,2-дихлорэтан. Реакция галогенирования является качественной на кратную связь.
Гидрирование или дегидрирование - присоединение или отщепление атомов водорода. При гидрировании этилен взаимодействует с водородом в присутствии никелевого катализатора и температуры, образуя алкан - этан.

Методическая разработка посвящается методике проведения лабораторных занятий, направленных на экспериментальное подтверждение теоретических положений. В ходе лабораторных занятий у студентов формируются практические умения и навыки обращения с различными приборами, установками, лабораторным оборудованием, а также исследовательские умения (наблюдать, сравнивать, анализировать, устанавливать зависимости, делать выводы и обобщения, самостоятельно вести исследования, оформлять результаты).
Лабораторная работа может носить репродуктивный, частично-поисковый и поисковый характер.
В данной методической разработке рассматривается работа, носящая репродуктивный характер. Она отличается тем, что при её проведении студенты пользуются подробной инструкцией, в которой указаны: цель работы, пояснения (теория, основные характеристики), оборудование, аппаратура, материалы и их характеристики, порядок выполнения работы, таблицы, выводы (без формулировок), контрольные вопросы, учебная и специальная литература.
При выполнении работы используется компьютерная техника.
Лабораторная работа: Получение этилена и изучение его свойств.
Раздел: Органическая химия
Тема: Непредельные углеводороды - алкены.
Цель методической разработки: определение формы организации и характера лабораторных работ при изучении темы
Учащиеся должны знать:
- строение, химические свойства и практическое значение углеводородов;
- природу двойной связи;
- механизм реакций присоединения;
- способы получения углеводородов-алкенов.
Учащиеся должны уметь:
-получать вещества в лаборатории и проводить реакции для изучения свойств веществ;
-составлять уравнения реакций, характеризующих свойства алкенов.
Место и роль темы в курсе: Проводится после изучения темы для повторения и закрепления.
Цель работы:
1. Получение непредельных углеводородов на примере этилена лабораторным способом.
2. Доказательство наличия двойной связи в молекуле органического соединения - этилена.
Оборудование и реактивы:
- штатив с зажимом,
- штатив с пробирками,
- прибор для получения этилена,
- смесь этилового спирта (96%) с конц. H2SO4 (d= 1,84 г/см 3 ) в соотношении 1:3,
- розовый раствор перманганата калия,
- разбавленный светло-желтый раствор бромной воды,
Техническое обеспечение: Компьютер, проектор, видео:
- Получение этилена и его горение.
- Реакция этилена с раствором перманганата калия.
- Взаимодействие этилена с бромной водой.
Пояснение.
Алкены - непредельные ациклические углеводороды, содержащие в молекуле одну двойную связь между атомами углерода и соответствующие общей формуле CnH2n.
Этилен относится к непредельным углеводородам-алкенам.
Лабораторный способ получения этилена осуществляется нагреванием этилового спирта (винного) с концентрированной серной кислотой H2SO4. Ненасыщенность этилена легко обнаружить реакцией с раствором перманганата калия и с бромной водой.
Электронное строение: Атомы C, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, двойная связь является сочетанием - и -связей. По своей природе -связь резко отличается от -связи; -связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм. Имея в молекуле двойную связь, состоящую из - и -связей, этилен способен присоединять два одновалентных атома или радикала за счет разрыва -связи.
Физические свойства: Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
Химические свойства
• Способность к реакциям присоединения
1. Присоединение водорода (реакция гидрирования):
2. Присоединение галогенов (реакция галогенирования):
При добавлении к алкену брома (в виде бромной воды) бурая окраска брома быстро исчезает. Эта реакция является качественной на двойную связь.
3. Присоединение галогеноводородов (реакция гидрогалогенирования):
4. Присоединение воды (реакция гидратации):
5. Реакция окисления (реакция гидроксилирования):
Этилен легко окисляется уже при обычной температуре, например при действии перманганата калия. Если этилен пропускать через водный раствор перманганата калия KMnO4, то характерная фиолетовая окраска последнего исчезает, происходит окисление этилена перманганатом калия (качественная реакция на двойную связь):
6. Реакциия полимеризации.
Они протекают при повышенной температуре, давлении и в присутствии катализаторов:
Характер выполняемой работы – репродуктивный
Форма организации работы – фронтальная
Порядок выполнения работы:
А) Допуск к работе: (Фронтальная беседа)
К какой группе углеводородов относится этилен?
Какие углеводороды называют алкенами?
Какие углеводороды называют непредельными?
Запишите молекулярную, сокращённую и развёрнутую структурные формулы этилена (этена).
Как можно получить этен в лаборатории?
Какие реакции характерны для алкенов?
Как с помощью качественных реакций определить непредельный характер алкенов?
Б) Проведение инструктажа по технике безопасности.
Правила нагревания веществ и правила работы с концентрированными кислотами.
-Прогрейте сначала всю пробирку-реактор, затем нагревайте пробирку у донышка.
-Не касайтесь пламенем границы жидкость — воздух.
-Вспомните порядок действий, предотвращающих засасывание жидкости в пробирку-реактор.
- Выньте газоотводную трубку из пробирки с водой, не прекращая нагревания пробирки с веществом, в противном случае жидкость из пробирки может перебросить в раскаленную пробирку с веществом и пробирка лопнет.
-Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.
-Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
-Не наклоняйтесь над нагреваемой пробором.
Правила безопасности при работе со спиртовкой?
-При пользовании нагревательным прибором запрещается:
1) Передача зажженной спиртовки. 2) Зажигание одной спиртовки от другой.
- Гасите спиртовку только накрывая пламя колпачком.
В) Обеспечение студентов каждой группы:
а) необходимым оборудованием,
б) необходимыми реактивами.
Пробирка-реактор со смесью этилового спирта и концентрированной серной кислотой, с прокаленным речным песком стоит у каждого учащегося в штативе на столе (заранее готовит лаборант), а также растворы перманганата калия и бромной воды, спиртовка и лучинка.
Д) Выполнение студентами лабораторной работы по инструкции с методическими рекомендациями:
Ход работы
1. Получение этилена
Внести в пробирку 6—8 капель заранее приготовленной смеси из этилового (винного) спирта с концентрированной серной кислотой и несколько крупинок прокаленного речного песка для равномерного кипения. Закрыть пробирку пробкой с газоотводной трубкой и закрепить в зажиме штатива.
Смесь в пробирке нагреть (осторожно!) над пламенем горелки. Концентрированная серная кислота — окислитель, поэтому наряду с этиленом образуется ряд продуктов окисления органических соединений, например СО2, уголь (смесь при этом чернеет), а также другие побочные продукты.
Выделяющийся газ поджечь у конца газоотводной трубки. Этилен горит светящимся пламенем.
- Взаимодействиеэтилена с раствором перманганата калия и бромной водой.
Не прекращая нагревания пробирки со смесью спирта и серной кислоты (H2SO4 – конц.) опустить газоотводную трубку сначала в пробирку с 5 каплями бромной воды так, чтобы конец газоотводной трубки касался дна пробирки, а затем в другую пробирку, содержащую 5 капель розового раствора перманганата калия. Растворы обесцвечиваются. Записать наблюдения.
Е) Уборка рабочего места.
Ж) Составление отчета о выполнении лабораторной работы и запись выводов:
А) Заполните таблицы к каждому опыту.
Б) Запишите уравнения реакций к каждому опыту.
В) Ответьте на предлагаемые вопросы.
Выводы:
1. Написать уравнение реакции получения этилена из этилового спирта в присутствии серной кислоты.
2. Какую роль играет конц. H2SO4 при получении этилена из этилового спирта?
3. Написать уравнения реакций:
а) горения этилена;
б) присоединения к этилену брома;
в) окисления этилена перманганатом калия;
4. Объяснить, почему этилен обесцвечивает бромную воду и раствор перманганата калия.
Читайте также:

