Л де бройль волновая модель кратко
Обновлено: 05.07.2024
В атомная модель де Бройля он был предложен французским физиком Луи Бройлем в 1924 году. В своей докторской диссертации Бройль утверждал дуальность электронов между частицами и волнами, заложив основы волновой механики. Бройль опубликовал важные теоретические открытия о корпускулярно-волновой природе материи на атомном уровне.
Позже утверждения де Бройля были экспериментально продемонстрированы учеными Клинтоном Дэвиссоном и Лестером Гермером в 1927 году. Теория электронных волн Де Бройля основана на предложении Эйнштейна о волновых свойствах света на коротких волнах.
Бройль объявил о возможности того, что материя имеет поведение, подобное поведению света, и предположил аналогичные свойства у субатомных частиц, таких как электроны.
Электрические заряды и орбиты ограничивают амплитуду, длину и частоту волны, описываемой электронами. Бройль объяснил движение электронов вокруг ядра атома.
Характеристики модели атома де Бройля
Развивая свое предложение, Бройль исходил из принципа, что электроны имеют двойную природу между волной и частицей, подобно свету.
В этом смысле Бройль провел сравнение между обоими явлениями и на основе уравнений, разработанных Эйнштейном для изучения волновой природы света, указал следующее:
- Полная энергия фотона и, следовательно, полная энергия электрона, является произведением частоты волны и постоянной Планка (6,62606957 (29) × 10 -34 Жюля x секунд), как подробно описано в следующем выражении:
В этом выражении:
E = энергия электрона.
h = постоянная Планка.
f = частота волны.
- Импульс фотона и, следовательно, электрона обратно пропорционален длине волны, и обе величины связаны через постоянную Планка:
В этом выражении:
p = импульс электрона.
h = постоянная Планка.
- Линейный импульс - это произведение массы частицы и скорости, которую частица имеет во время своего перемещения.
Если приведенное выше математическое выражение преобразовать в функцию от длины волны, мы получим следующее:
В этом выражении:
h = постоянная Планка.
m = масса электрона.
v = скорость электрона.
Поскольку h, постоянная Планка, имеет небольшое значение, длина волны λ тоже. Следовательно, можно утверждать, что волновые свойства электрона проявляются только на атомном и субатомном уровнях.
- Бройль также исходит из постулатов атомной модели Бора. Согласно последнему, орбиты электронов ограничены и могут быть только кратными целым числам. Так:
h = постоянная Планка.
m = масса электрона.
v = скорость электрона.
r = радиус орбиты.
Согласно атомной модели Бора, которую Бройль принял за основу, если электроны ведут себя как стоячие волны, единственными допустимыми орбитами являются те, радиус которых равен целому кратному длине волны λ.
Следовательно, не все орбиты соответствуют параметрам, необходимым для движения электрона по ним. Вот почему электроны могут двигаться только по определенным орбитам.
Теория электронных волн де Бройля оправдала успех атомной модели Бора в объяснении поведения одного электрона атома водорода.
Точно так же это также пролило свет на то, почему эта модель не подходит для более сложных систем, то есть атомов с более чем одним электроном.
Эксперимент Дэвиссона и Гермера
Экспериментальная проверка атомной модели де Бройля состоялась через 3 года после ее публикации, в 1927 году.
Выдающиеся американские физики Клинтон Дж. Дэвиссон и Лестер Гермер экспериментально подтвердили теорию волновой механики.
Дэвиссон и Гермер провели испытания на рассеяние электронного луча через кристалл никеля и наблюдали явление дифракции через металлическую среду.
Проведенный эксперимент заключался в проведении следующей процедуры:
- В первую очередь был размещен узел электронного пучка с известной начальной энергией.
- Установлен источник напряжения для ускорения движения электронов за счет разности потенциалов.
- поток электронного луча был направлен на металлический кристалл; в данном случае никель.
- Было измерено количество электронов, столкнувшихся с кристаллом никеля.
В конце эксперимента Дэвиссон и Гермер обнаружили, что электроны рассеиваются в разных направлениях.
Повторяя эксперимент с использованием металлических кристаллов разной ориентации, ученые обнаружили следующее:
- Рассеяние электронного луча через металлический кристалл было сопоставимо с явлением интерференции и дифракции световых лучей.
- Отражение электронов от ударного кристалла описывало траекторию, которую он теоретически должен описывать согласно теории электронных волн де Бройля.
Короче говоря, эксперимент Дэвиссона и Гермера экспериментально подтвердил дуальную волновую и частичную природу электронов.
Ограничения
Атомная модель де Бройля не предсказывает точное положение электрона на орбите, по которой он движется.
В этой модели электроны воспринимаются как волны, которые движутся по орбите без определенного местоположения, тем самым вводя понятие электронной орбитали.
Более того, модель атома де Бройля, аналогичная модели Шредингера, не рассматривает вращение электронов вокруг своей оси (вращение).
Пренебрегая собственным угловым моментом электронов, мы пренебрегаем пространственными вариациями этих субатомных частиц.
Точно так же эта модель также не учитывает изменения в поведении быстрых электронов как следствие релятивистских эффектов.
1923 год ознаменовался событием, значимо ускорившим развитие квантовой физики. Французским физиком Л. де Бройлем была предложена гипотеза, предполагающая универсальность корпускулярно-волнового дуализма. В своей концепции Де Бройль сформулировал утверждение о том, что, помимо фотонов и электроны, а также прочие частицы материи имеют как корпускулярные, так и волновые свойства.
Описание гипотезы де Бройля
Идеи де Бройля содержали мысль о том, что любой микрообъект имеет, с одной стороны, корпускулярные характеристики – энергия E и импульс p , а с другой стороны, волновые характеристики – частота v и длина волны λ . При этом количественное соотношение корпускулярных и волновых характеристик аналогично тому же для фотона:
E = h v , p = h v c = h λ .
Как уже было сказано выше, в гипотезе французского физика шла речь о всех видах микрочастиц, соответственно и указанное выше соотношение применимо для любых из них, в том числе, и для обладающих массой m . Любая частица, обладающая импульсом, была сопоставлена с волновым процессом с длиной волны λ = h p .
Для частиц, имеющих массу: λ = h p = h 1 - v 2 / c 2 m v .
В нерелятивистском приближении ( υ c )
Основой идей де Бройля стали размышления о симметрии свойств материи, и в то время, увы, гипотеза не получила опытного подтверждения. Однако, она стала мощнейшим катализатором развития новых идей о природе материальных объектов. На протяжении последующих нескольких лет выдающиеся умы XX века (физики В. Гейзенберг, Э. Шредингер, П. Дирак, Н. Бор и др.) создавали теоретические основы новой науки, названной квантовой механикой.
Дифракция электронов
Впервые гипотеза де Бройля была экспериментально подтверждена в 1927 году, когда американские физики К. Девиссон и Л. Джермер выяснили, что пучок электронов, рассеивающийся на кристалле никеля, дает ясную дифракционную картину, похожую на возникающую тогда, когда на кристалле рассеивается коротковолновое рентгеновское излучение. В исследованиях физиков кристалл служил естественной дифракционной решеткой. По тому, какое положение имели дифракционные максимумы, выяснилась длина волны электронного пучка, и она полностью соответствовала той, что вычислялась по формуле де Бройля.
В 1928 году физик из Англии Г. Томсон (являющийся сыном Дж. Томсона, который открыл за 30 лет до этого электрон) вновь подтвердил гипотезу де Бройля. Эксперименты Томсона позволили наблюдать дифракционную картину, которая возникала, когда пучок электронов проходил через тонкую поликристаллическую фольгу из золота.
Рисунок 5 . 4 . 1 . Упрощенная схема опытов Г. Томсона по дифракции электронов. K – накаливаемый катод, A – анод, Ф – фольга из золота.
За фольгой установлена фотопластинка, на которой наблюдались явные концентрические светлые и темные кольца. Радиусы этих колец варьировались в зависимости от скорости электронов (т. е. длины волны) согласно де Бройлю (рис. 5 . 4 . 2 ).
Рисунок 5 . 4 . 2 . Картина дифракции электронов на поликристаллическом образце при длительной экспозиции ( a ) и при короткой экспозиции ( b ) .
В случае ( b ) видны точки попадания отдельных электронов на фотопластинку.
В последующие годы эксперимент Г. Томсона многократно повторяли и результат был неизменен даже в тех случаях, когда поток электронов был столь слабым, что через прибор единовременно проходила только одна частица (например, опыт В. А. Фабриканта в 1948 г.). Так была доказана идея, что волновые свойства характерны как для большой совокупности электронов, так и для каждого электрона в отдельности.
В последующем явления дифракции обнаружились и для нейтронов, протонов, атомных и молекулярных пучков. Доказанное экспериментально наличие волновых свойств различных видов микрочастиц позволило сделать вывод об универсальности этого явления в природе, являющегося общим свойством материи. Если продолжать данное рассуждение, волновыми свойствами должны обладать и макроскопические тела. Но из-за больших показателей массы, присущих макроскопическим телам, их волновые свойства затруднительно доказать при помощи экспериментов.
К примеру, пылинка массой 10 – 9 г , которая движется со скоростью 0 , 5 м / с , обладает волной де Бройля с длиной примерно 10 – 21 м, т. е. меньше размера атома на 11 порядков. Подобная длина волны находится за границами области, которая доступна для наблюдения.
Приведенный пример демонстрирует, что для макроскопических тел доступно лишь проявление корпускулярных свойств.
Приведем еще пример.
U = 100 В , длину волны де Бройля для него мы можем определить по формуле: λ = h 2 m e U
Приведенный пример - нерелятивистский случай, поскольку разница между кинетической энергией электрона e U = 100 э В и энергией покоя m c 2 ≈ 0 , 5 М э В достаточно значима (кинетическая энергия значимо меньше энергии покоя).
В результате расчета получим: λ ≈ 0 , 1 н м , т. е. полученная длина волны примерно соответствует размерам атомов. Для таких электронов кристалл служит отличной решеткой для дифракции. Как раз подобные малоэнергичные электроны показывают четкую дифракционную картину при проведении экспериментов по дифракции электронов. Вместе с этим электрон с такими характеристиками, испытавший дифракционное рассеяние на кристалле как волна, осуществляет взаимодействие с атомами фотопластинки в качестве частицы и вызывает почернение фотоэмульсии в некоторой точке (рис. 5 . 4 . 2 ).
Резюмируя, еще раз отметим, что гипотеза де Бройля о корпускулярно-волновом дуализме, доказанная экспериментально, глобально поменяла представления о том, какими свойствами обладают микрообъекты.
Все микрообъекты обладают и волновыми, и корпускулярными свойствами, но при этом не являются ни волной, ни частицей в стандартном представлении.
Одновременного проявления различных свойств микрообъектов не происходит: они являются дополнением друг друга, и лишь их совокупность характеризует микрообъект в целом.
Эти заключения были сформулированы датским физиком Н.Бором и получили название принципа дополнительности. Упрощенно возможно говорить о том, что микрообъекты распространяются как волны, а обмениваются энергией как частицы.
Факт, что необходимо использовать вероятностный подход, описывая микрообъекты, является важной отличительной чертой квантовой теории. Квантовая механика для характеристики состояний микрообъектов включает в себя понятие волновой функции Ψ (пси-функции).
Квадрат модуля волновой функции | Ψ | 2 пропорционален вероятности нахождения микрочастицы в единичном объеме пространства.
Определенный вид волновой функции задается внешними условиями, в которых находится микрочастица. Математический инструментарий квантовой механики дает возможность определять волновую функцию частицы, которая находится в заданных силовых полях. Безграничная монохроматическая волна де Бройля является волновой функцией свободной частицы, на которую не действуют никакие силовые поля.
Максимально четко явление дифракции наблюдается тогда, когда размерность препятствия, на котором происходит дифракция волн, соизмерима с длиной волны. Подобное поведение характерно для волн любой физической природы и, в частности, электронных волн. Для волн де Бройля естественная дифракционная решетка - это упорядоченная структура кристалла с пространственным периодом порядка размеров атома (приблизительно 0 , 1 н м ). Нет возможности создать искусственным образом препятствие указанного размера (к примеру, отверстие в непрозрачном экране), однако, чтобы уяснить природу волн де Бройля, возможно проводить, так сказать, мысленные эксперименты.
Для примера разберем дифракцию электронов на одиночной щели шириной D (рис. 5 . 4 . 3 )
Рисунок 5 . 4 . 3 . Дифракция электронов на щели. График справа – распределение электронов на фотопластинке.
Из общей массы электронов, проходящих через щель, свыше 85 % окажутся в центральном дифракционном максимуме. Угловая полуширина θ 1 этого максимума определится из условия
Указанная формула - часть волновой теории. Если рассуждать, опираясь на корпускулярные свойства, возможно сказать, что, когда электрон проходит через щель, он получает дополнительный импульс в перпендикулярном направлении. Можем пренебречь оставшимися 15 % электронов, попадающих на фотопластинку за пределами центрального максимума, и тогда будем считать, что максимальное значение p y поперечного импульса равно:
p у = p · sin θ 1 = h λ · sin θ 1
В этой формуле p является модулем полного импульса электрона, равным (по гипотезе де Бройля) h λ . Величина p , когда электрон проходит через щель, неизменна, поскольку неизменной является длина волны λ . Указанные выражения дают возможность записать следующее соотношение:
Для задач квантовой механики это несложное с виду соотношение, служащее следствием волновых свойств микрочастицы, имеет глубочайший смысл. Электроны проходят через щель, что есть эксперимент, где y – координата электрона – определяется с точностью Δ y = D .
Величина Δ y носит название неопределенности измерения координаты.
Вместе с тем, точность определения y – составляющей импульса электрона в момент прохождения через щель – равна p y или даже больше, учитывая побочные максимумы дифракционной картины.
Эта величина носит название неопределенности проекции импульса и обозначается как Δ p y .
Показатели Δ y и Δ p y связаны соотношением:
и оно названо соотношением неопределенностей Гейзенбурга.
Величины Δ y и Δ p y следует уяснить в том смысле, что микрочастицы не обладают одновременно точным значением координаты и соответствующей проекцией импульса. Соотношение неопределенностей не имеет отношения к несовершенству используемых приборов, чтобы одновременно измерить координаты и импульс микрочастицы. Соотношение Гейзенбурга есть проявление той самой дуальной корпускулярно-волновой природы материи микрообъектов. Соотношение дает возможность дать оценку тому, насколько применимы к микрочастицам постулаты классической механики. Оно также демонстрирует, что к микрообъектам невозможно применить понятие траектории в классическом понимании, поскольку характеристикой движения по траектории в любой момент времени являются определенные значения координат и скорости. В принципе нет возможности указать траекторию, по которой в некотором мысленном эксперименте двигался некий определенный электрон после прохождения щели до фотопластинки.
И все же определенные условия создают ситуацию, когда соотношение неопределенностей не является противоречием классическому описанию движения тел, в частности, микрочастиц.
К примеру, электронный пучок в кинескопе телевизора при вылете из электронной пушки имеет диаметр D около 10 – 3 с м . В телевизоре ускоряющее напряжение U ≈ 15 к В .
Нетрудно рассчитать импульс электрона: p = 2 m e U ≈ 6 , 6 · 10 - 23 к г · м / с
Данный импульс имеет направление вдоль оси трубки. Из соотношения неопределенностей вытекает, что электронам при формировании пучка сообщается неконтролируемый импульс Δ p , являющийся перпендикуляром к оси пучка: Δ p ≈ h D ≈ 6 , 6 · 10 – 29 к г · м / с .
Допустим, до экрана кинескопа электроны проходят расстояние L ≈ 0 , 5 м . В таком случае размытие Δ l пятна на экране, заданное волновыми свойствами электрона, составит:
∆ l ≈ ∆ p p L ≈ 5 · 10 - 5 с м
Так как Δ l D , возможно рассмотреть движение электронов в кинескопе телевизора при помощи основ классической механики.
Так, используя соотношение неопределенностей, есть возможность выяснять, насколько справедливы законы классической физики в отдельных случаях.
Проведем еще мысленный эксперимент: это будет дифракция электронного пучка на двух щелях
(рис. 5 . 4 . 4 ).
Структура эксперимента аналогична структуре оптического интерференционного опыта Юнга.
Рисунок 5 . 4 . 4 . Дифракция электронов на двух щелях.
Проанализировав данный эксперимент, мы можем отметить некоторые трудности логических умозаключений в квантовой теории. Собственно, то же затруднение имеет место быть при попытке объяснить оптический опыт Юнга на основе концепции фотонов.
Конечно, довольно затруднительно представить с точки зрения присущей нашему мышлению логике, что единственным ответом на указанный выше вопрос является факт, что электрон проходит через обе щели. Нашему мышлению свойственно представлять поток микрообъектов в виде направленного движения, например, маленьких шариков и соответственно описывать это движение, опираясь на законы классической физики. Однако для всех микрочастиц характерны как корпускулярные, так и волновые свойства. Нам легко представится, как электромагнитная световая волна пройдёт сквозь две щели в оптическом эксперименте Юнга, поскольку волна не имеет локализации в пространстве. Но при рассмотрении концепции фотонов приходится принять, что и каждый фотон не имеет локализации. Мы не имеем возможности указать, через какую щель прошел фотон, как и не имеем возможности отследить точную траекторию полета фотона до фотопластинки с указанием точной точки его попадания. Опыты демонстрируют такую картину, что, даже когда фотоны проходят сквозь интерферометр поштучно, интерференционная картина после прохождения многих независимых фотонов все равно имеет место быть. Таким образом, квантовая физика формулирует вывод: фотон интерферирует сам с собой.
Сказанное выше имеет отношение и к эксперименту по дифракции электронов на двух щелях. Все известные экспериментальные факты в своей совокупности могут быть объяснены, если признать, что волна по де Бройлю каждого конкретного электрона проходит одномоментно сквозь обе щели, и, как результат, имеет место явление интерференции.
Поштучный поток электронов также дает интерференцию при длительной экспозиции, т. е. электрон, как и фотон, интерферирует сам с собой.
Атомная модель Бройля был предложен французским физиком Луи Бройлем в 1924 году. В своей докторской диссертации Бройль утверждал, что электронно-волновое дуальность электронов закладывает основы волновой механики. Бройль опубликовал важные теоретические выводы о корпускулярно-волновой природе вещества в атомном масштабе..
Впоследствии утверждения Бройля были экспериментально продемонстрированы учеными Клинтоном Дэвиссоном и Лестером Джермером в 1927 году. Теория электронных волн Бройля основана на предложении Эйнштейна о волновых свойствах света на коротких длинах волн..
Брогли объявил о возможности поведения вещества, подобного поведению света, и предложил аналогичные свойства в субатомных частицах, таких как электроны..
Электрические заряды и орбиты ограничивают амплитуду, длину и частоту волны, описываемой электронами. Бройль объяснил движение электронов вокруг атомного ядра.
- 1 Характеристики атомной модели Бройля
- 2 Эксперимент Дэвиссона и Гермера
- 3 ограничения
- 4 Статьи интересов
- 5 ссылок
Характеристики атомной модели Бройля
Чтобы развить свое предложение, Бройль исходил из принципа, что электроны имеют двойственную природу между волной и частицей, подобно свету..
В этом смысле Бройль провел сравнение между обоими явлениями и, основываясь на уравнениях, разработанных Эйнштейном для изучения волновой природы света, указал следующее:
- Полная энергия фотона и, следовательно, полная энергия электрона, являются результатом произведения частоты волны и постоянной Планка (6.62606957 (29) × 10 -34 Жюль х секунд), как указано в следующем выражении:
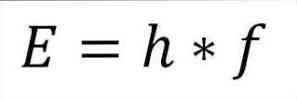
В этом выражении:
E = энергия электрона.
h = постоянная планки.
f = частота волны.
- Линейный момент фотона, а следовательно, и электрона, обратно пропорционален длине волны, и обе величины связаны через постоянную Планка:
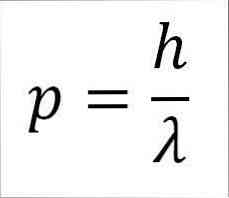
В этом выражении:
р = линейный момент электрона.
h = постоянная планки.
- Линейный импульс представляет собой произведение массы частицы на скорость, которую частица имеет при перемещении.
Если предыдущее математическое выражение реструктурируется как функция длины волны, мы имеем следующее:
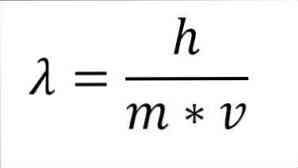
В указанном выражении:
h = постоянная планки.
m = масса электрона.
v = скорость электрона.
Поскольку h, постоянная Планка, имеет небольшое значение, длина волны λ также. Следовательно, можно утверждать, что волновые свойства электрона проявляются только на атомном и субатомном уровнях..
- Бройль также основан на постулатах атомной модели Бора. Согласно последним, орбиты электронов ограничены и могут быть только кратными целым числам. таким образом:
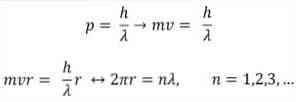
h = постоянная планки.
m = масса электрона.
v = скорость электрона.
r = радиус орбиты.
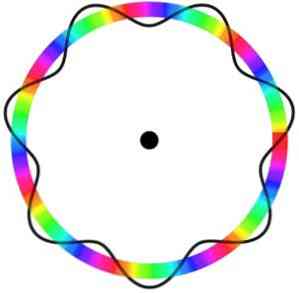
Согласно атомной модели Бора, которую Брогли принял за основу, если электроны ведут себя как стоячие волны, единственными допустимыми орбитами являются те, радиус которых равен целому кратному длине волны λ.
Поэтому не все орбиты соответствуют параметрам, необходимым для того, чтобы электрон проходил через них. Вот почему электроны могут путешествовать только по определенным орбитам.
Волновая теория электронов Бройля обосновала успех атомной модели Бора для объяснения поведения одиночного электрона атома водорода..
Аналогично, это также пролило свет на то, почему эта модель не подходит для более сложных систем, то есть атомов с более чем одним электроном..
Эксперимент Дэвиссона и Гермера
Экспериментальная проверка атомной модели Брогли состоялась через 3 года после ее публикации, в 1927 году..
Выдающиеся американские физики Клинтон Дж. Дэвиссон и Лестер Гермер экспериментально подтвердили теорию волновой механики.
Дэвиссон и Гермер провели тесты рассеяния электронного пучка на кристалле никеля и наблюдали явление дифракции в металлической среде..
Проведенный эксперимент состоял из проведения следующей процедуры:
- В первом случае была размещена сборка с электронным пучком, которая имела известную начальную энергию.
- Источник напряжения был установлен, чтобы ускорить движение электронов, вызывая разность потенциалов.
- Поток электронного пучка был направлен к металлическому кристаллу; в этом случае никель.
- Было измерено количество электронов, которые воздействовали на кристалл никеля..
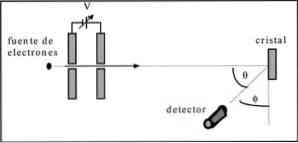
В конце эксперимента Дэвиссон и Гермер обнаружили, что электроны были распределены в разных направлениях..
Повторяя эксперимент с использованием металлических кристаллов с различной ориентацией, ученые обнаружили следующее:
- Дисперсия электронного пучка через металлический кристалл была сравнима с явлением интерференции и дифракции световых лучей..
- Отражение электронов на ударном кристалле описало траекторию, которую, теоретически, следует описать в соответствии с теорией электронных волн Бройля.
В синтезе эксперимент Дэвиссона и Гермера экспериментально доказал двойственную волновую-электронную природу электронов.
ограничения
Модель атома Брогли не предсказывает точное местоположение электрона на орбите, по которой он движется.
В этой модели электроны воспринимаются как волны, которые движутся по орбите без определенного местоположения, что вводит понятие электронной орбитали.
Кроме того, модель атома Бройля, аналогичная модели Шредингера, не учитывает вращение электронов вокруг своей оси (спин).
Игнорируя внутренний момент импульса электронов, пространственные изменения этих субатомных частиц игнорируются..
В том же порядке идей, эта модель не учитывает изменения в поведении быстрых электронов в результате релятивистских эффектов.
Если кванты света могут себя вести и как волна, и как частица, то могут ли подобным образом вести себя другие микрочастицы, составляющие атом? Настала пора ответить и на этот вопрос.
Мы уже знаем, что фотон ведет себя в пространстве не только как некий материальный объект — корпускула, но и как волна. Причем длина этой волны определяется формулой 1 = h/р, где h — постоянная Планка, а р — импульс частицы. Вопросом, любая ли движущаяся частица может себя вести подобным образом, заинтересовался французский физик-теоретик Луи де Бройль.
Частица превращается. В волну

Луи де Бройль (1892-1987) — французский физик-теоретик, один из основоположников квантовой механики, лауреат Нобелевской премии по физике за 1929 год
Впервые идею о корпускулярно-волновой природе электрона французский физик выдвинул еще в 1923 году. Позднее это оказалось справедливым и для других составляющих атома. Выдвинутая им гипотеза хорошо обосновала казавшийся загадочным принцип стационарных орбит в модели атома Бора.
Де Бройль предположил, что если частица имеет массу m и скорость v, значительно меньшую скорости света с, импульс частицы р = mv, то длина волны должна определяться формулой А = h/mv.
Волновые свойства макроскопических объектов практически не проявляются из-за очень малых длин волн. Из приведенной выше формулы следует, что длина волны де Бройля тем меньше, чем больше масса частицы и ее скорость. Например, для тела массой 200 г, движущегося со скоростью 3 м/с, вычисленная длина волны приблизительно равна 10 -32 см, что лежит за пределами наших наблюдательных возможностей. Однако для микрочастиц длины волн лежат в доступной наблюдению области. Так, для электрона, ускоренного разностью потенциалов 100 вольт, длина волны составит всего около 10 -9 м, что соответствует размеру атома.
Волновые свойства электронов должны проявиться, например, при их рассеянии на кристаллах, на которых уже к этому времени наблюдали дифракцию рентгеновских лучей.
Оставалось проверить теорию на практике. Как же это сделать?

Окошко в микромир
Впервые экспериментальное подтверждение гипотезы де Бройля осуществили американские ученые Клинт Дэвиссон и Лестер Джермер. Они разогнали пучок электронов в электрическом поле с разностью потенциалов до 150 вольт и пустили его на кристалл никеля. Было установлено, что на кристалле происходит дифракция электронов, причем полученная длина соответствует соотношению де Бройля, а следовательно, электрон в данном случае действительно ведет себя как волна.
Сегодня волновые свойства составляющих атом частиц, а также самих атомов и молекул не только доказаны прямыми опытами, но и широко используются в установках с высокой разрешающей способностью.
Существование волн де Бройля лежит в основе работы электронного микроскопа, разрешающая способность которого на много порядков выше, чем у любого оптического микроскопа, что позволяет ученым наблюдать молекулы и атомы. Метод дифракции частиц в настоящее время широко используется при изучении строения и свойств вещества.

Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу.
Содержание
История
В 1924 году [1] французский физик Луи де Бройль высказал гипотезу о том, что установленный ранее [1] для фотонов корпускулярно-волновой дуализм присущ всем частицам — электронам, протонам, атомам и так далее, причём количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и для фотонов. Таким образом, если частица имеет энергию и импульс, абсолютное значение которого равно , то с ней связана волна, частота которой и длина волны , где — постоянная Планка. [1] Эти волны и получили название волн де Бройля. [1]
Экспериментальная проверка
Гипотеза де Бройля объясняет ряд экспериментов, необъяснимых в рамках классической физики [2] :
-
по дифракции электронов на кристаллахникеля.
- Опыт Дж. П. Томсона по дифракции электронов на металлической фольге. аномального уменьшения сечения рассеяния электронов малых энергий атомамиаргона.
- Дифракция нейтронов на кристаллах (опыты Г. Хальбана, П. Прайсверка и Д. Митчелла).
Физический смысл
Для частиц не очень высокой энергии, движущихся со скоростью (скорости света), импульс равен (где — масса частицы), и
= \frac" width="" height="" />
. Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость. Например, частице с массой в 1 г, движущейся со скоростью 1 м/с, соответствует волна де Бройля с 62\cdot 10^" width="" height="" />
м, что лежит за пределами доступной наблюдению области. Поэтому волновые свойства несущественны в механике макроскопических тел. Для электронов же с энергиями от 1 эВ до 10 000 эВ длина волны де Бройля лежит в пределах от ~ 1 нм до 10 −2 нм, то есть в интервале длин волн рентгеновского излучения. Поэтому волновые свойства электронов должны проявляться, например, при их рассеянии на тех же кристаллах, на которых наблюдается дифракция рентгеновских лучей. [1]

нм) и падал на кристалл никеля, играющий роль пространственной дифракционной решётки. Было установлено, что электроны дифрагируют на кристалле, причём именно так, как должно быть для волн, длина которых определяется соотношением де Бройля. [1]

где — время, .

, то есть вероятность обнаружить частицу в любой точке одинакова.
Читайте также:

