Кривые нагрева и охлаждения чистого железа кратко
Обновлено: 04.07.2024
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как называют, в разных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой а, при более высокой В, затем у и т. д. Переход чистого металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре (критической точке) и сопровождается выделением тепла, если превращение идет при охлаждении, и поглощением тепла в случае нагрева. В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму. Поэтому такое превращение называют перекристаллизацией.
Полиморфные превращения происходят в чистых металлах, в сплавах, в химических соединениях. Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т. д.
Строение, получающееся в результате полиморфного превращения, называется аллотропической формой. Аллотропическая форма, устойчивая при более низкой температуре, обозначается индексом a, при более высокой – b, g и так далее.
Железо- полиморфно( может находиться в различных кристаллографических модификациях). Порядковый номер железа в таблице Менделеева -26, атомная масса А- 55.85 а.е.м.( атомные единицы массы). Радиус атома R – 1,27А. Температура плавления- 1539°С. Плотность – 7,68 г/ см³ . Кривая охлаждения железа представлена на рис. 1.4
Рис. 1.4 Кривая охлаждения чистого железа
768°С – точка Кюри ( магнитное превращение, в котором ά –Fе из ферромагнитного состояния переходит в паромагнитное.
910°С- температура, при которой a - Fе переходит в γ Fе с решеткой ГЦК и периодом элементарной частицы а=3,645А
1392°С- температура, при которой γ Fе переходит в σ Fе с решеткой ОЦК и периодом элементарной ячейки а- 2,86068А
1539°С- Тплавл.- температура плавления
Литература
1. Серебряков А.С. Материаловедение. Изоляционные материалы. М. 2009г.
2. Колесов С.Н., Колесов И.С Материаловедение и технология
конструкционных материалов . М 2007г.
3. Лейкин А.Е. Материаловедение, 1971г.
4.. Кудрявцев И.В. Материалы в машиностроении Выбор и применение Том 5, 1969г.
5. Лахтин Ю.М. Материаловедение Учебник для высших технических учебных заведений, 1990г.
6. Ржевская С.В. Материаловедение Учебник, 2004г.
7. Комаров О.С. Технология конструкционных материалов, 2005г.
8. Пейсахов А.Н. Материаловедение и технология конструкционных материалов, 2003г.
9. Попов В.А. Материалы в машиностроении Неметаллические материалы Справочник Том5, 1969г.
Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или, как называют, в разных модификациях. В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой а, при более высокой В, затем у и т. д. Переход чистого металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре (критической точке) и сопровождается выделением тепла, если превращение идет при охлаждении, и поглощением тепла в случае нагрева. В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму. Поэтому такое превращение называют перекристаллизацией.
Полиморфные превращения происходят в чистых металлах, в сплавах, в химических соединениях. Полиморфное превращение сопровождается скачкообразным изменением всех свойств металлов и сплавов: удельного объема, теплоемкости, теплопроводности, электропроводности, магнитных свойств, механических и химических свойств и т. д.

Строение, получающееся в результате полиморфного превращения, называется аллотропической формой. Аллотропическая форма, устойчивая при более низкой температуре, обозначается индексом a, при более высокой – b, g и так далее.
Железо- полиморфно( может находиться в различных кристаллографических модификациях). Порядковый номер железа в таблице Менделеева -26, атомная масса А- 55.85 а.е.м.( атомные единицы массы). Радиус атома R – 1,27А. Температура плавления- 1539°С. Плотность – 7,68 г/ см³ . Кривая охлаждения железа представлена на рис. 1.4
Рис. 1.4 Кривая охлаждения чистого железа
768°С – точка Кюри ( магнитное превращение, в котором ά –Fе из ферромагнитного состояния переходит в паромагнитное.
910°С- температура, при которой a - Fе переходит в γ Fе с решеткой ГЦК и периодом элементарной частицы а=3,645А
1392°С- температура, при которой γ Fе переходит в σ Fе с решеткой ОЦК и периодом элементарной ячейки а- 2,86068А
1539°С- Тплавл.- температура плавления
Литература
1. Серебряков А.С. Материаловедение. Изоляционные материалы. М. 2009г.
2. Колесов С.Н., Колесов И.С Материаловедение и технология
конструкционных материалов . М 2007г.
3. Лейкин А.Е. Материаловедение, 1971г.
4.. Кудрявцев И.В. Материалы в машиностроении Выбор и применение Том 5, 1969г.
5. Лахтин Ю.М. Материаловедение Учебник для высших технических учебных заведений, 1990г.
6. Ржевская С.В. Материаловедение Учебник, 2004г.
7. Комаров О.С. Технология конструкционных материалов, 2005г.
8. Пейсахов А.Н. Материаловедение и технология конструкционных материалов, 2003г.
9. Попов В.А. Материалы в машиностроении Неметаллические материалы Справочник Том5, 1969г.
Внимательно всмотревшись в излом металла, ясно можно увидеть, что он представляет собой нагромождение (совокупность) отдельных кристаллов (зерен), крепко сцепленных между собой. Мельчайшей частицей металла, как и всякого другого вещества, является атом. В элементарных ячейках, из которых состоят кристаллы железа, атомы расположены в определенном порядке. Это расположение изменяется в зависимости от температуры нагрева. При любой температуре ниже 910° атомы в ячейках кристаллов располагаются в виде куба, образуя так называемую кристаллическую решетку альфа-железа. В этом кубе восемь атомов расположены в углах решетки и один в центре.
При нагреве свыше 910° происходит перегруппировка атомов и кристаллическая решетка представляет собою форму куба с четырнадцатью атомами; условно ее называют решеткой гамма-железа. При температуре 1390° решетка гамма-железа перестраивается в решетку с девятью атомами, носящую название дельта-железо. Эта решетка отличается от решетки альфа-железа несколько большим расстоянием между центрами атомов и сохраняется до момента расплавления железа, т. е. до 1535° (Рис. 1).
Перестройка кристаллической решетки при медленном охлаждении происходит в обратном порядке: дельта-железо при 1390° превращается в гамма-железо, а гамма-железо при 898° превращается в альфа-железо.
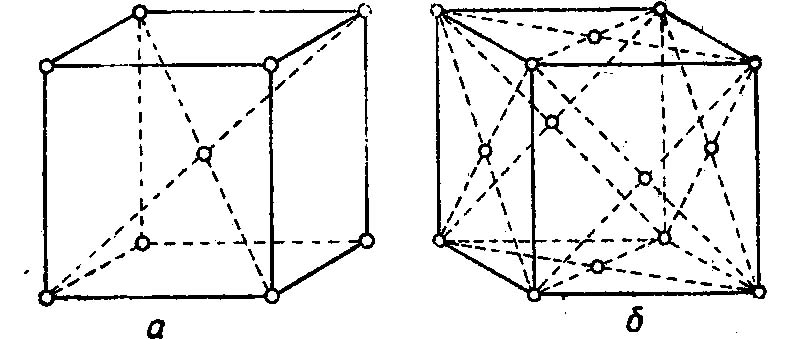
Рис. 1. Строение кристаллической решетки: а — альфа и дельта железа; б — гамма железа.
Критические точки превращения
На рис.2 показаны кривые охлаждения и нагревания чистого железа. Как видно из этих кривых, в процессе перестройки одной решетки в другую, а также при расплавлении и затвердевании железа происходят температурные остановки, являющиеся результатом выделения дополнительного количества тепла при охлаждении и поглощении дополнительного количества тепла при нагревании.
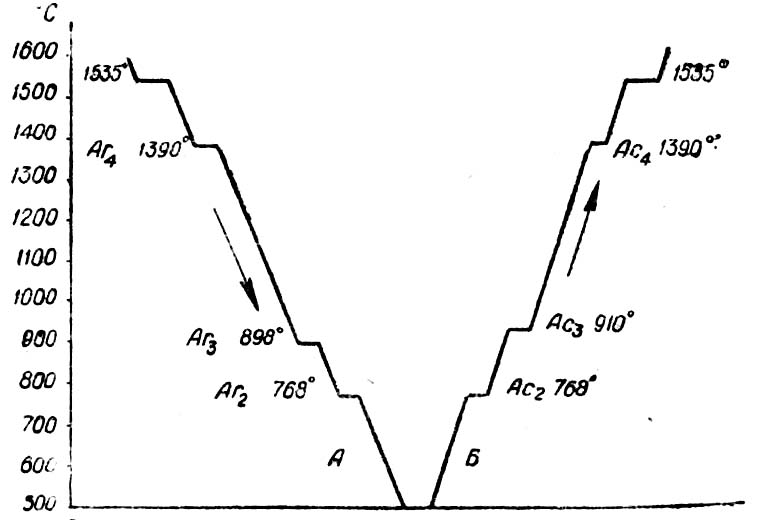
Рис. 2. Кривые охлаждения и нагрева чистого железа.
Температурные остановки, при которых происходят перестройки решеток, называются критическими температурами или критическими точками и обозначаются Аrпри охлаждении и Ас при нагревании. В точках Аr2и Ас2,не происходит перестройка атомной решетки, а изменяются магнитные свойства железа. При температуре выше 768° железо теряет способность притягиваться магнитом. При очень малой скорости нагревания и охлаждения критические точки А с3и Аr3не совпадают друг с другом на 12°. При увеличении скорости охлаждения несовпадение критических точек увеличивается, так как температура значительно снижается и железо переохлаждается. Это явление, носит название гистерезис.
При нагревании и охлаждении стали происходит также перестройка атомной решетки, но температуры критических точек не постоянны. Они зависят от содержания углерода и легирующих примесей в стали, а также от скорости нагревания и охлаждения.
На рис. 3 представлена диаграмма состояния углеродистой стали при медленном охлаждении и нагревании.
Рис.3. Диаграмма состояния углеродистых сталей.
Структура стали
Структурой стали называется внутреннее ее строение. Углерод в стали находится в виде химического соединения с железом, и это соединение называется — цементит. Кроме цементита, в стали имеется феррит, представляющий собой почти чистое железо. В зависимости от содержания углерода большая или меньшая часть феррита находится в механической смеси с цементитом, образуя новую структуру — перлит. Если небольшой кусок металла прошлифовать, отполировать и протравить в специальном реактиве, то под микроскопом можно различить структуры. Ниже приводится описание структур железоуглеродистых сплавов.
Аустенит представляет собою твердый раствор углерода и других элементов в гамма-железе. Наибольшее содержание углерода, которое может раствориться в ау-стените — это 2%. Аустенит образуется при затвердевании жидкой стали и при нагреве твердой стали выше критических температур.
В обычных сталях аустенит устойчив только лишь при температуре выше критических точек. При охлаждении, даже самом быстром, с этих температур аустенит превращается в другие структуры. При комнатной температуре аустенит полностью сохраняется в ряде марок нержавеющих сталей, в высокомарганцовистой стали и в незначительном количестве остается при закалке некоторых марок инструментальной и конструкционной сталей.
Аустенит мягок, пластичен, тягуч, мало упруг. Твердость его по Бринелю находится в пределах 170—220.
Аустенит немагнитен, обладает невысокой электропроводностью.
Феррит представляет собой твердый раствор углерода и других элементов в альфа-железе. Наибольшее содержание углерода, которое может раствориться в феррите, это 0,04%. Феррит устойчив при температурах ниже критической точки AC1. Он выделяется из аустенита при медленном охлаждении последнего ниже A6i. Феррит мягок, сильно тягуч. Твердость HB= 60—100. Феррит магнитен до 768°. Свыше этой температуры он теряет магнитные свойства.
Цементит представляет собой химическое соединение железа с углеродом Fe3C—карбид железа. Цементит содержит углерода 6,67%. Выделяется из жидкого и твердого раствора при медленном охлаждении. Цементит весьма тверд и хрупок. Твердость его НB= 800—820. Он магнитен до 210°. Выше этой температуры цементит теряет магнитные свойства.
Перлит представляет собой механическую смесь феррита и цементита. Он образуется из аустенита при медленном его охлаждении. Температура превращения аустенита в перлит 723°С. При весьма медленном переходе через эту температуру цементит образуется в виде зерен (глобулей), и тогда перлит называется зернистым. При более быстром охлаждении цементит приобретает форму пластинок, и такой перлит называется пластинчатым. При весьма быстром охлаждении в результате значительного переохлаждения аустенита вместо перлита получаются другие структуры, о которых речь будет ниже.
Перлит магнитен, прочен и пластичен. Твердость его находится в пределах от 160 до 230 кг/мм 2 по Бринелю. При обработке резанием наиболее чистую поверхность дает структура зернистого перлита.
Мартенсит образуется в результате весьма быстрого охлаждения (закалки) аустенита. При быстром охлаждении успевает произойти перестройка кристаллической решетки гамма-железа в решетку альфа-железа, выделение же углерода в карбид железа не успевает произойти, и он весь остается растворенным в решетке альфа-железа. Так как нормально альфа-железо может растворить в себе не более 0,04% углерода, то такой раствор называют пересыщенным. Он отличается весьма большой твердостью (свыше Rc= 60) и хрупкостью. Следует указать, что решетка альфа-железа, получающаяся в результате закалки, имеет искаженную форму. Так, размеры ее граней не одинаковы — в одном направлении они удлинены за счет других (см. рис. 4). Такая решетка называется тетрагональной. Чем больше в стали углерода, тем больше тетрагональность решетки и тем более велики внутренние напряжения. При нагревании до температур 100—200° тетрагональность мартенсита уменьшается, форма кристаллической его решетки приближается к форме правильного куба, и вместе с этим уменьшаются внутренние напряжения. Мартенсит магнитен.
Рис. 4. Строение кристаллической решетки стали, закаленной на мартенсит.
Троостит представляет собой высокодисперсную (мелкораздробленную) смесь феррита и карбидов. Он образуется при охлаждении аустенита с замедленной против закалки скоростью или в результате нагрева (отпуска) мартенсита в пределах 250—400°.
При нагреве закаленной стали происходит постепенное выделение углерода из кристаллической решетки с образованием карбидов. Троостит менее прочен, более пластичен, чем мартенсит. Твердость его НB330—400. При охлаждении аустенита в горячих средах в интервале 250—400° (изотермическое превращение аустенита) происходит образование игольчатого троостита, несколько более прочного, чем обычный троостит.
Сорбит представляет собой дисперсную смесь феррита и карбидов. Он образуется при охлаждении аустенита с небольшой скоростью или при нагреве (отпуске) мартенсита до 400—650°. Карбиды сорбита более крупные, чем троостита. Сорбит пластичен, вязок и магнитен. Твердость НВ 270—320.
Ледебурит представляет собой эвтектическую смесь аустенита и цементита. Он содержит углерода 4 3% Образуется ледебурит при затвердевании жидкого сплава с содержанием углерода свыше 2%. Ледебурит хрупок.
На рис. 5. представлены фотоснимки структур стали с различным содержанием углерода.
Структура стали с содержанием углерода 0,83% состоит из сплошного перлита и называется эвтектоидной; при меньшем содержании углерода структура стали состоит из перлита и феррита и носит название доэвтектоидной, а при большем содержании углерода — из перлита и цементита и называется заэвтектоидной. Температура 723°, при которой перлит переходит в аустенит, также называется критической и обозначается Ас.
Для того чтобы доэвтектоидную и эвтектоидную сталь полностью отжечь, нормализовать или закалить, их нужно нагреть до такой температуры, при которой они перешли бы в аустенитное состояние.
Рис. 5. Микроструктура отожженной углеродистой стали:
а - с содержанием углерода -0,1%
б - с содержанием углерода -0,85%
в - с содержанием углерода -1,1%
Превращения, происходящие в стали при нагревании
По диаграмме на рис. 3 можно проследить за изменениями структуры трех разных марок стали при нагревании:
- Сталь с содержанием углерода 0,83%. Структура стали представляет собой перлит. При температуре 723° в точке Aс1 перлит переходит в аустенит.
- Сталь с содержанием углерода 0,4%. Структура стали представляет собой перлит и феррит. При температуре 723° в точке К1 перлит переходит в аустенит, и по мере повышения температуры происходит растворение свободного феррита в аустените. При пересечении линии GS в точке К2 закончится растворение феррита и структура будет полностью состоять из аустенита. Для этой стали точка К1на диаграмме будет нижней критической точкой Ас1,а К2— верхней критической точкой Ас1,.
- Сталь с содержанием углерода 1,2%. Структура стали представляет собой перлит и цементит. При температуре 723° в точке Pi перлит переходит в аустенит, и при дальнейшем повышении температуры происходит постепенное растворение цементита в аустените. При пересечении линии SEв точке Р2 это растворение закончится. Для этой стали точка Р1 явится нижней критической точкой Ас1, а точка Ρ2 — верхней критической точкой, которая для заэвтектоидных сталей обозначается Асm.
Линия на диаграмме, обозначенная буквами GS, соответствует окончанию растворения феррита в аустените в доэвтектоидных сталях, а линия SE соответствует окончанию растворения цементита в аустените в заэвтектоидных сталях.
Следует указать, что заэвтектоидные стали при операциях термической обработки не нагревают выше линии Аcт(такая высокая температура нагрева приведет к перегреву и ухудшению свойств стали), а ограничиваются нагревом выше первой критической точки ACl, что полностью обеспечивает получение необходимых свойств.
Превращения, происходящие в стали при медленном охлаждении
В сталях, нагретых до аустенитного состояния, при весьма медленном охлаждении произойдут обратные превращения, а именно:
а) в стали с содержанием углерода 0,83% аустенит превратится в перлит;
б) в стали с содержанием углерода 0,4% сначала из аустенита начнет выделяться феррит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит и
в) в стали с содержанием углерода 1,2% сначала из аустенита выделится цементит, а затем в районе температуры 700° оставшийся аустенит превратится в перлит.
Даже при весьма медленном охлаждении температура распада аустенита не совпадает с теми температурами, при которых аустенит образовался при нагревании. Чем скорость охлаждения больше, тем больше становится гистерезис, т. е. разница между критическими температурами (точками) при нагревании и охлаждении.
Превращения, происходящие в стали при быстром охлаждении
Как указывалось выше, при быстром охлаждении не успевает произойти превращение аустенита в перлит с выделением избыточного феррита или цементита, а в зависимости от скорости охлаждения аустенит превращается в новые структуры - мартенсит, троостит или сорбит. Сталь с этими структурами отличается от сталей со структурами перлита и феррита повышенной твердостью, прочностью и уменьшенной пластичностью. Если углеродистую сталь, нагретую выше критических температур, охладить очень быстро, то аустенит превратится в мартенсит и это превращение начнется лишь при температуре около 200°. При несколько меньшей скорости охлаждения образуется структура троостит, а при еще меньшей — сорбит.
В производственных условиях при охлаждении углеродистой инструментальной стали в воде образуется мартенсит, при охлаждении в масле — троостит и при охлаждении в струе воздуха -сорбит. На рис. 6 показаны микроструктуры закаленной стали.
Рис. 6. Микроструктура закаленной стали:
а — игольчатый мартенсит;
В легированных сталях, благодаря присутствию специальных элементов, для образования мартенсита не требуется столь большой скорости охлаждения, как для углеродистых сталей, и мартенсит образуется при охлаждении в масле, а для быстрорежущих сталей — и при охлаждении на воздухе.
Троостит и сорбит можно получить не только в результате ускоренного охлаждения, нои путем нагрева закаленной стали, имеющей структуру мартенсита, до температуры ниже Aс1, т. е. путем отпуска стали. В этом случае троостит получается при нагреве стали до 400°, а сорбит—при нагреве до 650°. При нагреве до промежуточных температур получаются смешанные структуры: при нагреве от 250—400° — мартенсит и троостит и при нагреве от 400—650° — троостит и сорбит. В производственных условиях троостит и сорбит получают путем отпуска закаленной стали.
Превращения, происходящие в стали при охлаждении в среде, имеющей температуру выше 200° (изотермическое превращение)
Если деталь, нагретую выше критической точки, поместить в среду, имеющую температуру от 700 до примерно 200°, и выдержать в ней до выравнивания температуры по всему сечению, то аустенит превратится в ту структуру, которая соответствует превращению при данной температуре.
О поведении стали при изотермической обработке, выборе температуры и времени выдержки судят по кривым изотермического превращения, построенным для разных марок стали.
Рис. 7. Диаграмма изотермического превращения аустенита углеродистой стали.
На рис. 7 дан вид диаграммы изотермического превращения в стали. На горизонтальной оси отложено время начала и конца превращения, а на вертикальной— температура, при которой оно происходит. Линия А с соответствует переходу аустенита в перлит, а линия Мн — образованию мартенсита из аустенита. На кривой I начинаются, а на кривой II заканчиваются структурные превращения.
Если углеродистую инструментальную сталь, нагретую до 800°, поместить в масло, расплавленную соль или щелочь при температуре 250°, в ней образуется игольчатый троостит с высокой твердостью Rc=45—55. Если эту же сталь охладить в среде, имеющей температуру свыше 600°, в ней образуется перлит и такая сталь легко обрабатывается на станках. При охлаждении стали в среде с промежуточными температурами образуются структуры троостита и сорбита с соответствующей твердостью.
Изотермический отжиг нашел большое применение при термической обработке инструментальных сталей как процесс, резко уменьшающий время по сравнению с другими видами отжига.
Изотермическая закалка в инструментальном деле применяется редко из-за недостаточной для инструмента твердости, достигаемой при этом процессе.
Источник:
Остапенко Н.Н.,Крапивницкий Н.Н. Технология металлов. М. Высшая школа,1970г.
Каменичный И.С. Практика термической обработки инструмента. Киев, 1959 г.
Металлы - неорганические, крупнокристаллические, абсолютно плотные вещества, обладающие специфическими свойствами: металлическим блеском, высокой прочностью, электро- и теплопроводимостью..
Кристаллизация - процесс перехода металла из жидкого состояния в твердое. Кристаллизация состоит из двух процессов: 1)зарождения мельчайших частиц кристаллов (зародышей или центров кристаллизации) и 2)роста кристаллов из этих центров.
С понижением температуры подвижность ионов падает и вблизи температуры плавления образуются скопления атомов, в которых они расположены, как в кристаллах, правильными рядами и они начинают обрастать новыми слоями. Такие скопления являются центрами кристаллизации (зародышами). Кристаллы свободно растут до тех пор, пока со всех сторон их окружает жидкий металл. По достижению температуры затвердевания, вновь образуется кристаллическая решетка и металл переходит в твердое состояние.
Чистое железо(суммарное содержание примесей — до 0,1%, углерода — до 0,02%). Технически чистое железо мягкое(не твёрдое)устойчиво к коррозии, обладает повышенной электропроводностью и очень высокой пластичностью.
До температуры 1539 °С происходит охлаждение жидкого железа. На кривой охлаждения появляется площадка. При этой температуре железо затвердевает, и выделяется скрытая теплота кристаллизации. По окончании кристаллизации и до температуры 1392 °С железо имеет объемно-центрированную кубическую решетку. При 1392 °С на кривой появляется вторая площадка, связанная с аллотропическим превращением α-железа (Feα) в -железо (Fe), имеющее гранецентрированную кубическую решетку.
При аллотропическом превращении исчезают старые зерна и появляются новые. Такое превращение аналогично процессу кристаллизации: вначале образуются зародыши, а затем идет рост зерен новой модификации(перекристаллизацией)
Следующая площадка наблюдается на кривой охлаждения при температуре 911 °С по причине превращения Fe в Feα. Кристаллическая решетка превращается из гранецентрированной опять в объемно-центрированную кубическую, которая сохраняется до самых низких температур.
Площадка на кривой охлаждения, соответствующая температуре 768 °С, связана с перестройкой электронных оболочек атомов и изменением магнитных свойств. Ниже 768 °С железо магнитно, а выше – немагнитно.
Чистое железо кристаллизуется в виде трех модификаций α, и β(α-феррит, аустенит и β-феррит), каждая из которых устойчива в своем интервале температур. Модификации α и β обладают одинаковой кубической пространственно центрированной решеткой и представляют собой, - строго говоря, одну фазу. β-Fe отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика. Его не выделяют как отдельную фазу, и рассматривает как разновидность α-Fe; модификация является кубической гранецентрированной решеткой.
2. Виды сплавов, основные составляющие структуры сплавов
Сплавы - сложные кристаллические вещества, которые обладают свойствами металлов.
1) По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов.
2) По способу получения заготовки (изделия) различают литейные (чугуны), деформируемые (стали) и порошковые сплавы.
3) В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным).
Твёрдый раствор является основой сплава (матричная фаза). Фазовый состав гетерогенного сплава зависит от его химического состава. В сплаве могут присутствовать: твердые растворы внедрения, твердые растворы замещения, химических соединений (карбиды, нитриды) и кристаллиты простых веществ.
1) Феррит – твердый раствор углерода в α-Fe. При температуре 723° С предельное содержание углерода 0,02 %. При отсутствии примесей не корродирует.
2) Цементит – карбид железа Fe3C – химическое соединение, содержащее 6,67 % углерода. Является составной частью эвтектической смеси, а также самостоятельной структурной составляющей. Способен образовывать твердые растворы путем замещения атомами других металлов, неустойчив, распадается при термической обработке. Цементит очень тверд (НВ 800) и хрупок.
3) Аустенит – твердый раствор углерода в γ–Fe. Атомы углерода внедряются в кристаллическую решетку, причем насыщение может быть различным в зависимости от температуры и примесей. Устойчив только при высокой температуре, а с примесями Mn, Сг – при обычных, даже низких температурах. Твердость аустенита НВ 170-220.
4) Перлит – эвтектоидная смесь феррита и цементита, образуется при распаде аустенита при температуре 723° С и содержании углерода 0,83 %. Твердость перлита НВ 160-260. Структура перлита может быть пластинчатой и глобулярной (зернистой).
5) Ледебурит – эвтектическая смесь аустенита и цементита, образующаяся при 1130° С и содержании углерода 4,3 % Структура неустойчивая: при охлаждении аустенит, входящий в состав ледебурита, распадается на вторичный цементит и перлит. Ледебурит очень тверд (НВ 700) и хрупок.
6) Графит – мягкая и хрупкая составляющая чугуна, состоящая из разновидностей углерода. Встречается в серых и ковких чугунах.
3. Углеродистые стали — структура, свойства, применение.
Углеродистые стали - это сплавы железа с углеродом, содержащие до 2,14 % углерода при малом содержании других элементов. Они обладают высокой пластичностью и хорошо деформируются.
- доэвтектоидные (менее 0,8% С)
- эвтектоидные (0,8% С)
- заэвтектоидные (С более 0,8%)
2) По способу получения
3) По степени раскисления
4) По качеству (определяется содержанием вредных примесей в стали)
5) По содержанию углерода
С увеличением углерода в структуре стали растет содержание цементита. При содержании до 0,8 % С сталь состоит из феррита и перлита, при содержании более 0,8 % С в структуре стали, кроме перлита, появляется структурно свободный вторичный цементит.
Феррит имеет низкую прочность, но сравнительно пластичен. Цементит характеризуется высокой твердостью, но хрупок. Поэтому с ростом содержания углерода увеличивается твердость и прочность и уменьшается вязкость и пластичность стали. Рост прочности происходит до 0,8–1,0 % углерода. При увеличении содержания углерода более 0,8 % уменьшается не только пластичность, но и прочность.
С увеличением содержания углерода ухудшается свариваемость, а также способность деформироваться в горячем и особенно в холодном состоянии.
Находят многостороннее применение в технике: детали изготавливаемые холодной штамповкой и глубокой вытяжкой, используют для деталей не испытывающих высоких нагрузок, детали автотракторного с/х машиностроения, слабонагруженные и средненагруженные оси, валы различных машин и механизмов, ж/д рельсы.
4) Зависимость свойств стали от химического состава.
Сталь— сплав (твёрдый раствор) железа с углеродом (и другими элементами). Содержание углерода в стали не более 2,14 %. Углерод придаёт сплавам железа прочность и твёрдость, снижая пластичность и вязкость.
Свойства сталей зависят от их состава и структуры, которые формируются присутствием и процентным содержанием следующих составляющих:
1) Углерод — элемент, с увеличением содержания которого в стали увеличивается её твердость и прочность, при этом уменьшается пластичность.

2) Кремний и марганец в пределах (0,5-0,7 %) существенного влияния на свойства стали не оказывают.
3) Сера является вредной примесью, образует с железом химическое соединение FeS. Сернистое железо обусловливает ломкость материала при обработке давлением с подогревом. Сера уменьшает пластичность и прочность стали, износостойкость и коррозионную стойкость.
4) Фосфор также является вредной примесью, т.к. придает стали хрупкость при пониженных температурах.
5) Феррит — железо с объемноцентрированной кристаллической решеткой и сплавы на его основе является фазой мягкой и пластичной.
6) Цементит — карбид железа, химическое соединение с формулой Fe3C предоставляет стали твердость и хрупкость.
7) Перлит — эвтектоидная смесь двух фаз — феррита и цементита, содержит 1/8 цементита и поэтому имеет повышенную прочность и твердость по сравнению с ферритом. Поэтому доэвтектоидные стали гораздо более пластичны, чем заэвтектоидные.
5.Влияние структуры на свойства стали
Величина зерен оказывает существенное влияние на механические свойства стали (чем мельче зерна, тем выше качество стали).
Структура низколегированных сталей аналогична структуре малоуглеродистой стали. Низколегированные стали тоже содержат мало углерода, повышение их прочности достигается легированием — добавками, которые, как правило, находятся в твердом растворе с ферритом и этим его упрочняют; некоторые из них образуют карбиды, также упрочняющие ферритовую основу и прослойки между зернами.
Основные химические элементы, применяемые при легировании малоуглеродистой стали, стали повышенной и высокой прочности.
Углеродистая сталь обыкновенного качества состоит из железа и углерода с некоторой добавкой кремния или алюминия, марганца, меди.
Углерод (У), повышая прочность стали, снижает пластичность и ухудшает ее свариваемость; поэтому в строительных сталях, которые должны быть достаточно пластичными и хорошо свариваемыми, углерод допускается в количестве не более 0,22%.
Кремний (С), находясь в твердом растворе с ферритом, повышает прочность стали, но ухудшает ее свариваемость и стойкость против коррозии.
Алюминий (Ю) входит в сталь в виде твердого раствора феррита и в виде различных нитридов и карбидов, хорошо раскисляет сталь, нейтрализует вредное влияние фосфора, повышает ударную вязкость.
Марганец (Г) растворяется как в феррите, так и в цементите; образует тугоплавкие карбиды, что приводит к повышению прочности и вязкости стали.
Медь (Д) несколько повышает прочность стали и увеличивает стойкость ее против коррозии. Избыточное ее содержание (более 0.7%) способствует старению стали.
Прочность низколегированных сталей также повышается при введении никеля, меди, кремния и алюминия, которые входят в сталь в виде твердых растворов (феррита).
Вольфрам и молибден, значительно повышая твердость, снижают пластические свойства стали: никель повышает прочность стали и пластические ее свойства.
Молибден (М) и бор (Р) обеспечивают высокую устойчивость аустенита при охлаждении и тем самым облегчают получение закалочных структур (так называемых бейнита и мартенсита), что очень важно для получения высокопрочного проката больших толщин.
Азот (А) в несвязанном состоянии способствует старению стали и делает её хрупкой, особенно при низких температурах.
6.Диаграмма состояния системы железо-цементит

Диаграмма состояния железо - цементит. В диаграмме состояния железо – цементит (Fe-Fe3C) рассматриваются процессы кристаллизации железоуглеродистых сплавов (стали и чугуна) и превращения в их структурах при медленном охлаждении от жидкого расплава до комнатной температуры. Диаграмма показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67% С). Сплавы с содержанием углерода до 2,14% называют сталью, а от 2,14 до 6,67% - чугуном.
Диаграмма состояния Fe-Fe3C представлена в упрощенном виде. Первичная кристаллизация, т. е. затвердевание жидкого сплава начинается при температурах, соответствующих линии ликвидуса ACD
7.Виды термической обработки стали
Шире других видов термической обработки применяют отжиг, нормализацию, закалку и отпуск стали.
Отжиг стали производят в тех случаях, когда необходимо уменьшить твердость, повысить пластичность и вязкость, ликвидировать последствия перегрева, получить равновесное состояние, улучшить обрабатываемость при резании.
Полный отжиг стали производят путем нагрева ее до температуры выше верхних критических точек на 20. 50 СС (Лс3 + 20. 50°С), т.е. выше линии GS, выдержки при такой температуре до полного прогрева слитка с последующим очень медленным охлаждением (вместе с охлаждаемой печью, под слоем песка, золы, шлака и т. п.).
При неполном отжиге сталь нагревают выше нижних критических точек на 2О. 5О°С (ЛЙ+20. 50° С), выдерживают при этой температуре с последующим медленным охлаждением. При неполном отжиге происходит только частичная перекристаллизация. Неполному отжигу подвергают стали, не требующие исправления структуры, т. е. измельчения.
Для снятия внутренних напряжений, снижения твердости, улучшения обрабатываемости металлов применяют низкотемпературный отжиг.
Закалка стали заключается в нагреве ее до температуры образования аустенита (727 + градусов), выдержке при этой температуре и последующем быстром охлаждении. В зависимости от скорости охлаждения сталь получают в состоянии мартенсита, троостита или сорбита закалки.
При закалке обычной углеродистой стали в слабых водных растворах — электролитах или в холодной воде сталь получает структуру мартенсита; при закалке в горячей воде или минеральном масле — структуру троостита и в расплавленном свинце — структуру сорбита. Стали с содержанием углерода менее 0,2 % практически не воспринимают закалку.
Закалке подвергают готовые изделия с целью повышения твердости, и прочности.
Метод термомеханической обработки (ТМО) проводят в две стадии: 1) горячая или теплая деформация в области существования высокотемпературной фазы — аустенита (выше критических точек Лез, либо ниже критических точек Ас\); 2) последующее регламентированное охлаждение, в процессе которого деформированный аустенит претерпевает полиморфное превращение. Чаще всего применяют закалку на мартенсит. Высокие механические свойства после ТМО обусловливаются получением мелкодисперсной структуры с повышенной плотностью.
Отпуском называют термическую обработку, при которой закаленную сталь нагревают до температуры ниже критических точек Ас\ (723 °С), выдерживают при этой температуре, а затем охлаждают. При отпуске стали мартенсит закалки и остаточный аустенит распадаются, образуя более устойчивые структуры (троостит, сорбит). Цель отпуска — уменьшение внутренних напряжений, снижение твердости и хрупкости, повышение пластичности.
Различают три вида отпуска : низкий (в интервале температур 150. 200°С), средний (300. 400°С), высокий (500. 600°С). При низком отпуске сталь сохраняет структуру мартенсита.При среднем и высоком отпуске проходят диффузионные процессы и мартенсит распадается с образованием смеси феррита с высокодисперсными частицами цементита (троостита или сорбита
8.Примеси в сталях и их влияние на свойства
Углерод в стали находится в виде химического соединения-Fe3C (цементита), а также в виде твердого раствора — углерода FeαC (феррита).
С увеличением содержания углерода твердость и прочность стали увеличиваются, а пластичность и ударная вязкость понижаются.
В углеродистых сталях обычно содержится 0,10—0,35% Si и 0,3—0,8% Mn. Их присутствие благоприятно сказывается на качестве стали: с увеличением их процентного содержания увеличиваются упругие свойства стали, сопротивление коррозии, твердость, а также улучшаются магнитные свойства.
Фосфор и сера являются неизбежными вредными примесями. Сера находится в стали в виде соединения FeS. Присутствие серы способствует красноломкости стали, т. е. способности к образованию трещин при высоких температурах, понижению сопротивления усталости, уменьшению сопротивления коррозии.
Фосфор находится в стали в виде соединения Fe3P. Кристаллы этого химического соединения обычно располагаются по границам зерен стали, ослабляя связь между ними и, тем самым, придавая стали хрупкость в холодном состоянии (хладноломкость).
Углеродистая сталь по химическому составу подразделяется на три группы:
низкоуглеродистая, содержащая до 0,25% С;
среднеуглеродистая, содержащая 0,25—0,60% С;
высокоуглероднстая, содержащая 0,6—2,0% С.
Сталь по способу изготовления подразделяется на следующие виды:
обычного качества (изготовляется конверторным способом);
качественная (выплавляется конверторным способом и в мартеновских печах);
высокого качества (может выплавляться как в мартеновских, так и электрических печах).
Чем меньше в стали будет вредных примесей (серы и фосфора), тем выше качество стали.
9)Легированные стали и их свойства.
Стали, в которые вводят легирующие элементы (Cu, Al, Si, Ti, V, Cr, Nb, W, Mo, Ni, Mu, Co и др.) называются легированными. Легирование повышает коррозионную стойкость в условиях низких и высоких температур и давлений, повышают прочность, твердость, износостойкость и др.
Cu, Si, Cr, Mo, Ni – коррозионную стойкость;
Si, Cr, Mo, W, Mn, Ni – твердость и прочность;
Cr, Mn, Ni – вязкость;
Cr, Mn, Ni – сопротивление истиранию.
Преимущества легированных сталей особенно полно проявляется после термической обработки.
1)По содержанию углерода
С C c реднеуглеродистая
10)рельсовая сталь
Рельсы для железнодорожного транспорта изготавливаются из углеродистой стали. Качество рельсовой стали определяется её химическим составом, микроструктурой и макроструктурой.
Углерод повышает твёрдость и износостойкость стали. Однако большое содержание углерода, при прочих равных условиях, делает сталь хрупкой, химический состав при повышении содержания углерода должен выдерживаться более жестко, особенно в отношении вредных примесей. Марганец повышает твёрдость, износостойкость и вязкость стали. Кремний увеличивает твёрдость и износостойкость. Мышьяк увеличивает твёрдость и износостойкость стали, но в больших количествах уменьшает ударную вязкость. Ванадий, титан, цирконий — микролегирующие добавки, улучшают структуру и качество стали.
Мы уже начинали рассматривать диаграммы состояния в этой публикации и там разобрали основные понятия, которые важно осмыслить, прежде, чем вникать в тему более глубоко. Но тут меня попросили разобрать диаграмму состояния железо-углерод (её ещё частенько называют железо-цементит). Ну что же, запасаемся попкорном и пытаемся вместе разобраться в этом крокодиле.
Диаграмма состояния железо-углерод , в том или ином количестве, встречается всем инженерам. Изучают её на курсе материаловедения, а прослушивают этот курс все технари. В большинстве случаев, изучение этой темы превращается в кошмар. Особенно, когда тебя просят нарисовать этот кошмар по памяти на листочке. Но главный вопрос - почему именно эта диаграмма? Ответ простой. На диаграмме железо-углерод есть большая часть сложных моментов, которые вообще встречаются на диаграммах состояния. От того, поняв её мы разберемся и со всеми основами чтения диаграмм. Кроме всего этого, сплавы железа всё ещё продолжают заниматься лидирующее положение среди конструкционных материалов. Поэтому, вперёд друзья.
Как мы помним, диаграмма состояния - это график фазовых состояний в зависимости от концентрации каждого химического элемента и температуры.
Значит, диаграмма железо-углерод - это отображение фазового состояния сплавов железа с углеродом в зависимости от их химсостава и температуры.
Это нужно для того, чтобы мы, зная химический состав стали и температуру системы, могли понять, какой фазовый состав будем иметь. Знания эти необходимы для того, чтобы выбрать правильный режим термической обработки или подобрать вариант механической обработки (ведь зная фазовый состав мы уже примерно представляем свойства).
Вот, собственно, и всё, что нужно знать про диаграмму :). Теперь остается научиться её читать. И с этим есть масса сложностей.
Вот диаграмма железо-углерод на рисунке ниже. И что это? А мы не понимаем, что это :)! Давайте разбираться, ибо сейчас оно выглядит скорее как клетчатый листочек с нарисованным динозавром.
По оси ординат у нас обозначены температуры системы . По оси абцисс - химические составы .
Максимальная температура системы ограничивается температурами плавления компонентов. Выше идёт только жидкость. Но про фазы чуть позднее.
Слева у нас феррит . Справа - углерод . Количество углерода растёт слева направо.
Обратите внимание и на нижнюю шкалу, где отложен Fe3C.
Это цементит . Его количество также увеличивается слева направо. Цементит - это карбид железа или химическое соединение железа с углеродом . Но есть подлянка, куда же без неё :). Максимальное количество углерода в этой системе у нас 6,67% . А вот цементита будет 100%. Процентное содержание цементита не соответствует проценту углерода.
Это появилось из-за того, что в системе железо-углерод в целом возможно максимальное содержание углерода 6,67% на физическом уровне .
И вот тут внимание! Чистое железо (альфа-железо) у нас на диаграмме есть только в крайней левой точке . Этот вопрос любят задавать на защитах. Всё что дальше вправо - это феррит. А феррит, как мы помним, это твёрдый раствор углерода в альфа железе . Или, сплав железа с углеродом.
На диаграмме мы видим и сталь, и чугун . Их отличие в том, что сталь - это содержание углерода в сплаве с железом от 0,02 до 2,14%. Чугун - тот же сплав железа с углеродом, но с содержанием от 2,14% углерода.
Фазы на диаграмме
Само собой, из диаграммы состояния можно узнать фазовый состав . Или на кой чёрт она бы ещё сдалась :) Тут мы видим следующие фазы .
- Жидкая фаза - это коктейль, который получается, если всё расплавить. Обращаем внимание, что при разных химических составах мы имеем разные температуры плавления.
- Феррит - уже обсудили, что это твердый раствор внедрения углерода в альфа железо.
- Аустенит - это твёрдый раствор внедрения углерода в гамма железо.
- Цементит - тоже уже обсудили. Химическое соединение железа с углеродом. Максимальная концентрация углерода в цементите 6,67% по массе и это предельная для железоуглеродистых сплавов концентрация.
- Графит - это фаза состоящая только из углерода со слоистой гексагональной решёткой. Он выделяется в системе железо-углерод при определенных условиях.
Сразу отмечу, что на этом фазы заканчиваются. Преподы любят заваливать на подобных вопросах. Фаз на диаграмме у нас больше нет, зато есть кое-что ещё. Об этом далее.
Наверняка возникает вопрос что это за альфа-железо и за гамма-железо . Это так называемый полиморфизм. Химический состав один, а вид кристаллической решетки разный.
На самой же диаграмме есть ещё всякие буковки . И если буквы А (аустенит), Ж (жидкость), Ц (цементит), то всё ясно. Но ещё есть буквы Л и П. Что это такое?
Структуры на диаграмме
Л - это ледебурит . Так называется особенная структура, характерная преимущественно для чугунов. Представляет собой эвтектическую смесь аустенита и цементита. Её же можно назвать механической смесью.
П - это перлит . Ещё одна структура, которая представлена эвтектоидной смесью из тонких пластинок феррита и цементита.
Новые слова для нас эвтектическая и эветктоидная. Эвтектическая в данном случае означает образование гетерогенной структуры сплава. Эвтектоидная - по сути тоже самое, только образуется изначально не из жидких фаз, а из твердых.
Эветктика же, это точка, в которой находятся в термодинамическом равновесии n - твёрдых фаз и жидкая фаза. Жидкая эвтектика кристаллизуется при температуре более низкой, чем температура кристаллизации каждого из веществ, входящих в состав смеси. Температура плавления твёрдой эвтектики — самая низкая для данной смеси компонентов.
Что происходит на диаграмме железо-углерод
Теперь самое веселое. Вроде бы всё, что вокруг на диаграмме есть, мы проанализировали. Остается понять что во что и когда превращается :)
Ну, мы уже поняли, что отправная точка - это температура. Греем систему из железа и углерода и видим изменения.
На диаграмме мы видим многочисленные линии ликвидуса и солидуса . Это линии, по которым идёт плавление и кристаллизация соответственно.
Удобно пользоваться следующей картинкой. Здесь расставлены все фазы и структуры.
Если путешествовать по линиям, то видим протекающие процессы.
Всё, что выше линий ABCD - жидкая фаза. Значит это линия ликвидус . Выше неё только жидкая фаза. Дальше работаем по правилу фаз Гиббса. Линию солидус найти сложнее. Ниже неё только твердая фаза. Тут солидусов несколько.
Не знаю, стоит ли досконально разбирать каждую линию. Если у вас есть вопросы, задавайте их в комментариях и я дополню материалы.
Сейчас же попробую обобщить всё одной фразой . Читаем внимательно. Диаграмма состояния железо-углерод, с размеченными областями, как показано на рисунке выше, указывает нам фазовые и структурные состояния, которые мы имеем в системе при данных параметрах (температура и химсостав) . Линии указывают начало или конец процесса кристаллизации или плавления. Всё! Другого секрета тут нет.
Как пользоваться диаграммой железо-углерод
Часто преподы гасят студентов вопросами про использование диаграммы состояния. Ученик не понимает, как диаграммой пользоваться и зачем её вообще нужно изучать. Рассмотрим типичную задачу.
Нужно нам изучить состояния сплава, содержащего 0,4% углерода в своем составе . Имеем дело с обычной сталью.
Поднимаем перпендикуляр из точки, соответствующей количеству углерода в 0,4%.
Видим, что система, в диапазоне от 0 до 700 градусов, представляет собой твердую смесь перлита и цементита. В точке 4 происходит переход и в диапазоне от 700 до 800 градусов и мы попадаем в зону аустенита и феррита.
В диапазоне от 800 до 1450 градусов сплав имеет состав аустенита, а переход состоялся в точке 3.
В диапазоне от 1450 до 1520 градусов рассматриваемый сплав начинает постепенно плавиться и представлен аустенитом и жидким раствором. Переход происходил в точке 2.
Ну и всё что выше - это уже жидкость, где произошла гомогенизация. Вот такие данные можно выцепить.
Часто возникают вопросы, что именно происходит в точках перехода (которые у нас отмечены 1,2,3 и 4). Там мы имеем адский коктейль. Нестабильную смесь. Например, в точке 4 будет месиво из феррита, перлита и аустенита. Пропорции тут можно определить только лабораторным испытанием.
Ещё может появиться вопрос, а что у нас, например, на отрезке 2 - 3. Тут ответ очевиден - там 100% аустенита. Т.е. 0,4% углерода внедрились в структуру гамма железа и застыли .
Сложнее ситуация на отрезках, типа 0 - 4. Там у нас феррит + перлит. Но чего сколько? Ответ кроется в понимании характерных точек. Перлит у нас в точке S. Значит, просто смотрим насколько далеко точка 4 от точки S.
Характерные точки на диаграмме железо-углерод
В системе железо-углерод происходит невероятное количество превращений. Несколько мы уже обсудили. Но систематизируем все знания.
Кривые охлаждения и нагрева чистого железа представлены на фиг. 85. На них видим четыре критические точки: для кривой нагрева 770, 910, 1390 и 1539°; для кривой охлаждения 1539, 1390, 906 и 770°. Критическая точка 1539° соответствует переходу железа из жидкого состояния в твердое и из твердого в жидкое; температура 770° является температурой точки Кюри, остальные критические точки указывают на структурные превращения железа в твердом состоянии.
Неполное совпадение второй снизу критической точки на кривой охлаждения с аналогичной точкой на кривой нагрева указывает на склонность железа к переохлаждению (гистерезису) при переходе через эту критическую точку.

Обозначая различные модификации железа соответствующими буквами греческого алфавита, имеем: 1) a-Fe—при нагреве до 910°; y-Fe — от 910 до - 1390° и б-Fe — от 1390 до 1539°; 2) б-Fe — при охлаждении в интервале температур от 1539 до 1390°; y-Fe — от 1390 до 906°; a-Fe— от 906° и ниже. При 770° железо претерпевает магнитное превращение.
Критические точки на кривых охлаждения и нагрева железа принято обозначать буквой А с индексом r, если точка находится на кривой охлаждения, и с индексом с на кривой нагрева; кроме того, при r и с ставится цифра, указывающая положение рассматриваемой точки на кривой.

При охлаждении температура перехода от б к у обозначается точкой Ar4, от y к а — Ar3, при нагревании от а к у —- Ac3, от у к б — Aс4; при магнитном превращении явление гистерезиса не имеет места, поэтому соответствующая температура обозначается просто A2.
Точки Ar1 и Ac4 отсутствуют на кривых охлаждения и нагрева чистого железа; они появляются на кривых охлаждения и нагрева различных сплавов железа с углеродом и соответствуют равновесной температуре 723°
Железо в модификациях y и б, а также а выше 770° не обладает ферромагнитными свойствами. Железо модификации у способно к образованию твердых растворов с углеродом; a-Fe и б-Fe обладают этой способностью в весьма слабой степени. Все модификации железа способны к образованию твердых растворов с Mn, Si, Cr, W, Mo, V, Ni, Al, P.

Твердый раствор на основе a-Fe носит название феррит, твердый раствор на основе y-Fe принято называть аустенитом.
Модификации а- и б-железо имеют одинаковую пространственную кристаллическую решетку — пространственно - центрированный куб, у-Fe имеет решетку гранецентрированного куба. На фиг. 86 представлена микрофотография шлифа чистого железа (структура феррита). Для сплавов железа с углеродом кривые охлаждения и нагрева будут иметь уже другой вид.
Так, например, для сплава, содержащего 4,3% С, кривая охлаждения будет иметь вид, представленный на фиг. 87, для сплава, содержащего 0,83% С, — вид, представленный на фиг, 88, и т. д. Анализ этих кривых дается ниже.
Читайте также:

