Кристаллическое состояние вещества кратко
Обновлено: 08.07.2024
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка


Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
В газообразном состоянии молекулы вещества находятся на достаточно большом расстоянии друг от друга и занимают небольшой объем вещества. В газообразном состоянии молекулы или атомы, составляющие газ, практически не взаимодействуют между собой. Структура газообразных веществ не упорядочена.
При конденсации газообразных веществ образуются жидкие вещества. В жидком состоянии расстояние между молекулами значительно меньше, и основную часть объема вещества занимают молекулы, соприкасаясь друг с другом и притягиваясь друг к другу. Т.е. в жидком состоянии наблюдается некоторая упорядоченность частиц, соблюдается ближний порядок.
В твердом состоянии частицы настолько сближены друг с другом, что между ними возникают прочные связи, практически отсутствует движение частиц относительно друг друга. Существует высокая упорядоченность структуры. Твердые вещества могут находиться в аморфном и кристаллическом состоянии.
Аморфные вещества не имеют упорядоченной структуры, подобно жидкостям у них наблюдается только близкий порядок (стеклообразное состояние). Аморфные вещества обладают текучестью. Полимеры, смолы, аморфный кремний, аморфный селен, мелкодисперсное серебро, аморфный оксид кремния, германия, некоторые сульфаты, карбонаты находятся в аморфном состоянии. Аморфные вещества изотропны, т.е. физические свойства вещества распространяются одинаково в разные стороны, и они не имеют строго определенной точки плавления, они плавятся в каком-то интервале температур. Но подавляющее число твердых тел - кристаллические вещества.
Кристаллические вещества характеризуются дальним порядком, т.е. трехмерной периодичностью структуры по всему объему. Регулярное расположение частиц изображается в виде кристаллических решеток, в узлах которых расположены частицы, образующие твердое вещество. Соединяются они воображаемыми линиями.
Идеальные монокристаллы обладают:
- анизотропностью – т.е. в различных направлениях по объему кристалла физические свойства различны.
- определенной температурой плавления.
- кристаллические вещества характеризуются энергией кристаллической решетки, это та энергия, которую нужно затратить на то, чтобы разрушить кристаллическую решетку и удалить частицы за пределы взаимодействия.
- постоянная кристаллической решетки характеризует расстояние между частицами в кристаллической решетке, а также узлы между гранями кристаллической решетки.
- координационное число кристаллической решетки – это число частиц, непосредственно примыкающих к данной частице.
Наименьшей структурной единицей является элементарная ячейка. Имеется семь типов кристаллических решеток: кубическая, тетраэдрическая, гексагональная, ромбоэдрическая, орторомбоэдрическая, моноклинная и триклинная.
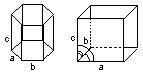 |
Они отличаются между собой углами между осями (a, b, g) и постоянными кристаллической решетки (a,b,c).
Существуют различные вещества, которые кристаллизуются в одинаковых кристаллических решетках – изоморфные вещества.
По типу частиц в узлах кристаллической решетки кристаллы бывают: молекулярные, атомно – ковалентные, ионные, металлические и смешанные.
1). Молекулярные кристаллы: в узлах находятся молекулы, между которыми существуют вандерваальсовы взаимодействия или водородная связь. Веществ с молекулярной решеткой очень мало. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические вещества. Например, структура льда:
Молекулярные кристаллы обладают небольшими координационными числами. и невысокой плотностью.
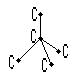
2). Атомно – ковалентные кристаллы: в узлах находятся атомы, которые связаны между собой ковалентными связями.
Пример: Атомно – ковалентный кристалл – алмаз, где атомы углерода (sp 3 – гибридизация) находятся в кристаллической решетке. Координационное число тоже небольшое (к.ч. = 4).
 |
3). Ионные кристаллы: в узлах находятся ионы, которые удерживаются друг около друга за счет электростатического взаимодействия. К соединениям с ионной связью относится большинство солей и небольшое число оксидов. Ионные соединения имеют сравнительно высокие температуры плавления. В связи с тем, что ионная связь ненасыщенна и ненаправленна, ионная решетка характеризуется высокими координационными числами (6,8).

4). Существуют металлические кристаллы. Металлические решетки образуют простые вещества большинства элементов периодической системы – металлы. По прочности металлические решетки находятся между атомными и молекулярными кристаллическими решетками.
5). В природе часто встречаются смешанные кристаллы, в которых взаимодействие осуществляется как ковалентными, так и вандерваальсовыми взаимодействиями, например, графит:
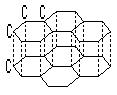 |
В слоях ковалентная связь (sp 2 -гибридтзация атома углергда), между слоями – вандерваальсово взаимодействие.
Некоторые вещества могут кристаллизоваться в различные кристаллические решетки. Это явление называется полиморфизм (примером являются: углерод, алмаз и графит) или аллотропия.
В газообразном состоянии молекулы вещества находятся на достаточно большом расстоянии друг от друга и занимают небольшой объем вещества. В газообразном состоянии молекулы или атомы, составляющие газ, практически не взаимодействуют между собой. Структура газообразных веществ не упорядочена.
При конденсации газообразных веществ образуются жидкие вещества. В жидком состоянии расстояние между молекулами значительно меньше, и основную часть объема вещества занимают молекулы, соприкасаясь друг с другом и притягиваясь друг к другу. Т.е. в жидком состоянии наблюдается некоторая упорядоченность частиц, соблюдается ближний порядок.
В твердом состоянии частицы настолько сближены друг с другом, что между ними возникают прочные связи, практически отсутствует движение частиц относительно друг друга. Существует высокая упорядоченность структуры. Твердые вещества могут находиться в аморфном и кристаллическом состоянии.
Аморфные вещества не имеют упорядоченной структуры, подобно жидкостям у них наблюдается только близкий порядок (стеклообразное состояние). Аморфные вещества обладают текучестью. Полимеры, смолы, аморфный кремний, аморфный селен, мелкодисперсное серебро, аморфный оксид кремния, германия, некоторые сульфаты, карбонаты находятся в аморфном состоянии. Аморфные вещества изотропны, т.е. физические свойства вещества распространяются одинаково в разные стороны, и они не имеют строго определенной точки плавления, они плавятся в каком-то интервале температур. Но подавляющее число твердых тел - кристаллические вещества.
Кристаллические вещества характеризуются дальним порядком, т.е. трехмерной периодичностью структуры по всему объему. Регулярное расположение частиц изображается в виде кристаллических решеток, в узлах которых расположены частицы, образующие твердое вещество. Соединяются они воображаемыми линиями.
Идеальные монокристаллы обладают:
- анизотропностью – т.е. в различных направлениях по объему кристалла физические свойства различны.
- определенной температурой плавления.
- кристаллические вещества характеризуются энергией кристаллической решетки, это та энергия, которую нужно затратить на то, чтобы разрушить кристаллическую решетку и удалить частицы за пределы взаимодействия.
- постоянная кристаллической решетки характеризует расстояние между частицами в кристаллической решетке, а также узлы между гранями кристаллической решетки.
- координационное число кристаллической решетки – это число частиц, непосредственно примыкающих к данной частице.
Наименьшей структурной единицей является элементарная ячейка. Имеется семь типов кристаллических решеток: кубическая, тетраэдрическая, гексагональная, ромбоэдрическая, орторомбоэдрическая, моноклинная и триклинная.
 |
Они отличаются между собой углами между осями (a, b, g) и постоянными кристаллической решетки (a,b,c).
Существуют различные вещества, которые кристаллизуются в одинаковых кристаллических решетках – изоморфные вещества.
По типу частиц в узлах кристаллической решетки кристаллы бывают: молекулярные, атомно – ковалентные, ионные, металлические и смешанные.
1). Молекулярные кристаллы: в узлах находятся молекулы, между которыми существуют вандерваальсовы взаимодействия или водородная связь. Веществ с молекулярной решеткой очень мало. К ним принадлежат неметаллы, за исключением углерода и кремния, все органические соединения с неионной связью и многие неорганические вещества. Например, структура льда:
Молекулярные кристаллы обладают небольшими координационными числами. и невысокой плотностью.
2). Атомно – ковалентные кристаллы: в узлах находятся атомы, которые связаны между собой ковалентными связями.
Пример: Атомно – ковалентный кристалл – алмаз, где атомы углерода (sp 3 – гибридизация) находятся в кристаллической решетке. Координационное число тоже небольшое (к.ч. = 4).
 |
3). Ионные кристаллы: в узлах находятся ионы, которые удерживаются друг около друга за счет электростатического взаимодействия. К соединениям с ионной связью относится большинство солей и небольшое число оксидов. Ионные соединения имеют сравнительно высокие температуры плавления. В связи с тем, что ионная связь ненасыщенна и ненаправленна, ионная решетка характеризуется высокими координационными числами (6,8).
4). Существуют металлические кристаллы. Металлические решетки образуют простые вещества большинства элементов периодической системы – металлы. По прочности металлические решетки находятся между атомными и молекулярными кристаллическими решетками.
5). В природе часто встречаются смешанные кристаллы, в которых взаимодействие осуществляется как ковалентными, так и вандерваальсовыми взаимодействиями, например, графит:
 |
В слоях ковалентная связь (sp 2 -гибридтзация атома углергда), между слоями – вандерваальсово взаимодействие.
Некоторые вещества могут кристаллизоваться в различные кристаллические решетки. Это явление называется полиморфизм (примером являются: углерод, алмаз и графит) или аллотропия.
Вы уже знакомы с разным агрегатным состоянием веществ: газообразным, жидким, твердым, а также переходами их из одного состояния в другое.
В твердом состоянии большинство веществ имеют кристаллическую структуру.
Для них характерна плотная упаковка их частиц в кристалле, эти частицы упорядочены.
Структура кристаллов разнообразна, но все они геометрически правильной формы.
Например, кристаллы поваренной соли имеют форму куба, горного хрусталя – форму тетраэдра, калийной селитры – призмы.

Кристаллами называют твердые тела с закономерным расположением в них частиц: атомов, молекул, ионов.
Внутреннее строение кристаллов характеризует их кристаллическая решетка – взаимное расположение атомов.

Кристаллическая решетка – это модель кристалла, его внутренний каркас.
Пересекающиеся прямые линии обозначают грани кристалла, а точки их пересечения – центры частиц, которые называются узлами кристаллической решетки.
В узлах расположены атомы, молекулы или ионы, стянутые в кристалл химическими связями.
Силы притяжения частиц в кристалле характеризуют энергию кристаллической решетки (обычно её измеряют в кДж/моль).
Любая кристаллическая решетка построена из повторяющихся одинаковых структурных единиц, индивидуальных для каждого кристалла.
Таковые называются элементарными ячейками.
Например, в кристалле хлорида натрия каждый ион окружен шестью ионами противоположного знака.

Элементарная ячейка – это предел делимости кристалла, наименьший его объем, при котором он сохраняет форму и свойства.
Пройти тест и получить оценку можно после входа или регистрации
Типы кристаллических решеток
Кристаллические решётки бывают:
Остановимся на характеристике основных типов кристаллических решеток и установим зависимость от них свойств веществ.
Молекулярные кристаллические решетки– это решетки, в узлах которых расположены молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия.
С помощь сухого льда кулинары делают забавные представления, ведь он совершенно безопасен для здоровья!

Рассмотрим модель его кристаллической решетки.
В ее узлах находятся молекулы.

Многие вещества в твердом состоянии имеют молекулярную кристаллическую решетку, особенно органические (например, белки, углеводы, полимеры).
Атомы в их молекулах связаны прочными ковалентными связями.
Молекулы же в кристаллах стянуты слабыми межмолекулярными силами, которые легко разорвать.
Поэтому кристаллы с молекулярной решеткой обладают малой твердостью, легкоплавкие, летучие.
Молекулярные вещества легко переходят из одного агрегатного состояния в другое.
Примером может служить сублимация йода.
Сублимация – возгонка, переход из твердого состояния не в жидкое, а сразу в газообразное.
Йод – это твёрдый (при нормальных условиях) неметалл темно-фиолетового цвета.
При нагревании йод не плавится, а возгоняется: сразу переходит в газообразное состояние.

У меня есть дополнительная информация к этой части урока!

Тот же эффект можно наблюдать и с сухим льдом. Если положить на стол кусочек сухого льда, то он не плавится, а сразу же испаряется (то есть переходит в газообразное состояние).
Интересно то, что он при этом начинает бегать по поверхности. Происходит это потому, что между кристаллом и столом образуется слой углекислого газа, который и толкает этот кристалл в разные стороны.
Атомные кристаллические решетки – решетки, в которых расположены атомы, стянутые в кристалле прочными ковалентными связями.
Атомных кристаллов сравнительно немного.
Примерами таких твердых веществ служат как простые вещества: алмаз, кремний; так и сложные вещества: карбид кальция, сульфид цинка, диоксид кремния и др.
Так, например, кристалл алмаза имеет форму тетраэдра.
Следовательно, структурную его единицу представляет тетраэдр.
В центре его ячейки расположен атом углерода, прочно связанный с четырьмя другими атомами углерода с помощью электронных пар.
Все связи одинаковы, как и углы, образующиеся между атомами.

Именно благодаря ковалентным связям атомные кристаллы имеют высокую твёрдость и температуру плавления.
Именно тот факт, что в алмазе каждый атом связан четырьмя ковалентными связями, и объясняет столь высокую его твёрдость.
Ионные кристаллические решетки – это решетки, в узлах которых расположены ионы с противоположными зарядами.
Связь между ионами осуществляется за счет электростатических сил притяжения.
Типичный представитель веществ с такой решеткой – поваренная соль (схематичное изображение решетки поваренной соли есть выше в этом уроке).
Ионные кристаллические решетки характерны для многих соединений с ионной связью. Это соли щелочных и щелочно-земельных металлов, щёлочи.
Ионные кристаллы отличаются высокой твердостью и температурой плавления, малой летучестью. По физическим свойствам они сходны с атомными кристаллами.
Металлические кристаллические решетки присущи простым веществам – металлам. Подробно они будут рассмотрены позже.
Многие простые и сложные вещества имеют кристаллическую структуру.
Для них характерны закономерное расположение частиц в трехмерном пространстве и строгая правильная геометрическая форма кристаллов. Свойства таких веществ зависят не только от строения образующих их атомов и характера их химической связи, но и от кристаллической структуры веществ.

У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.

Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.

Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это жидкость. В жидком состоянии вещества его молекулы и атомы имеют более прочные связи, которые сложнее разорвать.
Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.

Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
неспособность к растворению в воде,
высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC. Типичный представитель этой группы — обычный песок, который по сути является оксидом кремния SiO2.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.

Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).

Свойства молекулярных веществ:
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).

Ионная кристаллическая решетка
Как известно, в ходе ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
способность растворяться в воде.
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.

Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.

Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Частицы в узлах решетки
Тип связи между частицами
Физические свойства веществ
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.
Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ вещества, характеризуется наличием дальнего порядка в расположении частиц (атомов, ионов, молекул). В К. с. существует и ближний порядок, к-рый характеризуется постоянными координац. числами, валентными углами и длинами хим. связей. Инвариантность характеристик ближнего порядка в К. с. приводит к совпадению структурных ячеек при их трансляционном перемещении и образованию трехмерной периодичности структуры (см. Кристаллохимия. Кристаллы). Вследствие своей макс. упорядоченности К. с. в-ва характеризуется миним. внутр. энергией и является термодинамически равновесным состоянием при данных параметрах -давлении, т-ре, составе (в случае твердых растворов) и др. Строго говоря, полностью упорядоченное К. с. реально не м. б. осуществлено, приближение к нему имеет место при стремлении т-ры к О К (т. наз. идеальный кристалл). Реальные тела в К. с. всегда содержат нек-рое кол-во дефектов, нарушающих как ближний, так и дальний порядок. Особенно много дефектов наблюдается в твердых р-рах, в к-рых отдельные частицы и их группировки статистически занимают разл. положения в пространстве. Вследствие трехмерной периодичности атомного строения основными признаками кристаллов являются однородность и анизотропия св-в и симметрия, к-рая выражается, в частности, в том, что при определенных условиях образования кристаллы приобретают форму многогранников (см. Монокристаллов выращивание). Нек-рые св-ва в-ва на пов-сти кристалла и вблизи от нее существенно отличны от этих св-в внутри кристалла, в частности из-за нарушения симметрии. Состав и, соотв., св-ва меняются по объему кристалла из-за неизбежного изменения состава среды по мере роста кристалла. Т. обр., однородность св-в так же, как и наличие дальнего порядка, относится к характеристикам "идеального" К. с. Большинство тел в К. с. является поликристаллическими и представляет собой сростки большого числа мелких кристаллитов (зерен) - участков размером порядка 10 -1 -10 -3 мм, неправильной формы и различно ориентированных. Зерна отделены друг от друга межкристаллитными слоями, в к-рых нарушен порядок расположения частиц. В межкристаллитных слоях происходит также концснтрирование примесей в процессе кристаллизации. Из-за случайной ориентации зерен поликристаллич. тело в целом (объем, содержащий достаточно много зерен) м. б. изотропным, напр. полученное при осаждении кристаллич. порошков с послед. спеканием. Однако обычно в процессе кристаллизации и особенно пластич. деформации возникает текстура -преимуществ, ориентация кристаллич. зерен в определенном направлении, приводящая к анизотропии св-в. На диаграмме состояния однокомпонентной системы вследствие полиморфизма К. с. может отвечать неск. полей, расположенных в области сравнительно низких т-р и повыш. давлений. Если имеется лишь одно поле К. с. и в-во химически не разлагается при повышении т-ры, то поле К. с. граничит с полями жидкости и газа по линиям плавления кристаллизации и возгонки - конденсации соотв., причем жидкость и газ (пар) могут находиться в метастабильном (переохлажденном) состоянии в поле К. с., тогда как К. с. не может находиться в поле жидкости или пара, т. е. кристаллич. в-во нельзя перегреть выше т-ры плавления или возгонки. Нек-рые в-ва (мезогены) при нагреве переходят в жидкокристаллич. состояние (см. Жидкие кристаллы). Если на диаграмме однокомпонентной системы имеются два и более полей К. с., эти поля граничат по линии полиморфных превращений. Кристаллич. в-во можно перегреть или переохладить ниже т-ры полиморфного превращения. В этом случае рассматриваемое К. с. в-ва может находиться в поле др. кристаллич. модификации и является метастабильным. В то время как жидкость и пар благодаря существованию критич. точки на линии испарения можно непрерывно перевести друг в друга, вопрос о возможности непрерывного взаимного превращ. К. с. и жидкости окончательно не решен. Для нек-рых в-в можно оценить критич. параметры -давление и т-ру, при к-рых DH пл и DV пл равны нулю, т. е. К. с. и жидкость термодинамически неразличимы. Но реально такое превращ. не наблюдалось ни для одного в-ва (см. Критическое состояние). В-во из К. с. можно перевести в неупорядоченное состояние (аморфное или стеклообразное), не отвечающее минимуму своб. энергии, не только изменением параметров состояния (давления, т-ры, состава), но и воздействием ионизирующего излучения или тонким измельчением. Критич. размер частиц, при к-ром уже не имеет смысла говорить о К. с., примерно 1 нм, т. е. того же порядка, что и размер элементарной ячейки. К. с. отличают обычно от др. разновидностей твердого состояния (стеклообразного, аморфного) по рентгенограммам в-ва. Лит.: Шаскольская М. П., Кристаллография, М., 1976; Современная кристаллография, под ред. Б. К. Вайнштeйна. т. I. М., 1979. П. И. Федоров.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ" в других словарях:
кристаллическое состояние — kristalinė būsena statusas T sritis chemija apibrėžtis Būsena, kai medžiagos dalelės (atomai, jonai, molekulės) išsidėsčiusios taisyklinga, visomis kryptimis periodiškai pasikartojančia tvarka. atitikmenys: angl. crystalline state rus.… … Chemijos terminų aiškinamasis žodynas
кристаллическое состояние — kristalinė būsena statusas T sritis fizika atitikmenys: angl. crystalline state vok. kristalliner Zustand, m rus. кристаллическое состояние, n pranc. état cristallin, m … Fizikos terminų žodynas
КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ — правильное, закономерное расположение частиц (атомов, молекул) в пространстве, образующее кристаллическую решетку … Металлургический словарь
КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ ПОЛИМЕРОВ — характеризуется тем, что звенья макромолекул образуют структуры с трехмерным дальним порядком. Размер этих структур не превышает неск. мкм; обычно их называют кристаллитами. В отличие от низкомол. в в, полимеры никогда не кристаллизуются нацело,… … Химическая энциклопедия
перешедший в кристаллическое состояние — прил., кол во синонимов: 1 • закристаллизовавшийся (2) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
СОСТОЯНИЕ КРИСТАЛЛИЧЕСКОЕ — состояние вещества, когда слагающие его частицы (атомы, ионы, молекулы) занимают строго фиксированные положения по геометрическим законам пространственных гр. и соответственных решеток. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией … Геологическая энциклопедия
СОСТОЯНИЕ — (1) аморфное (рентгеноаморфное) состояние твёрдого вещества, в котором нет кристаллической структуры (атомы и молекулы расположены беспорядочно), оно изотропно, т. е. имеет одинаковые физ. свойства по всем направлениям и не имеет чёткой… … Большая политехническая энциклопедия
Стеклообразное состояние — У этого термина существуют и другие значения, см. Стекло (значения). Основная статья: Стекло Стеклообразное состояние твёрдое аморфное метастабильное состояние вещества, в котором нет выраженной кристаллической решётки, условные элементы… … Википедия
Аморфное состояние — (от греч. а отрицательная частица и morphē форма) твёрдое состояние вещества, обладающее двумя особенностями: его свойства (механические, тепловые, электрические и т. д.) в естественных условиях не зависят от направления в веществе… … Большая советская энциклопедия
Читайте также:

