Кратная связь это в химии кратко
Обновлено: 06.07.2024
Химическая связь – электрические силы притяжения, которые удерживают частицы друг около друга. В образовании химической связи могут участвовать атомы, ионы или молекулы. Атомы химических элементов, имеющих незавершённый внешний уровень, неустойчивы и стремятся его завершить. В процессе химических реакций осуществляется завершение внешних уровней, что достигается либо отдачей электронов (у металлов), либо присоединением (у неметаллов), а также образованием общих электронных пар. Различают несколько типов химических связей:
1.Ковалентная связьосуществляется за счёт образования общих электронных пар, связывающих ядра атомов. Ковалентная связь образуется между атомами неметаллов.
Ковалентная неполярная связь образуется между атомами с одинаковой электроотрицательностью (в простых веществах – неметаллах):
Н◦ + ◦Н → Н◦◦Н (или Н—Н)
Общие электронные пары в равной степени принадлежат обоим атомам.
2.Ковалентная полярная связь образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.

Атом хлора имеет большую электроотрицательность, чем атом водорода, поэтому общая электронная пара смещена в его сторону. Соответственно возникнут заряды: на атоме хлора - отрицательный, на атоме водорода – положительный. Такая связь называется полярной. (Примеры: Н2О, H2S, CH3Cl)
3. Ионная связь. Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).

Атом натрия полностью отдаёт один электрон, а атом хлора его принимает, образуются ионы, которые притягиваются друг к другу и образуют ионную кристаллическую решётку:

Ионная связь характерна для щелочей, солей, оксидов типичных металлов.
Простые и кратные связи
Если атомы связаны между собой одной общей электронной парой, то возникает одна ковалентная связь, которая называется простой, одинарной или σ-связью. Это основной вид связи, он существует во всех молекулах: Н-Н; Br-Br; CH3-CH3
σ-связи – это ковалентные связи, при образовании которых перекрывание электронных облаков осуществляется вдоль линии связи, соединяющей центры атомов.
Двойные и тройные связи имеют общее название: кратные связи.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей центры атомов.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Любая двойная связь состоит из одной σ-связи и одной π-связи: СН2=СН2; О=О.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Любая тройная связь состоит из одной σ-связи и двух
π-связей: СН≡СН; N≡N.


4. Аллотропия неорганических веществ на примере углерода и кислорода.
Аллотропия - способность химических элементов существовать в виде нескольких простых веществ.
Аллотропные видоизменения кислорода.
Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким запахом.
Озон можно получить при пропускании электрического тока через кислород: 3О2→2О3
В природе озон образуется во время грозы.
Озон — неустойчивое вещество, взрывается при ударе, легко распадается при обычной температуре с отщеплением атомарного кислорода: О3→О2+О
Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи.
Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
s-Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Число общих электронных пар между связанными атомами характеризует кратность связи.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойнойсвязью. Любая двойная связь состоит из одной σ-связи и одной π-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройнойсвязью. Любая тройная связь состоит из одной σ-связи и двух π-связей.
Двойные и тройные связи имеют общее название: кратные связи.
2. Непредельные углеводороды. Этиленовые углеводороды (Алкены) CnH2n
Алкены – это нециклические угдеводороды, в молекулах, которых два атома углерода находятся в состоянии sp 2 -гиридизации и связаны друг с другом двойной связью.

Строение молекулы этилена C2H4


SP 2 -гибридизация, валентный угол = 120
l = 0,134 нм (длина связи)
В молекулах этилена между атомами углерода двойная связь π и σ. σ-связь образуется гибридными облаками. σ-связь образована p-электронами (непрочная связь).
Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи.
Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью.
π-Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
s-Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков.
π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары.
Число общих электронных пар между связанными атомами характеризует кратность связи.
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойнойсвязью. Любая двойная связь состоит из одной σ-связи и одной π-связи.
Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройнойсвязью. Любая тройная связь состоит из одной σ-связи и двух π-связей.
Двойные и тройные связи имеют общее название: кратные связи.
2. Непредельные углеводороды. Этиленовые углеводороды (Алкены) CnH2n
Алкены – это нециклические угдеводороды, в молекулах, которых два атома углерода находятся в состоянии sp 2 -гиридизации и связаны друг с другом двойной связью.

Строение молекулы этилена C2H4


SP 2 -гибридизация, валентный угол = 120
l = 0,134 нм (длина связи)
В молекулах этилена между атомами углерода двойная связь π и σ. σ-связь образуется гибридными облаками. σ-связь образована p-электронами (непрочная связь).
КРАТНЫЕ СВЯЗИ
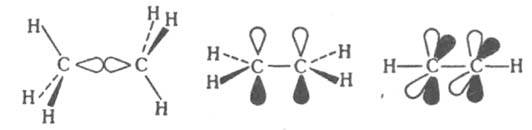
КРАТНЫЕ СВЯЗИ, хим. связи двухцентрового типа, к-рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих кратные связи, различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов кратные связи сопоставляются с мол. орбиталями, к-рые по св-вам симметрии делят на s -, p - и d -орбитали. p -Орбитали антисимметричны относительно плоскости, проходящей через связь. В многоатомных молекулах эта плоскость является общей для всей молекулы или для мол. фрагмента, включающего эту связь. d -Орбитали антисимметричны относительно двух взаимно перпендикулярных плоскостей, проходящих через связь. При образовании кратных связей возникает, как правило, одна (или более) s -орбиталь и обязательно хотя бы одна p - или d -орбиталь. По этой причине составляющие кратных связей, определяемые p - или d -орбиталями, наз. соотв. p - или d -связями. Атомы непереходных элементов в молекулах и ионах м. б. связаны простой, двойной и тройной связями. Образование простой d -связи С—С в молекуле этана соотносят с перекрыванием двух sp 3 -гибридных орбиталей атомов углерода. В молекуле этилена кроме s -связи С—С присутствует одна, а в молекуле ацетилена с тройной связью - две p -связи:
Четверная связь (и м. б. связи более высокой кратности) характерна только для переходных металлов. d -Перскрываниe ведет к образованию четверных связей в солях октагалогеиодиренат-аниона Re 2 Hal 8 2- , карбоксилатах молибдена и вольфрама M(OOCR) 4 , внутрикомплексных соед. хрома и ванадия М 2 А 2 , где А - 2,6-диметоксифенил. Энергетич. вклады, приходящиеся на связи разл. типов, неравноценны. Обычно энергия p -связи составляет в среднем около 80% энергии s -связи, а вклад d -связи оценивается, напр., в солях октахлородиренат-аниона всего в 14% от полной энергии связи. Чем выше кратность связи, тем больше ее прочность (энергия диссоциации), короче межатомное расстояние и больше силовая постоянная связи (см. табл.).
что это вообще?Объясните нормальным русским языком,а то в учебнике нихрена неясно,потому что афторы сами ничё не знают,просто пишут определения!
Кратная связь - это двойная или тройная связь между атомами углерода; двойная связь имеет место также в карбонильной группе -С=О или между атомами углерода и азота - С=N; тройная связь имеет место в нитрилах - между атомами углерода и азота.
В кратной связи одна из связей между атомами - это обязательно сигма-связь (максимум электронной плотности двух перекрывающихся орбиталей лежит на условной прямой, соединяющей центры ядер атомов; может быть образована s- и р-орбиталями: s-s, s-p, p-p).
Вторая связь (а в тройной связи - 2 другие связи) - это пи-связь (образована всегда р-орбиталями, которые перекрываются в плоскости, перпендикулярной плоскости молекулы - боковое перекрывание орбиталей) . Максимальная электронная плотность расположена по обе стороны условной прямой, соединяющей центры ядер атомов. π-связь менее прочная (т. к. область перекрывания меньше) и более реакционноспособная. Она образуется только тогда, когда в молекуле уже есть σ-связь. Она препятствует свободному вращению атомов в пространстве.
Читайте также:

