Клонирование в медицине кратко
Обновлено: 05.07.2024
Пересадка ядра при генетических болезнях. Терапевтическое клонирование
Пересаженные клетки сохраняют генотип донора, поэтому пересадку можно рассматривать как форму генотерапии, поскольку она приводит к изменению соматического генома.
Для использования трансплантации при лечении генетических болезней существуют два основных показания. Во-первых, клетки или органы могут пересаживаться с целью введения копии генов дикого типа пациенту с мутациями.
Это показание имеет интересное следствие, что иногда приходится удалять полностью нормальный орган, поскольку его биохимическая дисфункция повреждает другие ткани. Так происходит, например, при гомозиготной семейной гиперхолестеринемии, при которой эффективна пересадка печени, но она относится к процедурам высокого риска.
По мере накопления опыта с частичной пересадкой трансплантации целого органа, выполняемые по этим показаниям, должны становиться более редкими. Второе и более частое показание — пересадка клеток с целью компенсации органа, повреждаемого генетической болезнью (например, цирротической печени при недостаточности а1-антитрипсина).
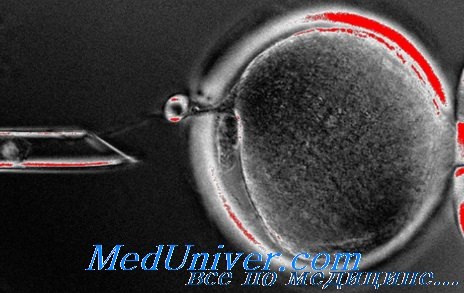
Пересадка ядра при генетических болезнях
Пересадка ядер (также называемая переносом ядра или ядерным клонированим) — новая технология, имеющая большой потенциал для регенеративной медицины, также вызывает огромную дискуссию из-за пугающих этических проблем, связанных с ее использованием.
Пересадка ядра — перенос диплоидного ядра из соматической клетки, например, фибробласта кожи взрослого донора в цитоплазму овоцита (т.е. овоцита, собственное ядро которого предварительно удалено), с целью получения клонированного эмбриона.
Терапевтическое клонирование — использование эмбриональных стволовых клеток с пересаженным ядром для формирования различных типов клеток организма в культуре. Поскольку клетки, полученные при этой технике, генетически идентичны ядру донора, они могли бы использоваться для пересадки полученных клеток донору без опасения иммунной реакции.
Тем не менее в настоящее время применение данной технологии встречает множество трудностей. Во-первых, есть серьезные биологические ограничения, включая то, что экспрессия генов в клонированных клетках, как правило, значительно нарушена. Во-вторых, использование эмбрионов человека для терапевтического клонирования, независимо от возможных терапевтических преимуществ, отвергаются по многочисленным причинам этического характера.
В отличие от терапевтического, репродуктивное клонирование имеет отношение к процессу реимплантации эмбриона, полученного при пересадке ядра, в матку суррогатной матери, с целью позволить эмбриону развиться в клон человека-донора, ядро соматической клетки которого было использовано. Репродуктивное клонирование запрещено во всех странах из-за сложных этических вопросов, связанных с созданием клонов человека.
Видео генетика клонирования ДНК
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Рязанова А.П. и Погорелова А.С.
Научный руководитель – к.и.н. Суворов В.В.
ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России
Кафедра философии, гуманитарных наук и психологии.
Резюме
Проблема клонирования широко обсуждается в современном научном обществе. Все по разному представляют себе этот процесс. В данной статье мы рассмотрели все плюсы и минусы данной проблемы. Провели социологический опрос по данной проблеме.
Ключевые слова
Статья
Актуальность проблемы. Проблема клонирования в современном мире занимает огромное место, вызывает множество споров среди ученых.
Цель работы. Сравнить разные точки зрения и все плюсы, и минусы клонирования.
Материалом для исследования послужили данные, которые собирались годами и обрабатывались, и результаты собственного исследования.
Исследование генома человека не только открыло широкие перспективы развития биотехнологий и лечения различных заболеваний, но и сделали возможным изменение самой сущности человека, породив тем самым множество вопросов этического характера. Достижения генетики кажутся настолько невероятными и фантастическими, а порой даже шокирующими, что современный человек все чаще задается вопросом: "Имеем ли мы право изменять то, что создано природой? Где та грань, которую нельзя переступать?"
В 1997 году весь мир облетела новость о невероятном научном прорыве в молекулярной генетике: шведскому ученому Яну Уилмуту удалось создать первый в истории клон. Это была овца Долли, ставшая впоследствии самым известным животным в истории науки. Она прожила 6 лет, а затем в 2003 умерла от опухоли легких.
Попытки создать настоящего клона предпринимались еще с 70-ых годов прошлого века, но настоящего успеха Ян Уилмут и его команда добились, пересадив ядро соматической клетки в цитоплазму яйцеклетки. В результате получилась точная копия исходного животного, причем животное было совершенно здорово, и его репродуктивная функция не была нарушена (овечка Долли оставила после себя 6 ягнят)[2].
Данное открытие не получила широкого распространения, все дальнейшие опыты проводились исключительно на других животных: коровах, собаках, мышах. Использованию человека во всех опытах по клонированию препятствовали не только многочисленные запреты правительства, но и религиозные предписания, и общественные нормы морали. Но на сегодняшний день не исключена возможность появления клонированных людей.
На сегодняшний день не разработана единая технология клонирования людей. Не существует именно такой технологии, которая позволила бы в точности повторить и анатомо-физиологические, и психические особенности человека. Именно это осуществить крайне сложно, поскольку каждый человек индивидуален, уникальны его умственные и физические возможности. С другой стороны, человек имеет право на свою непохожесть, неповторимость, поэтому создавая совершенно идентичных людей, человечество обрекает себя на безликую жизнь и уничтожает саму вероятность дальнейшего развития цивилизации[1].
Сейчас многие государственные органы пытаются отвлечь ученых от дальнейших шагов в этой области, вводя законодательные запреты, аргументируя это несостоятельностью и неэкономичностью клонирования. Можно найти множество недостатков клонирования, среди которых:
Ø Прежде всего, сама идея иметь двойника противоестественна и она противоречит уникальности человека. Люди не имеют морального права создавать копии себе подобных. К каждому родившемуся ребенку необходимо относиться как к личности, а не копии другого человека.
Ø Так как в результате появляются генетически идентичные организмы, то клонирование может уничтожить потерю человеческой индивидуальности, а многократно повторяющиеся одни и те же комбинации генов могут привести к уменьшению резистентности к различным инфекциям и эпидемиям. В принципе, последнее предположение маловероятно, поскольку из-за высокой стоимости процедуры. Многие люди просто-напросто не захотят иметь своих клонов, о чем мы еще будем говорить и даже убедительно докажем это на примере небольшого опроса, проведенного по данной теме. Таким образом, сокращение генетического разнообразия наступит только в случае очень широкого распространения клонирования.
Ø Другое дело, если при процедуре могут случайно возникнуть нарушения в структуре ДНК, а это уже приведет к неконтролируемым метаморфозам человеческого организма, как в хорошую сторону, так и в плохую.
Ø Процедура клонирование не освобождается от угрозы смерти. Известно, что эксперименты, проводимые на начальных этапах изучения клонирования (те же самые овечки в Чехии) заканчивались смертельными исходами лабораторных животных.
Ø Все мировые религии считают явление клонирования противоестественным, ведь человек должен появляться согласно воле Бога и быть единственным носителем только ему одному присущих качеств, хотя во всех священных письменных источниках не содержится прямого указания на запрет клонирования[3].
Вместе со всем этим клонирование имеет ряд существенных плюсов, так попробуем же разобраться в них:
1.В первую очередь для клонирования открываются широкие перспективы в области медицины. Терапевтическое клонирование приводит к образованию стволовых клеток зародыша, которые идентичны клеткам донора. Их можно использовать при лечении многих заболеваний.
2. Репродуктивное клонирование создает клон донора. Это может помочь бесплодным парам родить ребенка – копию одного из родителей, но это, конечно же, сугубо личное дело каждой отдельной семьи, поскольку не все родители захотят видеть свою абсолютную копию в своем ребенке.
3. Произведение на свет детей с запланированным генотипом позволит множить гениальных людей в лабораторных условия. Но такое отношение будет крайне неэтично по отношению к клону, так как подразумевается, что он должен будет буквально отдать подаренную ему жизнь во имя науки[1].
Появление клонирование вызовет соответствующие изменения и в правовой сфере общества, потребует разработки Нормативно-правовых актов, регулирующих этот процесс.
2. Как и любая медицинская манипуляция, клонирование должно осуществляться только с письменного согласия человека, поскольку генетический код принадлежит только ему и никто не вправе использовать его без согласия индивида.
3. Кроме несовершенной технологии клонирования существуют и затруднения, связанные с вынашиванием плода. По сути, вынашивание должно осуществляться взрослой здоровой женщиной, опять-таки только с ее полного согласия. А вот искусственное выращивание плода должно быть запрещено, так как противоречит этическим нормам и правилам. Конкретный тому пример – вероятность выращивания человеческого эмбриона в теле свиньи, что является само по себе абсурдным и смешным.
Существуют различные преграды на пути к клонированию:
1. Не для всех людей приятна мысль, что существует их точная копия, хотя найдутся и такие, которым такое обстоятельство придется по нраву.
2. Многие религии не допускают создание клонов, так как считают, что люди не имеют право вмешиваться в естественный ход вещей и нарушать проявление Божьей воли.
3. Поиск технологии клонирования сопряжен с огромными финансовыми рисками, он требует значительных капиталовложение и инвестиций.
4. Существуют не только морально-этические аспекты, но и различные правовые документы, запрещающие клонирование
5. Существует высокая вероятность снижения видового разнообразия, что может привести к крайне неприятным последствиям[2].
Давайте представим себе будущее, в котором клонирование приобрело широкий размах. Клонированы знаменитые личности, гении науки, каждый человек создает подобного себе. Решены проблемы бесплодия, пересадки органов и другие немаловажные проблемы. Но так ли это хорошо, как кажется со стороны? Сколь ни совершенна была бы технология клонирование, человечеству придется столкнуться с совершенно иными людьми, так как клон не унаследует мыслей, характера, воспоминаний своего прототипа. Более того, клон может оказаться полной его противоположностью, которая привнесет в наш мир только беды и разрушения.
Да и не каждому человеку по душе будет постоянно видеть около себя или хотя бы знать о существовании своей абсолютной копии.
Но самое главное, что может произойти – это переоценка моральных ценностей человека, например семьи. Человеку больше не понадобятся такие чувства, как любовь и дружба, все больше людей будут склоняться в сторону свободной жизни вне семьи, необходимое продолжение рода они будут находить в своих клонах. А нет семьи, нет основополагающих человеческих чувств, следовательно, нет полноценного человеческого общества. Существует лишь общество бесконечных копий друг друга, утративших свою индивидуальность и способность любить.
Будет происходить застой не только в нравственной жизни, но и в научной и культурной жизни. Не будут появляться новые гении искусства, светила науки, не будут появляться новые открытия и изобретения.
Рассуждать о клонировании можно бесконечно, находя все новые и новые доводы в пользу данного явления и в его вред. Недаром все научное сообщество разделилось на два лагеря, отстаивающих ту или иную точку зрения. И нет единого, объединенного взгляда на эту проблему.
Чтобы более полно представить картину отношения людей к клонированию, мы решили провести опрос среди не большой группы.
Вопрос таков: Как вы относитесь к клонированию людей?
Варианты ответа таковы:
А - на это интересно посмотреть
Б - хочу иметь своего клона
В - не хочу иметь клона
Г - еще не задумавался(лась) об этом
Оказалось, что более половины респондентов не хотят видеть рядом своего клона. И только 3 % респондентов даже допускают возможность существования своего клона. Примерно 14% никогда не задумывались об этом. Есть и респонденты, которые живо интересуются данной проблемой (24%)
Данный опрос убедительно доказывает, что проблема существует в обществе, хоть и не обсуждается слишком часто, тем не менее, вызывает интерес со стороны общественности. В то же время мы видим, что даже если бы технология клонирования была бы усовершенствована, то не получила большого размаха. То есть современный человек прекрасно отдает себе отчет в последствиях появления себе подобного индивида. Что же касается нас, то мы являемся скорее противниками клонирования, нежели чем сторонниками, хотя и не отрицаем возможность применения элементов клонирования в современной медицине.
Заключение.
В заключении хотелось бы сказать, клонирование могло бы успешно развиваться, если бы не было запретов и различных отрицательных последствий. Для клонирования нужна мощная технологическая база, которой нет в мире пока что нигде. Одни ученые не перестают надеяться на чудо, что когда-нибудь в далеком будущем появиться такая база, и мы сможем создавать клонов. Другие считают, что клоны бесполезны и опасны. Но остается открытым, вопрос как воспримут это все люди, как воспримет это правительство.
В данном обзоре рассматриваются возможности использования в медицине метода репрограммирования взрослых стволовых клеток человека в плюрипотентные (пребывающие в состоянии неполной дифференцировки). Именно плюрипотентные стволовые клетки (ПСК) обладают способностью при дальнейшем их развитии преобразовываться в структурные компоненты любых органов и систем. Данные клетки не могут развиться в полноценный организм (эмбрион), что сразу же исключает этический барьер как тормозящий фактор в такого рода исследованиях. Метод индукции репрограммирования стволовых клеток (ИРСК) содержит в себе огромный потенциал для дальнейшего развития терапевтического клонирования как перспективного медицинского направления.

2. Masako Tada, Yousuke Takahama, Kuniya Abe, Norio Nakatsuji, Takashi Tada. (2001). Nuclear reprogramming of somatic cells by in vitro hybridization with ES cells. Current Biology. 11, 1553-1558;
4. Кузьмина Е.Ю. Получение индуцированных плюрипотентных стволовых клеток для геннотерапевтической модели мыши: выпускная квалификационная работа бакалавра. Санкт-Петербург, 2016. 51 с.
Введение. Современная медицина активно разрабатывает и внедряет в практику разнообразные биотехнологии, которые открывают возможности для более полной и точной диагностики и лечения патологических состояний, ранее недоступных для коррекции. Идея регенеративной терапии различных заболеваний с использованием стволовых клеток - одно из магистральных направлений медицинской науки. К перспективным технологиям в контексте данного направления относится терапевтическое клонирование.
Терапевтическое клонирование заключается в получении пациент-специфичных линий эмбриональных стволовых клеток (ЭСК), обладающих колоссальными возможностями в поддержании и восстановлении здоровья человека. С биологической точки зрения, терапевтическое клонирование – это то же репродуктивное клонирование, но с ограниченным (до 14 дней) сроком роста эмбриона. По прошествии обозначенного временного промежутка процесс размножения клеток приостанавливается. Название метода предопределено тем, что образующиеся в течение двух недель эмбриональные клетки способны в дальнейшем преобразоваться в дифференцированные клетки различных органов: сердца, печени, поджелудочной железы, почек и т.д. Этот факт благоприятствует использованию данного метода в медицине для терапии многих заболеваний [5].
Выделяя стволовые клетки из эмбриона, срок жизни которого не более 3 - 4 дней, их дальнейший алгоритм развития в лабораторных условиях можно спроектировать в любом направлении. В теории, стволовые клетки способны дать начало любой структуре тела человека, способной заместить патологически изменный фрагмент или даже орган. В том случае, если они получены из тканей, взятых у человека, которому выращивают трансплантат (аутотрансплантация), также решается проблема гистосовместимости при пересадке.
Технология искусственного получения эмбриональных стволовых клеток с помощью клонирования активно разрабатывается в комплексе с биохимическими направлениями по созданию специальных питательных сред для культивирования живых тканей.
При ПЯСК осуществляется перенос ядра, извлеченного из соматической клетки пациента, в цитоплазму энуклеированного ооцита, находящегося в метафазе второго деления мейоза. Как результат, развивающийся эмбрион будет генетической копией донора ядра. По достижении стадии бластоцисты, из ее клеточной массы выделяют клонированные ЭСК и производят исследования свойств полученных клеточных культур [1, с. 207].
Проведение экспериментов с использованием яйцеклеток человека затрудняют различные проблемы этического и биомедицинского характера. Это законодательные нюансы, связанные с получением разрешений регулирующих органов, проблема оценки качества образовавшихся в организме клеток, риск возникновения мутаций при генно-инженерных манипуляциях и т.д.
Разработка методик формирования линий стволовых клеток человека, несущих генетический материал пациента (полученных методом ПЯСК), откроет широкие перспективы для дальнейших исследований в области клеточной терапии.
Индукция репрограммирования стволовых клеток (ИРСК) человека в плюрипотентные стволовые клетки происходит при внедрении в клетки исходной культуры генов плюрипотентности, способных вернуть взрослые клетки в эмбриональное состояние.
Лаборатория японского учёного С. Яманаки работала над поиском факторов, поддерживающих в ЭСК программу плюрипотентности. Было найдено несколько десятков генов, активность которых в ЭСК была намного выше, чем в дифференцированных клетках. К моменту исследования уже был открыт и тот факт, что слияние ЭСК и специализированной клетки может дать две плюрипотентные клетки [2].
Вооруженная этим знанием, группа учёных внедрила в клетку фибробласта вектор с 24 генами, заставившими часть клеток дать колонии, подобные стволовым клеткам, и принялась по одному удалять гены из этого набора. В результате был установлен список из четырех генов: c-Myc, Oct4, Sox2 и Klf4 (Nanog и Lin28). Стоит отметить, что схема репрограммирования основана на внедрении в культуру соматических клеток человека ретровирусов, несущих такой генный набор. Полученные клетки, названные индуцированными плюрипотентными стволовыми клетками (ИПСК), возникли в результате вышеупомянутой процедуры, имеющей крайне низкий выход, однако применяемые технологии селекции позволяют обнаружить даже одну перепрограммированную клетку на сотни тысяч. Далее последовала серия работ этой и других лабораторий, в которых исследователи оптимизировали состав перепрограммирующих факторов и способ введения вектора в клетку, чтобы повысить эффективность перепрограммирования и снизить вероятность образования опухолевых клеток в результате вызываемой метаморфозы [3].
Гены Sox2 и Oct4 кодируют ключевые белки, необходимые для пролиферации (деления) и поддержания плюрипотентности стволовых клеток. Продукты генов c-Myc и Klf4 способствуют активации Sox2 и Oct4. Ген c-Myc является протоонкогеном: при его гиперэкспрессии может происходить злокачественная трансформация нормальных клеток. Продукт гена Nanog требуется для индукции плюрипотентности соматических клеток. В последних исследованиях была показана целесообразность замены c-Myc и Klf4 на Lin28 и Nanog. Дальнейшую селекцию культур ИПС клеток проводят по соответствию морфологических (компактность колоний, высокое ядерно-цитоплазматическое соотношение и т.д.), иммуногистохимических и генетических характеристик с ЭСК человека [4, с. 9].
Получение стволовых клеток методами ИРСК и ПЯСК не является равноценными и по технологии, и по возможным осложнениям. Применение в клеточной терапии методик, основанных на использовании ретровирусной трансфекции и внесения в клетки протоонкогенов, может представлять опасность. Несмотря на то, что сторонники метода ИРСК уверяют, что указанные проблемы легко преодолимы, сторонники ПЯСК убеждены в необходимости ускорения исследований в наиболее спорных направлениях (использование яйцеклеток человека в ПЯСК и т.д.) для скорейшего внедрения методики переноса ядра, как наиболее перспективной и безопасной. Наряду с этим, пока недостаточно проработаны гарантии безопасности биологического материала при генно-инженерных манипуляциях. Для успешного развития и внедрения в медицинскую практику данных технологий требуется не только детальная разработка вариантов самой методики, но и определение чётких показаний и противопоказаний для ее применения. Кроме того, необходимо наличие совершенных критериев оценки и методов коррекции отдаленных результатов, обучение высококвалифицированных специалистов, совершенствование материальной базы клиник и законодательной базы.
Тем не менее, несмотря на имеющиеся сложности, терапевтическое клонирование отмечается большинством специалистов как одно из наиболее перспективных направлений в заместительной клеточной терапии и, в целом, в мировой научной практике. Важнейшей потребностью сейчас является получение законодательного разрешения на проведение исследований, способствующих стремительному развитию данного направления, и преодоление уже выявленных недостатков и сложностей биомедицинского характера.
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Обзор посвящен актуальному биомедицинскому направлению в заместительной клеточной терапии — терапевтическому клонированию, которое является наиболее универсальным подходом для получения пациент-специфичных линий эмбриональных стволовых клеток (ЭСК) с колоссальными возможностями в поддержании и восстановлении здоровья человека. В обзоре также представлены альтернативные подходы и тенденции в получении ЭСК человека, которые, в отличие от терапевтического клонирования, пока далеки от выхода в клиническую практику. Уникальная ценность ЭСК в лечебных целях определяет серьезную потребность в развитии терапевтического клонирования и в нашей стране.
Введение
Основой для возникновения одного из самых перспективных биомедицинских направлений в заместительной клеточной терапии — терапевтического клонирования явились два важнейших открытия конца XX века. Это, во-первых, создание клонированной овечки Долли [1], во-вторых, получение эмбриональных стволовых клеток (ЭСК) из бластоцист [2] и примордиальных зародышевых клеток человека [3]. В первом случае убедительно показано для млекопитающих, что если в энуклеиро-ванный овоцит ввести ядро соматической клетки взрослого организма, то под влиянием цитоплазмы овоцита ядро такой клетки репрограммируется и способно дать начало развитию эмбриона (клона), геном которого идентичен геному организма — донора ядер. Во втором случае показано, как можно получать и культивировать ЭСК человека. Объединение этих двух важных достижений создает принципиальную возможность получения паци-ент-специфичных линий ЭСК и на их основе прогени-торных клеток, детерминированных в определенном направлении (например, клетки гематопоэтического ряда), которые, по существу, будут клетками самого пациента, и полностью с ним иммуносовместимыми. В этом состоит главный смысл и главная цель терапевтического клонирования. Сейчас основными источниками получения стволовых клеток непосредственно для биомедицинских работ являются стволовые клетки из пуповинной крови и стволовые клетки взрослых. Оба источника имеют серьезные ограничения: стволовые клетки пуповинной крови аутогенны только вновь рожденным, а получение стволовых клеток от самого пациента небезопасно для него. Кроме того, по общему мнению, потенциальные возможности к дифференцировке у этих клеток ниже, чем у ЭСК. Очевидно, что наиболее универсальный и надежный источник получения стволовых клеток (СК) человека — с помощью технологий клонирования.
Перспективные потребности в терапевтическом клонировании
Можно уверенно утверждать, что перспективные потребности в терапевтическом клонировании неограниче-ны, поскольку этот подход позволяет практически для каждого человека создать собственный банк линий СК. Так как эти клетки быстро размножаются, их можно получать в любом количестве. Человек, по существу, станет обладать неограниченным запасом собственных стволовых и прогениторных клеток различной детерминации.
Если основываться на современных представлениях об огромной роли в нормальном функционировании человеческого организма природного пула стволовых клеток, который резко беднеет с возрастом, то становятся совершенно очевидными колоссальные возможности терапевтического клонирования в поддержании и восстановлении здоровья человека в процессе его жизни, в преодолении различных недугов и в продлении его активного возраста [4]. Жизненные возможности каждого конкретного человека при этом резко обогащаются.
Сейчас в ряде стран приняты законы, разрешающие исследования с ЭСК человека, хотя морально-этические проблемы, связанные с использованием для этого человеческих эмбрионов, по-прежнему продолжают вызывать в обществе самые острые дебаты в истории биомедицинской науки [5]. Обычно в репродуктивной практике получают примерно 24 овоцита от каждой женщины-клиента и лишь два-четыре эмбриона используют затем для имплантации в надежде, что один из них будет нормально развиваться в ходе беременности. Многие эмбрионы, остающиеся после искусственного оплодотворения, будут разрушены в любом случае, даже спустя годы хранения в криобанках. Менее 3% таких эмбрионов доступны сейчас для исследований [6]. В то же время, специальный анализ, проведенный в США, Канаде, Англии, Австралии и в других странах показал, что пациенты центров репродукции в преобладающем большинстве предпочли бы передать остающиеся ово-циты и эмбрионы в дар для научных исследований, в том числе и для получения СК [7—*10],
Совсем недавно в марте 2009 г. в США были законодательно разрешены исследования с эмбрионами и ЭСК человека в биомедицинских целях с проведением соответствующих клинических испытаний [11], хотя, фактически, эксперименты в этом направлении были начаты в 2006 г. в Гарвардском университете. Многомиллионные проекты по созданию клонированных человеческих эмбрионов с целью получения ЭСК были запущены также и в Австралии. С учетом этих фактов нет никаких сомнений, что терапевтическое клонирование в ближайшее время станет ведущим направлением в заместительной клеточной терапии и биомедицинской практике в мире. Уникальная ценность ЭСК в лечебных целях определяет серьезную потребность в развитии терапевтического клонирования и в нашей стране. Очевидно, что законодательное разрешение в России на проведение таких научно-исследовательских работ в определенных жестких этических рамках является сейчас важнейшей и насущной потребностью. Необходимо заметить, что терапевтическое клонирование человека и репродуктивное клонирование это принципиально разные по своим целям направления, и, безусловно, репродуктивное клонирование человека должно быть под строгим запретом по фундаментальным биологическим причинам, не говоря уже о возникающих при этом сложных этических, правовых и социальных проблемах.
Мировые тенденции развития терапевтического клонирования
Огромные возможности технологий терапевтического клонирования пока продемонстрированы на животных модельных объектах. Первая работа по терапевтическому клонированию опубликована в 2000 г. и была выполнена на мышах [12]. В работе было показано, что линии ЭСК из клонированных эмбрионов состоят из клеток с такими же плюрипотентными свойствами, как и обычные ЭСК. Затем появились десятки таких работ и сделаны удачные попытки при использовании технологии клонирования корректировать имеющиеся у экспериментальных животных патологии, в частности, комбинированный иммунодефицит [13]. Тем самым были продемонстрированы серьезные возможности сочетания терапевтического клонирования с генной терапией для успешного лечения различных генетических заболеваний.
Альтернативные подходы в получении пациент-специфичных линий ЭСК
Одновременно в мире ведется интенсивный поиск альтернативных возможностей для получения пациент-специфичных линий ЭСК в биомедицинских целях. Одна из возможностей состоит в пересадке ядер соматических клеток человека в овоциты животных. Стремительно возросший интерес к терапевтическому клонированию в лечении различных заболеваний требует получения ЭСК в больших количествах. Однако, даже в условиях законодательного благоприятствования, человеческих овоцитов и зародышей для этого всегда будет очень ограниченное количество, а их получение — дорогостоящим. Нехватка человеческих овоцитов, необходимых в исследовательских целях, может быть восполнена использованием овоцитов животных, которые более доступны. Гибридные гетероплазмичные эмбрионы с геномом человека и смешанной цитоплазмой человека и животного представляют собой привлекательную и удобную модельную систему для решения многих фундаментально-практических вопросов терапевтического клонирования. При проведении исследований строго запрещено имплантировать полученные гибридные эмбрионы в матку человека или животного, а также длительно выращивать их in vitro (более 14 сут).
Первая успешная работа в этом направлении принадлежит группе китайских ученых [22], которые методом переноса ядер соматических клеток человека (фибробластов) в энуклеированные кроличьи овоциты получили гибридные реконструированные эмбрионы и затем линии ЭСК. Тщательный анализ показал, что эти ЭСК фенотипически сходны с обычными человеческими ЭСК, включая способность к разнообразным клеточным диф-ференцировкам. Таким образом, оказалось возможным получать линии стволовых клеток человека без участия человеческих овоцитов. Эти же исследователи затем осуществили перенос ядер фибробластов человека в энуклеированные коровьи овоциты [23] и показали, что и в таких гибридах наблюдается перепрограммирование ядер клеток человека с соответствующей активацией эмбриональной генной экспрессии. Гибридные эмбрионы развивались до поздних предимплантационных стадий, что важно для генерации в дальнейшем ЭСК.
Проведение аналогичных исследований было разрешено в Англии, однако все усилия повторить работу китайских ученых оказались безуспешными: не удалось методом межвидовой пересадки ядер добиться развития таких же реконструированных гибридных эмбрионов человека и животных до стадии получения бластоцист и ЭСК [24, 25]. Аналогичные попытки межвидовой пересадки ядер человека, предпринятые в США, оказались тоже неудачными [26]. На основании большой серии опытов по переносу ядер соматических (кумулюс-ных) клеток человека в овоциты человека и различных животных: коров, кроликов и мышей, было показано, что в гибридах человека и животных не достигается соответствующего репрограммирования ядер, как в клонированных человеческих эмбрионах, у которых паттерн генной экспрессии был, практически, идентичен с нормальными человеческими эмбрионами. Особенно критично, что в гибридных эмбрионах отсутствовала экспрессия генов плюрипотентности, что необходимо для получения СК.
По мнению ряда исследователей, дефекты в развитии гибридов человека и животных могут быть связаны не только с недостаточным перепрограммированием эпигенетического статуса соматических ядер человека, но и с полной несовместимостью ядерного генома человека и митохондриального генома животного [27, 28]. Реконструированные гибридные зародыши выживают непродолжительное время только за счет человеческих митохондрий, поскольку ядра соматических клеток человека, как правило, переносятся в овоциты животного вместе с цитоплазмой [28]. Таким образом, на основании всех этих данных был сделан вывод, что овоциты животных не пригодны для использования в качестве реципиентов ядер человеческих клеток, и получение ЭСК человека из таких зародышей практически невозможно [26].
Другим подходом для создания пациент-специфичных плюрипотентных стволовых клеток является индукция дедифференцировки соматических клеток с помощью самих ЭСК, что было показано методом соматической гибридизации сначала на мышах [29, 30], а затем с ЭСК человека [31, 32]. Стволовые клетки при слиянии с соматическими клетками являются поставщиками факторов, требуемых для эпигенетического репрограммирования генома соматических клеток с соответствующей индукцией плюрипотентных свойств и характеристик [33, 34]. Показана возможность репрограммирования ядер соматических клеток с помощью экстракта ЭСК [35] и предприняты попытки селективной элиминации ЗСК-хро-мосом [36, 37], однако удаление всех хромосом технически пока мало достижимо, и рассматриваемый способ получения стволовых клеток в целом далек от выхода в терапевтическую практику.
Наиболее многообещающим альтернативным подходом для создания пациент-специфичных линий из соматических клеток в биомедицинских целях является получение ЗСК-подобных клеток или индуцированных плюрипотентных линий СК CiPSD. Это новое направление исследований в заместительной клеточной терапии, начало которому положила работа ученых из Японии 2006 г. на мышах по перепрограммированию фибро-бла-стов до статуса, аналогичного плюрипотентному [38]. Вскоре была показана возможность такой трансформации для фибробластов человека [39]. Генетическую модификацию фибробластов проводили с помощью ретровирусной трансфекции четырех ключевых факторов плюрипотентности: 0ct3/4, Sox2, Klf4, с-Мус, и последующая экспрессия этих генов индуцировала репрограммирование соматических клеток с возвратом к плюрипотентному состоянию. Хотя эффективность такого подхода была очень низка, и известно также, что использование вирусных векторов может приводить к малигниза-ции iPS-клеток, эти работы стали сенсацией [40—42]. Последовала целая серия исследований с факторами индукции и был предпринят активный поиск других способов введения генов в соматические клетки (не прибегая к ретровирусам) с минимизацией модификации генома [43—48]. В результате на мышах была показана возможность безопасного способа репрограммирования клеток с использованием транспозонов и всего одного фактора Klf4 [49].
Тем не менее, iPS-клетки преждевременно считать адекватной альтернативной заменой ЭСК для регенеративной терапии [50]. В биомедицинских целях необходимо репрограммировать собственные гены клеток вместо добавления новых копий и только технологии терапевтического клонирования предоставляют уникальную возможность такого репрограммирования ядер соматических клеток. Обратимость программы экспрессии генов под воздействием цитоплазмы овоцитов, возврат к паттерну эмбриональной экспрессии в соматических донорских ядрах позволяет в настоящее время рассматривать реконструированные эмбрионы человека как основной источник получения пациент-специфичных линий ЭСК.
Состояние исследований по терапевтическому клонированию в России
Несмотря на бум по поводу больших возможностей ЭСК в лечении различных заболеваний, работы по терапевтическому клонированию в России пока практически не ведутся. В первую очередь это объясняется отсутствием законодательной базы для проведения исследований с использованием овоцитов и эмбрионов человека. С принятием таких законов для России существует реальная возможность очень быстрого развития терапевтического клонирования. В нашей стране имеются эффективные клеточные технологии получения реконструированных эмбрионов методом трансплантации ядер. По-существу, основы современных технологий переноса ядер соматических клеток, сочетающие микрохирургию и электрослияние были разработаны впервые у нас в 80-х годах прошлого столетия [51]. Также имеются эффективные технологии получения линий человеческих ЭСК [52].
Реализовывать задачи терапевтического клонирования возможно на основе центров репродукции, которые помимо их прямого предназначения, могут стать центрами по получению линий ЭСК, в первую очередь, непосредственно для женщин — пациенток данного центра и любых членов их семей. Можно ожидать, что с развитием терапевтических технологий получение собственных ЭСК станет доступно каждому человеку. Необходимо осуществлять тесное сотрудничество центров репродукции с соответствующими научно-исследовательскими лабораториями, ориентированными на решение фундаментальных проблем и на разработку новых технологий. К подобным технологиям можно отнести реконструкцию эмбрионов с применением неинвазивных оптико-лазерных приемов микроманипулирования в целях терапевтического клонирования и заместительной клеточной терапии [53]. Разработка таких приемов приведет к появлению нового класса микроманипуляци-онной аппаратуры, совмещающей различные оптиколазерные микроинструменты (оптический пинцет, лазерный скальпель и т.д.) с компьютеризированным управлением. Следует ожидать, что при соответствующей последовательной направленной научно-организационной работе в отношении развития в нашей стране терапевтического клонирования, Россия может достичь в обозримом будущем зарубежного уровня в этой области биомедицинских исследований.

Обзор
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.

Сегодня существует ряд этических преград для дальнейшего развития клонирования, тем более в отношении человека. Некоторые мировые религии считают клонирование человека недопустимым. В некоторых странах клонирование запрещено вообще. В части стран запрещено клонирование, при котором воспроизводится целый многоклеточный организм [3].
Клонирование в биологии — это появление естественным или искусственным путем нескольких генетически идентичных живых организмов. Термин в том же смысле нередко применяют по отношению к одноклеточным организмам и клеткам многоклеточных организмов.
Естественное клонирование
В действительности, клонирование свойственно и растительному, и животному мирам. Например, вегетативное размножение растений, деление бактерий, клональное размножение ящериц. В том числе рождение близнецов у людей — тоже пример естественного клонирования.
Искусственное клонирование
Это группа методов, при которых целенаправленно создаются клоны молекул, клеток, многоклеточных организмов.
Бактериальное клонирование — это целенаправленное создание и выращивание бактериальных клонов для биотехнологий.
Молекулярное клонирование, при котором получают клоны фрагмента ДНК, а затем вставляют в необходимые клетки.
Искусственное клонирование многоклеточных организмов. При этом виде клонирования можно создать клоны клеток, тканей, целого органа или даже организма. Именно искусственное клонирование многоклеточных организмов является предметом споров и разногласий научного сообщества, религии, и предметом этой статьи.
Немного о биологии размножения многоклеточных организмов
Совокупность наследственного материала клетки называется геномом. Многоклеточные организмы — эукариоты. Одной из особенностей эукариотических клеток является то, что наследственный материал находится в ядре клетки в виде хромосом, а также в виде кольцевидной ДНК в митохондриях.
Хромосома — нитевидная структура, состоящая из ДНК и белков. Именно ДНК несет генетическую информацию. Например, в ядре клеток человека содержится 23 пары хромосом (то есть всего 46) [4]. В половых клетках человека содержится половина — 23 хромосомы. При соединении двух половых клеток — маминой и папиной — получается клетка зигота с 46-ю хромосомами (рис. 1). Зигота дает начало всем будущем клеткам и тканям организма. Таким образом, в естественных условиях все клетки многоклеточного организма несут генетическую информацию от своих отца (мужской гаметы) и матери (женской гаметы) [5]. Клетки, содержащие 23 хромосомы, называются гаплоидными, а содержащие все 46 хромосом — диплоидными. В организме млекопитающих все клетки, кроме половых, являются диплоидными соматическими [4], [6].

Рисунок 1. Результат оплодотворения — зигота человека
У разных млекопитающих — разное количество хромосом (см. табл.).
| Название млекопитающего | Количество хромосом диплоидного набора | Количество хромосом гаплоидного набора |
|---|---|---|
| Человек | 46 | 23 |
| Шимпанзе | 48 | 24 |
| Овца | 54 | 27 |
Немного истории клонирования
У клонирования сложный и тернистый путь.
В 40-х годах прошлого века советский ученый-эмбриолог Г.В. Лопашов проводил эксперименты по переносу клеточных ядер в энуклеированную (лишенную ядра) яйцеклетку земноводных. Аналогичные работы с земноводными проводили эмбриологи Т. Кинг и Р. Бриггс в США. В 50-х годах английский эмбриолог Д. Гордон пересаживал ядра соматических клеток в яйцеклетки лягушки. В 1963 году Тонг Дизхоу получал клоны карпа. В 1975 году были опубликованы результаты успешной работы Д. Бромхола по клонирования кроликов. В 1983 году Л.А. Слепцова и ее коллеги клонировали костистых рыб (вьюнов). В 80-х годах прошлого столетия ученый С. Вилладсен провел серию успешных опытов по клонированию сельскохозяйственных животных путем переноса в яйцеклетку ядра зародыша. В 1997 году Йэн Уилмат и Кейт Кэмпбелл из Шотландии объявили о прорыве: проведено клонирование овцы с использованием соматической, не зародышевой, клетки [1], [7]!
Долли — самка овцы, первое млекопитающее, которое смогли клонировать из зрелой соматической клетки путем замещения ядра. Технология получения этого клона была следующей.

Рисунок 2. Схема клонирования овцы Долли

Например, клонирование может помочь получить животных и растения с необходимыми параметрами, такими как плодовитость, устойчивость к болезням. Опыты с клонированием могут помочь в лечении болезней. Очень интересной является перспектива использования клонирования для восстановления популяции вымерших или вымирающих видов. Отдельного внимания заслуживают опыты терапевтического клонирования — получение культуры стволовых клеток для разработки новых методов терапии тяжелых заболеваний, например, онкологических [7].
Читайте также:

