Каталаза это в биологии кратко
Обновлено: 02.07.2024
фермент из группы гидропероксидаз, катализирующий окислительно-восстановительную реакцию, в ходе которой из 2 молекул перекиси водорода образуются вода и кислород:
К. получена в кристаллическом состоянии; её молекулярная масса 250 000. Широко распространена в клетках животных, растений и микроорганизмов. Относится к хромопротеидам, имеющим в качестве простетической (небелковой) группы окисленный Гем. Специфичность К. в отношении к субстрату-восстановителю невелика, поэтому К. может катализировать не только разложение H2O2, но и окисление низших спиртов. Функция К. сводится к разрушению токсической перекиси водорода, образующейся в ходе различных окислительных процессов в организме.
Найдено 1 изображение:
каталаза сущ., кол-во синонимов: 1 • фермент (253) Словарь синонимов ASIS.В.Н. Тришин.2013. . Синонимы: фермент
фермент, катализирующий реакцию разложения перекиси водорода на воду и молекулярный кислород: Н2О2 + Н2О2 = О2 + 2Н2О. Биологическая роль К. заключается в деградации перекиси водорода, образующейся в клетках в результате действия ряда флавопротеиновых оксидаз (ксантиноксидазы, глюкозооксидазы, моноаминоксидазы и др.), и обеспечении эффективной защиты клеточных структур от разрушения под действием перекиси водорода. Генетически обусловленная недостаточность К. является одной из причин так называемой акаталазии — наследственного заболевания, клинически проявляющегося изъязвлением слизистой оболочки носа и ротовой полости, иногда резко выраженными атрофическими изменениями альвеолярных перегородок и выпадением зубов.
К. широко распространена в тканях животных, в т.ч. человека, растений и в микроорганизмах (однако фермент полностью отсутствует у некоторых анаэробных микроорганизмов). В клетках К. локализуется в специальных органеллах — пероксисомах.
К. представляет собой гемопротеин, простетической группой которого является гем, содержащий ион трехвалентного железа. Молекула К. состоит из четырех, по-видимому, идентичных субъединиц с молекулярной массой 60 000 и имеет соответственно четыре простетические группы. Феррипротопорфириновые группы гема прочно связаны с белковой частью фермента — апофермектом и не отделяются от него при диализе. Оптимальная величина рН для К. находится в интервале значений 6,0—8,0.
Методы определения активности К. основаны на регистрации образующегося в процессе реакции О2 (манометрическим или полярографическим методами) или на измерении текущей (спектрофотометрическим) или остаточной (перманганатометрическим, йодометрическим и другими титриметрическими методами) концентрации перекиси водорода.
Активность К. в эритроцитах остается постоянной при ряде заболеваний, однако при злокачественной и других макроцитарных анемиях увеличивается так называемый каталазный индекс (отношение величины каталазной активности определенного объема крови к количеству эритроцитов в этом объеме), имеющий существенное диагностическое значение. При злокачественных новообразованиях отмечается уменьшение активности К. в печени и почках, причем существует зависимость между величиной опухоли, скоростью ее роста и степенью уменьшения активности К. и печени. Из некоторых опухолей выделены вещества — токсогормоны, которые при введении экспериментальным животным вызывают у них снижение активности К. в печени.
гемсодержащий фермент класса оксидоредуктаз (КФ 1.11.1.6), катализирующий разложение перекиси водорода с образованием кислорода и воды; широко распространена в тканях животных и растений; определение активности К. в эритроцитах человека имеет диагностическое значение при анемиях.
Каталаза – фермент, обнаруженный почти во всех живых организмах. Основная его функция – катализировать реакцию разложения перекиси водорода до безвредных для организма веществ. Каталаза имеет большое значение для жизнедеятельности клеток, так как защищает их от разрушения активными формами кислорода.
Общие сведения
Фермент каталаза относится к оксидоредуктазам – обширному классу ферментов, которые катализируют перенос электронов от молекулы-восстановителя (донора) к молекуле-окислителю (акцептору).
Оптимальный pH для работы каталазы в человеческом организме около 7, однако, скорость реакции существенно не изменяется при значениях показателя водорода от 6,8 до 7,5. Оптимальное значение рН для других каталаз колеблется от 4 до 11, в зависимости от вида организма. Оптимальная температура также различается, для человека это около 37 о С.
Каталаза - один из самых быстрых ферментов. Всего одна его молекула способна превращать миллионы молекул перекиси водорода в воду и кислород за секунду. С точки зрения энзимологии это значит, что для фермента каталазы характерно большое число оборотов.
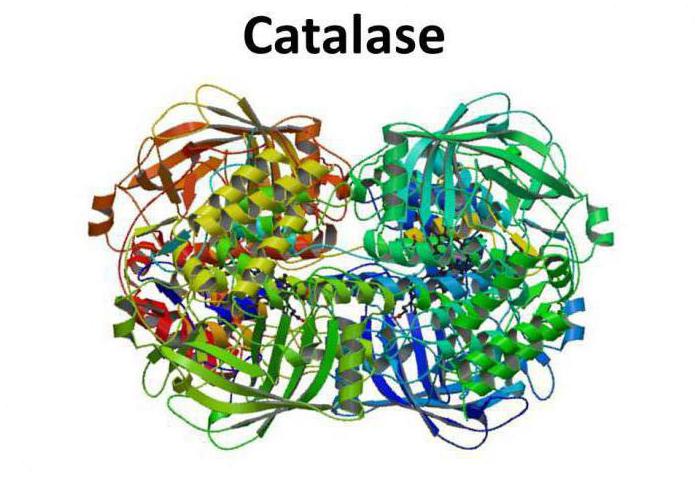
Структура фермента
Каталаза представляет собой тетрамер из четырех полипептидных цепей, каждая из которых имеет длину более 500 аминокислот. Фермент имеет в составе четыре группы порфирового гема, благодаря которым и вступает в реакцию с активными формами кислорода. Окисленный гем представляет собой простетическую группу каталазы.
История открытия
Каталаза не была известна ученым до 1818 года, пока Луи Жак Тенар, химик обнаруживший в живых клетках перекись водорода, не предположил, что ее разрушение связано с действием ранее неизвестного биологического вещества.

В 1937 году впервые удалось кристаллизоваться каталазу из говяжьей печени. В 1938 году была определена молекулярная масса фермента – 250 кДа. В 1981 году ученые получили изображение трехмерной структуры бычьей каталазы.
Катализ перекиси водорода
Несмотря на то, что пероксид водорода – продукт многих нормальных метаболических процессов, для организма он не является безвредным.
Чтобы предотвратить разрушение клеток и тканей, перекись водорода должна быть быстро превращена в другое, менее опасное для организма вещество. Именно с этой задачей и справляется фермент каталаза - он разлагает молекулу перекиси до двух молекул воды и молекулы кислорода.
Реакция разложения пероксида водорода в живых тканях:
Молекулярный механизм расщепления перекиси водорода ферментом каталазой пока точно не изучен. Предполагается, что реакция проходит в два этапа - на первом этапе железо в составе простетической группы каталазы связывается с атомом кислорода перекиси, при этом выделяется одна молекула воды. На втором этапе окисленный гем взаимодействует с другой молекулой перекиси водорода, в результате чего образуется еще одна молекула воды и одна молекула кислорода.
Благодаря такому действию фермента каталазы на пероксид водорода, наличие этого активного вещества в образцах ткани легко определить. Для этого достаточно добавить к исследуемому образцу небольшое количество перекиси водорода и наблюдать за реакцией. О наличии фермента говорит формирование пузырьков кислорода. Эта реакция хороша тем, что не требует никакого специального оборудования или инструментов - ее можно наблюдать невооруженным глазом.

Стоит заметить, что ион любого тяжелого металла может выступать как неконкурентный ингибитор каталазы. Кроме того, всем известный цианид ведет себя как конкурентный ингибитор каталазы, если в тканях много перекиси водорода. Арсенаты играют роль активаторов.
Применение
Разлагающее действие фермента каталазы на пероксид водорода нашло применение в пищевой промышленности – с помощью этого фермента из молока удаляется Н2О2 до приготовления сыра. Еще одно применение – специальные пищевые упаковки, которые защищают продукты от окисления. Каталаза также применяется в текстильной промышленности для удаления пероксида водорода из тканей.
Она в небольших количествах используется в гигиене контактных линз. Некоторые дезинфицирующие средства имеют в составе перекись водорода, и каталаза используется для расщепления этого компонента перед повторным использованием линз.
Активность
Активность фермента каталазы зависит от возраста организма. В молодых тканях активность фермента значительно выше, чем в старых. С возрастом и у людей, и у животных активность каталазы постепенно снижается как результат старения органов и тканей.
Согласно недавним исследованием, снижение активности каталазы является одной из возможных причин поседения волос. Перекись водорода постоянно образуется в человеческом организме, однако не приносит вреда - каталаза быстро разлагает ее. Но если уровень этого фермента снижен, очевидно, что не вся перекись водорода катализируется ферментом. Таким образом, она обесцвечивает волосы изнутри, растворяя естественные красители. Это неожиданное открытие сейчас проверяется исследователями, и, возможно, сыграет роль в разработке препаратов, приостанавливающих поседение волос.
Каталаза общий фермент обнаружены почти во всех живых организмах, подвергающихся воздействию кислорода (например, бактерии, растения и животные), которые катализирует разложение пероксид водорода к воды и кислород. [1] Это очень важный фермент для защиты клетки от окислительное повреждение к активные формы кислорода (ROS). Точно так же каталаза имеет один из самых высоких цифры оборота всех ферментов; одна молекула каталазы может каждую секунду превращать миллионы молекул перекиси водорода в воду и кислород. [2]
Каталаза - это тетрамер четырех полипептидных цепей, каждая более 500 аминокислоты длинный. [3] Он содержит четыре железосодержащих гем группы, которые позволяют ферменту реагировать с перекисью водорода. Оптимальный pH для каталазы человека составляет примерно 7, [4] и имеет довольно широкий максимум: скорость реакции существенно не меняется в диапазоне pH от 6,8 до 7,5. [5] Оптимум pH для других каталаз колеблется от 4 до 11 в зависимости от вида. [6] Оптимальная температура также зависит от вида. [7]
Содержание
Структура
Каталаза человека образует тетрамер состоит из четырех подразделения, каждый из которых можно концептуально разделить на четыре области. [8] Обширное ядро каждой субъединицы образовано восьмицепочечным антипараллельным бочка (b1-8), при этом связь ближайшего соседа ограничена петлями b-типа с одной стороны и петлями a9 с другой. [8] А спиральный домен на одной стороне b-цилиндра состоит из четырех C-концевых спиралей (a16, a17, a18 и a19) и четырех спиралей, образованных из остатков между b4 и b5 (a4, a5, a6 и a7). [8] Альтернативный сплайсинг может привести к различным вариантам белка.
История
Каталаза была впервые замечена в 1818 году, когда Луи Жак Тенар, открывший H2О2 (пероксид водорода), предположил, что его поломка вызвана неизвестным веществом. В 1900 г. Оскар Лёв был первым, кто дал ему название каталаза, и нашел его во многих растениях и животных. [9] В 1937 г. каталаза из говяжьей печени была кристаллизована Джеймс Б. Самнер и Александр Даунс [10] а молекулярный вес был найден в 1938 году. [11]
В аминокислота Последовательность из бык каталаза была определена в 1969 г., [12] и трехмерная структура в 1981 году. [13]
Функция
Реакция
Присутствие каталазы в микробном образце или образце ткани может быть продемонстрировано путем добавления пероксид водорода и наблюдая за реакцией. Производство кислород можно увидеть по образованию пузырей. Этот простой тест, который можно увидеть невооруженным глазом, без помощи инструментов, возможен, потому что каталаза имеет очень высокую специфическая деятельность, который дает заметный отклик, а также тот факт, что одним из продуктов является газ.
Молекулярный механизм
Хотя полный механизм каталазы в настоящее время неизвестен, [14] то реакция Считается, что происходит в два этапа:
Здесь Fe () - E представляет собой утюг центр гем группа, присоединенная к ферменту. Fe (IV) -E (. +) Представляет собой мезомерную форму Fe (V) -E, что означает, что железо не полностью окисляется до + V, но получает некоторую стабилизирующую электронную плотность от гемового лиганда, которая затем отображается как катион-радикал (. +).
Поскольку перекись водорода попадает в активный сайт, он взаимодействует с аминокислоты Asn148 (аспарагин в позиции 148) и Его75, вызывая протон (водород ион) для передачи между атомами кислорода. Свободный атом кислорода координирует, освобождая новообразованную молекулу воды, и Fe (IV) = O. Fe (IV) = O реагирует со второй молекулой пероксида водорода с преобразованием Fe (III) -E и образованием воды и кислорода. [14] Реакционная способность железного центра может быть улучшена за счет присутствия фенолята. лиганд из Tyr358 в пятой координационной позиции, которая может помочь в окисление от Fe (III) до Fe (IV). Эффективность реакции также можно повысить за счет взаимодействия His75 и Asn148 с промежуточные продукты реакции. [14] Разложение пероксида водорода каталазой протекает по кинетике первого порядка, причем скорость пропорциональна концентрации пероксида водорода. [15]
Каталаза также может катализировать окисление за счет пероксид водорода, различных метаболитов и токсинов, в том числе формальдегид, муравьиная кислота, фенолы, ацетальдегид и спирты. Это происходит в соответствии со следующей реакцией:
Точный механизм этой реакции неизвестен.
Любой ион тяжелых металлов (например, катионы меди в сульфат меди (II)) может действовать как неконкурентный ингибитор каталазы. Кроме того, яд цианид неконкурентный ингибитор [16] каталазы при высоких концентрациях пероксид водорода. [17] Арсенат действует как активатор. [18] Трехмерный белковые структуры промежуточных продуктов пероксидной каталазы доступны в Банк данных белков.
Сотовая роль
Перекись водорода - вредный побочный продукт многих нормальных метаболический процессы; чтобы предотвратить повреждение клеток и тканей, его необходимо быстро преобразовать в другие, менее опасные вещества. С этой целью клетки часто используют каталазу, чтобы быстро катализировать разложение перекиси водорода в менее реакционноспособный газообразный кислород и молекулы воды. [19]
Мыши, генетически модифицированные с отсутствием каталазы, изначально фенотипически нормальны. [20] однако дефицит каталазы у мышей может увеличить вероятность развития ожирение, жирная печень, [21] и диабет 2 типа. [22] У некоторых людей очень низкий уровень каталазы (акаталазия), но показывает мало побочных эффектов.
Каталаза обычно находится в клеточном органелла называется пероксисома. [25] Пероксисомы в клетках растений участвуют в фотодыхание (использование кислорода и производство углекислого газа) и симбиотический азотфиксация (распад двухатомный азот (N2) к реактивным атомам азота). Перекись водорода используется как мощное противомикробное средство, когда клетки инфицированы патогеном. Каталаза-положительные патогены, такие как Микобактерии туберкулеза, Легионелла пневмофила, и Campylobacter jejuni, заставляют каталазу дезактивировать перекисные радикалы, тем самым позволяя им выживать без повреждений в хозяин. [26]
Нравиться алкогольдегидрогеназа, каталаза превращает этанол в ацетальдегид, но маловероятно, что эта реакция является физиологически значимой. [27]
Распространение среди организмов
Подавляющее большинство известных организмов используют каталазу во всех орган, с особенно высокими концентрациями в печень у млекопитающих. [28] Каталаза содержится в основном в пероксисомы и цитозоль из эритроциты (а иногда и в митохондрии [29] )
Почти все аэробные микроорганизмы использовать каталазу. Он также присутствует в некоторых анаэробный микроорганизмы, Такие как Methanosarcina barkeri. [30] Каталаза также универсальна среди растения и встречается в большинстве грибы. [31]
Одно уникальное использование каталазы происходит в Жук-бомбардир. У этого жука два набора жидкостей, которые хранятся отдельно в двух парных железах. Более крупная из пары, камера хранения или резервуар, содержит гидрохиноны и перекись водорода, в то время как реакционная камера меньшего размера содержит каталазы и пероксидазы. Чтобы активировать ядовитую аэрозоль, жук смешивает содержимое двух отсеков, вызывая высвобождение кислорода из перекиси водорода. Кислород окисляет гидрохиноны, а также действует как пропеллент. [32] Реакция окисления очень экзотермический (ΔH = -202,8 кДж / моль) и быстро нагревает смесь до точки кипения. [33]
Долгожители королевы термит Ретикулитермес speratus значительно ниже окислительное повреждение их ДНК чем непродуктивные особи (рабочие и солдаты). [34] Куинс имеет более чем в два раза более высокую активность каталазы и в семь раз более высокий уровень экспрессии гена каталазы RsCAT1, чем рабочие. [34] Похоже, что эффективный антиоксидант Способность королев термитов может частично объяснить, как они достигают более долгой жизни.
Ферменты каталазы разных видов имеют сильно различающиеся оптимальные температуры. Пойкилотермный животные обычно имеют каталазы с оптимальной температурой в диапазоне 15-25 ° C, в то время как каталазы млекопитающих или птиц могут иметь оптимальную температуру выше 35 ° C, [35] [36] и каталазы растений различаются в зависимости от их привычка к росту. [35] Напротив, каталаза, выделенная из гипертермофил Археон Pyrobaculum calidifontis имеет температурный оптимум 90 ° C. [37]
Клиническое значение и применение

Каталаза используется в пищевой промышленности для удаления пероксид водорода из молоко до сыр производство. [38] Другое использование - в пищевых обертках, где они предотвращают попадание пищи. окисляющий. [39] Каталаза также используется в текстиль промышленности, удаляя перекись водорода из тканей, чтобы убедиться, что материал не содержит перекиси. [40]
Незначительное использование в контактные линзы гигиена - несколько средств для чистки линз дезинфицировать линза с использованием раствора перекиси водорода; затем раствор, содержащий каталазу, используется для разложения перекиси водорода перед повторным использованием линзы. [41]
Идентификация бактерий (каталазный тест)

Каталазный тест - один из трех основных тестов, используемых микробиологами для определения видов бактерий. Если бактерии обладают каталазой (т. Е. Каталазоположительны), когда небольшое количество бактерий изолировать добавляется к перекиси водорода, наблюдаются пузырьки кислорода. Тест на каталазу проводится путем нанесения капли перекиси водорода на предметное стекло микроскопа. К колонии прикасаются палочкой-аппликатором, а затем кончик мазка наносится на каплю перекиси водорода.
Хотя тест на каталазу сам по себе не может идентифицировать конкретный организм, он может помочь в идентификации в сочетании с другими тестами, такими как устойчивость к антибиотикам. Присутствие каталазы в бактериальных клетках зависит как от условий роста, так и от среды, используемой для роста клеток.
Капиллярные трубки также могут быть использованы. Небольшой образец бактерий собирается на конце капиллярной трубки, не блокируя пробирку, чтобы избежать ложноотрицательный полученные результаты. Затем противоположный конец погружают в перекись водорода, которая втягивается в трубку через капиллярное действиеи переверните так, чтобы образец бактерий был направлен вниз. Затем руку, держащую трубку, постукивают по столу, перемещая перекись водорода вниз, пока она не коснется бактерий. Если при контакте образуются пузырьки, это указывает на положительный результат каталазы. Этот тест может обнаруживать каталаза-положительные бактерии в концентрациях выше примерно 10 5 клеток / мл, [45] и прост в использовании.
Бактериальная вирулентность
Акаталазия
Акаталазия это состояние, вызванное гомозиготными мутациями в CAT, что приводит к недостатку каталазы. Симптомы легкие и включают язвы во рту. Гетерозиготная мутация CAT приводит к более низкому, но все же присутствующему уровню каталазы. [49]
серые волосы
Низкий уровень каталазы может играть роль в седеющий процесс человеческих волос. Перекись водорода естественным образом вырабатывается организмом и расщепляется каталазой. Если уровень каталазы снижается, перекись водорода не может так хорошо расщепляться. Перекись водорода препятствует образованию меланин, пигмент, придающий цвет волосам. [50] [51]
Взаимодействия
Каталаза была показана взаимодействовать с ABL2 [52] и Abl гены. [52] Заражение вирус лейкемии мышей вызывает снижение активности каталазы в легких, сердце и почках мышей. И наоборот, диетический рыбий жир увеличивает активность каталазы в сердце и почках мышей. [53]
Каталаза – это фермент, который в организме человека принимает участие в обмене веществ и в расщеплении пероксида водорода, обладает очень мощными антиоксидантными свойствами.
Что представляет собой каталаза / краткое описание
Каталаза обеспечивает разложение перекиси водорода на воду и молекулярный кислород. В этом и заключаются ее антиоксидантные свойства. Перекись водорода образуется в клетках организма в результате некоторых химических процессов под воздействием определенных ферментов. Накопление ее в организме приводит к разрушению и гибели клеток. Каталаза предотвращает этот процесс. По-другому ее еще называют гемопротеином. То есть это небелковое вещество, но связанное с белком.
Что такое пероксид / перекись водорода
Пероксид водорода – это мощнейший оксидант, или по-другому свободный радикал. Он образуется при дыхании клеток.
Функции и активность каталазы
Главная функция каталазы – расщепление пероксида водорода на молекулярный кислород и воду. Она принимает участие в обмене веществ и пищеварении.
Каталаза действует в организме всегда. Это ее задача – защита организма и обезвреживание разрушительных окислителей. Наибольшее ее количество содержится в печени. Действует она в эритроцитах при самых разных заболеваниях. Однако, есть данные исследований, что при злокачественных опухолях ее активность в почках и в печени заметно снижается. Зависимость размера опухоли зависит от снижения активности каталазы.
Каталаза содержится в коже всего тела. Благодаря ее антиоксидантным свойствам и прямым функциям, кожа получает в результате влагу и кислород. Так, действие фермента каталазы не только обеспечивает защиту организму от свободных радикалов, но еще увлажняет его и обеспечивает свободное дыхание. А это значит здоровье и молодость.
Старение организма происходит по нескольким причинам. Одна из них – уменьшение количества и активности каталазы в организме. Тогда начинается активное накопление свободных радикалов, или окислителей. Предотвратить это можно при помощи натуральных антиоксидантных препаратов. Например, все пептидные биорегуляторы, или Цитомаксы и Цитогены, являются природными антиоксидантами и/или содержат их в своем составе.
Также практически вся продукция НПЦРиЗ содержит антиоксидантные компоненты в своем составе. Это и онкопротекторы, женские онкопротекторы для репродуктивной системы (Мамитон) и другие. Вот некоторые из них: Олекап, Панаксод, химиорадиопротектор Ревиплант, и другие.
Читайте также:

