Каково значение коллоидных растворов кратко
Обновлено: 05.07.2024
Коллоидные системы очень распространены в природе, они имеют большое значение для жизнедеятельности растений и животных. Почва, клеточный сок, белковые вещества, лимфа, кровь- все это коллоидные системы.
Коллоидные системы состоят из дисперсионной среды и дисперсной фазы.В дисперсных системах одна из фаз находится в мелко раздробленном состоянии и распределена в другой, имеющей непрерывное строение. Вещество, находящееся в мелко раздробленном состоянии, называется дисперсной фазой, а вещество, находящееся в виде сплошной массы - дисперсионной средой. По размерам частиц дисперсной фазы дисперсные системы классифицируются на три вида:
1. Истинные растворы -это гомогенные однофазные дисперсные системы Растворенное вещество находится в виде молекул или ионов, например: растворы сахара, спирта, мочевины в воде, растворы электролитов и др.
2. Коллоидные системы - это высокодисперсные гетерогенные системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами (пергаментом, перепонкой из бычьего пузыря и др.). Например, почвенные коллоиды, водные растворы серебра, золота, серы, сульфидов металлов.
3. Грубые дисперсии - это системы с размером частиц 10 –5 . К ним относятся суспензии и эмульсии, например: суспензия глины в воде, эмульсия жира в воде (молоко) и др.
Таким образом, коллоидные растворы занимают промежуточное положение - между истинными растворами и грубыми дисперсиями.
Коллоидные растворы обладают своеобразными кинетическими, оптическими и электрическими свойствами. Особые свойства коллоидных систем в значительной мере определяются молекулярными силами, некомпенсированными в поверхностных межфазовых слоях, свойствами и строением этих слоев.
Коллоидные растворы по интенсивности взаимодействия дисперсной фазы со средой (сольватации) делятся на две группы: лиофобные -характеризующиеся слабым взаимодействием частиц дисперсной фазы смолекулами среды, и лиофильные, характеризующиеся сильным взаимодействием с растворителем. Высокодисперсные коллоидные растворы, относящиеся к типу систем т/ж, носят название золей (от лат. solutio – раствор).
Полуколлоидные системы представляют собой растворы смешанного характера, т. е. в одном и том же растворителе одновременно находятся молекулы, ионы и мицеллы различной дисперсности. К лиофильным системам ранее относили и растворы высокомолекулярных соединений, которые в настоящее время выделены в отдельную группу.
Примером растворов высокомолекулярных соединений являются белки, каучук в бензине или бензоле, полиамиды в этиловом спирте, желатин в воде. Исследование свойств этих растворов показало, что они являются гомогенными и равновесными системами. По принятой в настоящее время терминологии их называют истинными растворами высокомолекулярных соединений; но так как они имеют ряд свойств, характерных для типичных коллоидных систем, то их изучают в коллоидной химии.
Гетерогенные высокодисперсные системы обладают резко выраженной поверхностью раздела между фазами, агрегативной и термодинамической неустойчивостью, необратимостью, существуют только в присутствии стабилизатора.
4. Мицелла является наименьшим количеством коллоидного вещества, способным к самостоятельному существованию и определяющим все основные свойства коллоидной системы.
В качестве примера рассмотрим схему строения мицеллы золя хлорида серебра, получаемого при реакции обмена между азотнокислым серебром и хлористым калием в сильно разбавленных растворах:
Для получения устойчивого золя необходимо, чтобы один из электролитов AgNO3 или КС1 присутствовал в избытке в качестве стабилизатора. Согласно экспериментальным данным в присутствии избытка AgNO3 получается золь с положительно заряженными частицами, в случае избытка КС1 –сотрицательно заряженными частицами. Ядро частицы, представ-ляющее собой кристаллик AgCl, адсорбирует на своей поверхности или ионы Ag + в случае избытка AgNO3 , или ионы С1 - в случае избытка КС1, сообщающие частице соответственно положительный или отрицательный заряд. К адсорбированным ионам из раствора притягиваются ионы противоположного знака, причем часть их колеблется на некотором расстоянии, образуя диффузный слой. Ионы стабилизатора, как потенциалоопределяющие, так и противоионы находятся в сольватированном состоянии.

Схема строения мицеллы золя с положительно заряженной - частицей может быть представлена и в виде формулы:
адсорбционный слой диффузный слой
ядро потенциалоопре- противоионы
m - количество молекул в ядре частицы;
n - количество потенциалоопределяющих ионов;
(n - х) - часть противоионов, входящая в адсорбционный слой;
х - количество противоионов, образующих внешний, диффузный слой ионов.
Схема строения мицеллы золя с отрицательно заряженной частицей следующая:
Предметом изучения коллоидной химии являются гетерогенные высокодисперсные системы и высокомолекулярные системы.
Коллоидные системы очень распространены в природе, они имеют большое значение для жизнедеятельности растений и животных. Почва, клеточный сок, белковые вещества, лимфа, кровь- все это коллоидные системы.
Коллоидные системы состоят из дисперсионной среды и дисперсной фазы.В дисперсных системах одна из фаз находится в мелко раздробленном состоянии и распределена в другой, имеющей непрерывное строение. Вещество, находящееся в мелко раздробленном состоянии, называется дисперсной фазой, а вещество, находящееся в виде сплошной массы - дисперсионной средой. По размерам частиц дисперсной фазы дисперсные системы классифицируются на три вида:
1. Истинные растворы -это гомогенные однофазные дисперсные системы Растворенное вещество находится в виде молекул или ионов, например: растворы сахара, спирта, мочевины в воде, растворы электролитов и др.
2. Коллоидные системы - это высокодисперсные гетерогенные системы с хорошо развитой поверхностью раздела между фазами. Их частицы не оседают под действием силы тяжести, проходят через бумажные фильтры, но задерживаются растительными и животными мембранами (пергаментом, перепонкой из бычьего пузыря и др.). Например, почвенные коллоиды, водные растворы серебра, золота, серы, сульфидов металлов.
3. Грубые дисперсии - это системы с размером частиц 10 –5 . К ним относятся суспензии и эмульсии, например: суспензия глины в воде, эмульсия жира в воде (молоко) и др.
Таким образом, коллоидные растворы занимают промежуточное положение - между истинными растворами и грубыми дисперсиями.
Коллоидные растворы обладают своеобразными кинетическими, оптическими и электрическими свойствами. Особые свойства коллоидных систем в значительной мере определяются молекулярными силами, некомпенсированными в поверхностных межфазовых слоях, свойствами и строением этих слоев.
Коллоидные растворы по интенсивности взаимодействия дисперсной фазы со средой (сольватации) делятся на две группы: лиофобные -характеризующиеся слабым взаимодействием частиц дисперсной фазы смолекулами среды, и лиофильные, характеризующиеся сильным взаимодействием с растворителем. Высокодисперсные коллоидные растворы, относящиеся к типу систем т/ж, носят название золей (от лат. solutio – раствор).
Полуколлоидные системы представляют собой растворы смешанного характера, т. е. в одном и том же растворителе одновременно находятся молекулы, ионы и мицеллы различной дисперсности. К лиофильным системам ранее относили и растворы высокомолекулярных соединений, которые в настоящее время выделены в отдельную группу.
Примером растворов высокомолекулярных соединений являются белки, каучук в бензине или бензоле, полиамиды в этиловом спирте, желатин в воде. Исследование свойств этих растворов показало, что они являются гомогенными и равновесными системами. По принятой в настоящее время терминологии их называют истинными растворами высокомолекулярных соединений; но так как они имеют ряд свойств, характерных для типичных коллоидных систем, то их изучают в коллоидной химии.
Гетерогенные высокодисперсные системы обладают резко выраженной поверхностью раздела между фазами, агрегативной и термодинамической неустойчивостью, необратимостью, существуют только в присутствии стабилизатора.
4. Мицелла является наименьшим количеством коллоидного вещества, способным к самостоятельному существованию и определяющим все основные свойства коллоидной системы.
В качестве примера рассмотрим схему строения мицеллы золя хлорида серебра, получаемого при реакции обмена между азотнокислым серебром и хлористым калием в сильно разбавленных растворах:
Для получения устойчивого золя необходимо, чтобы один из электролитов AgNO3 или КС1 присутствовал в избытке в качестве стабилизатора. Согласно экспериментальным данным в присутствии избытка AgNO3 получается золь с положительно заряженными частицами, в случае избытка КС1 –сотрицательно заряженными частицами. Ядро частицы, представ-ляющее собой кристаллик AgCl, адсорбирует на своей поверхности или ионы Ag + в случае избытка AgNO3 , или ионы С1 - в случае избытка КС1, сообщающие частице соответственно положительный или отрицательный заряд. К адсорбированным ионам из раствора притягиваются ионы противоположного знака, причем часть их колеблется на некотором расстоянии, образуя диффузный слой. Ионы стабилизатора, как потенциалоопределяющие, так и противоионы находятся в сольватированном состоянии.
Схема строения мицеллы золя с положительно заряженной - частицей может быть представлена и в виде формулы:
адсорбционный слой диффузный слой
ядро потенциалоопре- противоионы
m - количество молекул в ядре частицы;
n - количество потенциалоопределяющих ионов;
(n - х) - часть противоионов, входящая в адсорбционный слой;
х - количество противоионов, образующих внешний, диффузный слой ионов.
Схема строения мицеллы золя с отрицательно заряженной частицей следующая:
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой . Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой . Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм (1 нм = 10 -9 м) и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Когда речь идет об агрегатном состоянии веществ, то принято выделять четыре основных типа:
Однако большинство биологических сред, жидкостей, природных явлений представляет собой некую смесь из нескольких вариантов. Значительная часть всех растворов обладает особыми свойствами. Они отличаются и внешними признаками, и внутренним строением. Называют их так: коллоидные системы. Это совокупная смесь веществ разной природы, находящихся в разных агрегатных состояниях. Чтобы лучше разобраться в данном вопросе, следует рассмотреть все свойства и характеристики подобных растворов, что мы и сделаем в ходе данной статьи.
Коллоидно-дисперсная система: характеристика
Если говорить простым обыденным языком, то данная система - это нечто среднее между истинным раствором, который является 100% гомогенной средой и грубодисперсными взвесями, в которых четко прослеживается граница раздела фаз.
Вообще коллоидные системы являются частью дисперсных систем, одной из их разновидностей. Поэтому неудивительно, что свойства их во многом схожи. Чтобы лучше представить себе, что же такое описываемое состояние вещества, приведем несколько примеров из жизни.
- Гели и гелеподобные тела. Например, те, что применяются для укладки прически. Также сюда можно отнести гелеобразные и студнеобразные крема, в том числе и кондитерские. Раствор агар-агара, набухший крахмал, раствор куриного белка - все это коллоидные системы. Химия, которая занимается изучением подобных структур, именуется физколлоидной или физической.
- Золи. Другими словами, это деструктурированные гели. Именно они и стоят на границе между грубодисперсными системами и истинными растворами. Примеры данного состояния: туман, дым или пыль в воздухе.
Также можно привести еще несколько общеизвестных соединений, которые считают коллоидами:
- пыль;
- аэрозоль;
- эмульсия;
- суспензия;
- туман и прочие.
Для каждого приведенного примера можно привести свои специфические свойства. Однако существуют и те, что являются для них общими.
Классификация коллоидных систем
Так как разнообразие рассматриваемых соединений велико, то естественно, что имеется их классификация. В основу положены признаки строения - структурированность, размеры дисперсной фазы по отношению к среде и прочие. Если все коллоидные системы разделить на типы по характеру входящих в их состав частиц, то можно выделить основные из них:
- жидкость в газе - туман, например;
- твердые частицы в газовой среде - дым, пыль;
- жидкость в жидкости - различные эмульсии;
- твердые частицы в жидкости - суспензии;
- жидкость в твердом - эмульсии;
- твердые частицы в твердой среде - твердые золи.
Также существует еще один признак, который ложится в основу разделения рассматриваемых систем. Это взаимодействие частиц фазы и среды друг с другом. Классификация коллоидных систем в этом случае принимает следующий вид.
- Лиофильные. Включают в себя те системы, в которых происходит взаимодействие и даже растворение частиц фазы в среде.
- Лиофобные. Не происходит ни взаимодействия между средой и фазой, ни их взаимного растворения.
Если речь идет о такой среде, как вода, то можно эти же группы назвать, соответственно, гидрофильными и гидрофобными.
Еще один вариант подразделения рассматриваемых систем следующий:
- Свободнодисперсные. Это такие, в которых частицы находятся в постоянном движении, взаимодействуют друг с другом и не формируют определенной структуры, то есть находятся в неком хаосе. Примеры: мелкодисперсные суспензии, эмульсии, лиозоли, аэрозоли.
- Связнодисперсные - это коллоидные системы, в которых внутренняя структура четко упорядочена и представляет собой некий молекулярный каркас из среды, заполненный внутри фазой. Примерами могут служить гели, пасты, порошки, густые эмульсии и суспензии.
Возможен самопроизвольный переход золя в гель, этот процесс имеет название гелеобразования. Однако нередко наблюдается и обратный процесс.
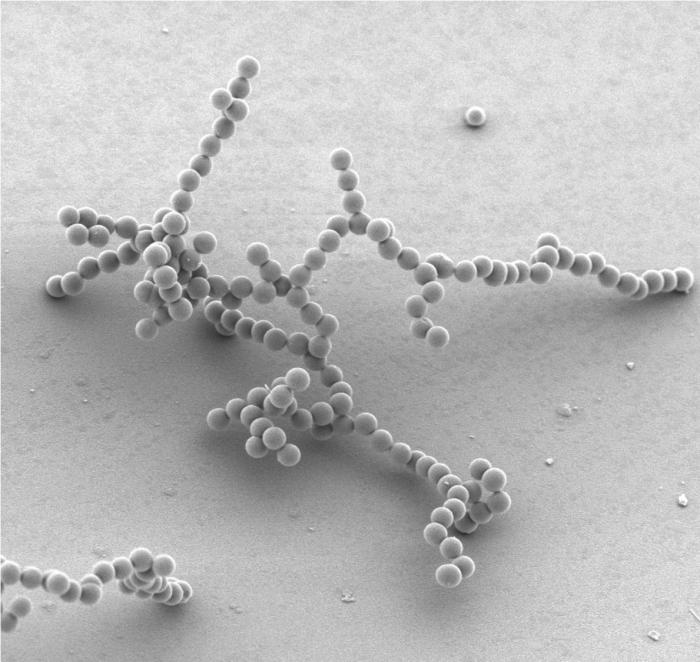
Лиофобные системы: золи
Это такая коллоидная система, фазы которой достаточно четко отделены друг от друга границей раздела. Однако увидеть это сложно, ведь размеры частиц дисперсных - не более 100 нм. Именно поэтому золи - промежуточное состояние между истинными растворами и грубодисперсными составами.
У данных систем есть своя классификация. Их разделяют в зависимости от вида дисперсионной среды. Можно выделить несколько основных вариантов:
- гидрозоли - среда водная;
- алкозоли - спирт;
- этерозоли - эфирная;
- органозоли - более общее обозначение органической природы среды.
Именно для лиозолей (среда - жидкая) характерно такое понятие, как мицелла. Им обозначают фазные частицы в совокупности с внешней сферой - частицами (ионами) окружающей среды. Для любой зольной системы можно записать свое химическое выражение, отражающее ее состав в виде мицеллы.
Пример: красный золь золота с составом NaAuO2 + HCOH + Na2CO3 → Au + HCOONa + H2O имеет мицеллу следующего вида: m· n AuO2 – · (n-x) Na + > x– · xNa + .
Свойства золей можно описать несколькими пунктами:
- Существует граница раздела фаз, у которой сильное поверхностное натяжение.
- Частица фазы и среды находятся в постоянном броуновском движении.
- Частицы способны к агрегации - слипанию и осаждению. Это объясняется их постоянным взаимодействием.
Если же говорить об использовании золей в промышленности, то оно достаточно широко. Если вспомнить, что все аэрозоли, суспензии и эмульсии относятся именно к ним, то становится ясно, что без подобных коллоидных систем не обходятся:
- химическая промышленность;
- фармацевтика;
- военное дело;
- пищевая отрасль и прочие.
При определенных условиях золи могут начать структурироваться. То есть выстраивать внутренний каркас из дисперсных частиц, ячейки в которых будут заполнены молекулами среды. Еще одно название происходящего - коагуляция или слипание. В этом случае говорят о гелеобразовании, так как продуктом станет гель.

Лиофильные системы
Данные структуры образуются благодаря тесному взаимодействию частиц среды и фазы. Это приводит к тому, что они растворяются друг в друге, набухают и образуются студенистые гелеобразные по консистенции соединения. Внутри же они представляют собой трехмерную пространственную сетку, в которой все поры заполняются частицами жидкой или твердой среды. Благодаря такому строению все лиофильные гели обладают следующими свойствами:
- упругость;
- способность сохранять постоянную форму;
- прочность;
- пластичность;
- нетекучесть.
Такие молекулярные коллоидные системы встречаются очень часто. Ведь по своей природе это как высокомолекулярные, так и низкомолекулярные вещества, подвергшиеся воздействию для изменения свойств. Приведем несколько всем известных вариантов:
- косметические гели для бритья, для волос;
- лекарственные препараты - от болей, ушибов, ран и прочего;
- бытовая химия;
- адсорбенты в химической промышленности.
Особое свойство данных веществ - способность самопроизвольно необратимо разрушаться при высушивании. Наверняка многие замечали, что есть обычный гель для волос оставить открытым, то через два-три дня от него останется лишь маленькая сухая масса, непригодная к использованию.
Это происходит из-за разрушения пространственной структуры и испарения влаги. Иногда влагу специально убирают из состава гелей, чтобы получить нужный продукт. Но делается это химическим путем, без разрушения общей структуры. Так получают силикагели, алюмогели.

Особенные и общие свойства коллоидов
Свойства коллоидных систем (или коллоидов) следующие:
- Отличительный внешний вид, особенно если речь идет о гелях, эмульсиях и суспензиях, аэрозолях.
- Особое отношение к проходящему сквозь вещество свету: большинство из них не препятствует этому, а часть (прозрачные) вообще рассеивают направленный пучок.
- Постоянное движение частиц не позволяет в коллоидных системах образовываться осадку.
- Так как среда и фаза могут быть очень разными по отношению друг к другу, то выделить общие физические параметры сложно. Они должны относиться к каждому конкретному веществу.
Если говорить об особых свойствах рассматриваемых состояний веществ, то следует указать на броуновское движение структурных элементов и на эффект Тиндаля, то есть на рассеивание света.
Эффект Тиндаля
Данное явление входит в особые оптические свойства коллоидных систем. Суть его заключается в следующем: пучок света, проходящий через раствор (или аэрозоль) системы, рассеивается. Однако делает это не совсем обычно. Так как способность отражать или поглощать пучки света у всех частиц разная, показатель преломления варьируется, то получается, что можно наблюдать конусообразное пятно на темном фоне.
Этот эффект используется для определения качества, количества и размеров частиц, составляющих данную систему. Впервые методика была разработана и введена в использование Джоном Тиндалем, за что и получила такое название.
Очень простой и доступный опыт в домашних условиях позволит убедиться в наличии данного эффекта. Нужно приготовить раствор куриного белка в воде. Получится типичная лиофильная коллоидная система. Затем пропустить через него лазерный луч и обеспечить позади сосуда темный фон. Таким образом, конус Тиндаля будет виден очень отчетливо, а свет внутри раствора рассеется.

Броуновское движение частиц
Это еще одно особое свойство рассматриваемых систем. Заключается в постоянном движении частиц фазы в среде раствора как газообразной, так и жидкой. Молекулы, атомы, ионы находятся в беспрерывном хаотическом круговороте. Это позволяет коллоиду существовать в неизменном виде. Кроме того, благодаря их одинаковым зарядам слипания между ними не происходит. Это позволяет системе быть достаточно устойчивой.
Это явление характерно лишь для тех частиц, размер которых не превышает 3 мкм. Иначе наступает седиментация раствора.
Способы образования коллоидов
Методы получения коллоидных систем достаточно разнообразны, поскольку и сами системы неодинаковы. Можно выделить несколько наиболее часто применяемых приемов.
- Конденсация.
- Диспергирование.
- Пептизация.
Все эти методы коллоидных систем имеют широкое промышленное значение при работе с ними, при их получении и изучении свойств. Рассмотрим более подробно каждый из них.
Конденсация - это метод, в основе которого лежит способность молекул и ионов ассоциироваться друг с другом, слипаться, образуя более крупные частицы. Таким образом, формируется новая система, чаще всего обладающая свойствами коллоида. Сделать это можно двумя путями:
- заменой растворителя (то есть среды);
- химической конденсацией, то есть рядом последовательных взаимодействий, приводящих к укрупнению частиц.
И в том, и в другом случае получаются настоящие коллоиды, в которых твердые частицы удерживаются броуновским движением во взвешенном состоянии.
Диспергирование, напротив, заключается в измельчении фазового компонента смеси до того состояния, когда раствор станет коллоидом. Делают это несколькими способами:
- механическим дроблением;
- электродуговым распылением;
- измельчением ультразвуком и прочее.
Пептизация - химическое расщепление слипшихся коагулированных частиц на более мелкие структуры. Таким способом получают растворы в промышленности. При этом обязательное участие принимают специфические агенты - пептизаторы.

Условия устойчивого состояния
Устойчивость коллоидных систем требует определенных условий. Ведь мы уже говорили, что с течением времени они могут разрушаться, иногда необратимо. Особенно это касается лиофобных систем - золей. Поэтому существуют методы, позволяющие сохранить и повысить устойчивость коллоидов:
- Добавление специальных антикоагулянтов - стабилизаторов.
- Введение постоянных и временных электролитов для изменения значения электродного потенциала участников системы.
Остальные способы являются узкоспецифичными для каждого конкретного коллоида, когда учитываются все свойства раствора.
Распространение и значение коллоидных систем
Встретиться с коллоидами можно как в химической лаборатории, так и в природе. Известно, что практически все внутренние биологические вещества живого организма представляют собой именно такие дисперсные системы. Например:
- цитоплазма;
- строма;
- костный мозг и прочие.
Среди строительных материалов очень много именно коллоидных систем, которые обладают хорошими техническими характеристиками. Это бетон, металлические сплавы, глиносодержащие соединения, пены, аэрозоли и так далее.
Фармацевтика вообще невозможна без коллоидов. Все пасты, мази, гели, суспензии и эмульсии - это лекарственные средства, представляющие собой рассматриваемые нами системы. Поэтому переоценить значение и распространение коллоидов сложно, они одни из самых распространенных и широко используемых видов агрегатного состояния вещества.

Раство́р — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия
Содержание
Твердые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое вещество, например раствор соли или спирта в воде (или даже раствор золота в ртути — амальгама).
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
Раствором именуют и смесь цемента с водой, песком и т.д. Хотя это и не является раствором в химическом смысле этого слова.
Истинные и коллоидные растворы
Коллоидные и истинные растворы (изучением коллоидных систем занимается коллоидная химия) отличаются главным образом размерами частиц.
В истинных растворах размер частиц менее 1·10 −9 м, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1·10 −9 м — 5·10 −7 м, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (см. эффект Тиндаля).
Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда - цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворенного вещества сильно меняются и химические свойства - например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.
См. также
Растворы электролитов и неэлектролитов
Электролиты при растворении в подходящих растворителях (вода, другие полярные растворители) диссоциируют на ионы. Сильное физико-химическое взаимодействие при растворении приводит к сильному изменению свойств раствора (химическая теория растворов).
См. также
Растворы полимеров
Растворы высокомолекулярных веществ ВМС — белков, углеводов и др. обладают одновременно многими свойствами истинных и коллоидных растворов. Средняя молекулярная масса растворенного
Концентрация растворов
В зависимости от цели для выражения концентрации растворов используются разные единицы измерения — весовой и объёмный процент, молярность, моляльность, г/л, мольная доля и др.
Мнемонические правила
В случаях приготовления растворов сильных кислот согласно правилам техники безопасности кислоту нужно лить в воду, но ни в коем случае не наоборот. Для запоминания этого лабораторного приема существует несколько мнемонических правил:
Сначала вода,
Потом кислота,
Иначе случится
Большая беда
- Не плюй в кислоту!
- Чай с лимоном (здесь нужно представить, как в чай Вы кладете дольку лимона).
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Коллоидный раствор" в других словарях:
коллоидный раствор — коллоидная дисперсия золь — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом Синонимы коллоидная дисперсиязоль EN colloidal solution … Справочник технического переводчика
коллоидный раствор — Colloid Solution Коллоидный раствор Раствор, размер частиц которого составляет от 10 9 до 5х10 7 м (1 500 нм). Отличается от истинного раствора (размер частиц менее 10 9 м), как правило, непрозрачен. Выделяют коллоидные растворы газа в… … Толковый англо-русский словарь по нанотехнологии. - М.
коллоидный раствор — koloidinis tirpalas statusas T sritis fizika atitikmenys: angl. colloidal solution vok. kolloide Lösung, f rus. коллоидальный раствор, m; коллоидный раствор, m pranc. solution colloïdale, f … Fizikos terminų žodynas
коллоидный раствор — Термин коллоидный раствор Термин на английском colloidal solution Синонимы дисперсная система, золь, colloidal system Аббревиатуры Связанные термины двойной электрический слой, диализ, золь, коагуляция, коллоидная химия, кристаллоид, критическая… … Энциклопедический словарь нанотехнологий
коллоидный раствор — koloidinis tirpalas statusas T sritis chemija apibrėžtis Koloidinė sistema, kurios disperguojančioji terpė – skystis. atitikmenys: angl. colloidal solution rus. коллоидный раствор … Chemijos terminų aiškinamasis žodynas
коллоидный раствор — коллоид … Cловарь химических синонимов I
КОЛЛОИДНЫЙ РАСТВОР КРЕМНЕЗЕМА — коллоидный кремнезем, кремнезоль высокодисперсный SiO2 (5 15 нм), стабилизированные в воде соединения щелочных металлов. Содержание SiO2 15 50%; плотность 1088 1202 кг/м3; рН при 20° С 9,5 10,6; удельная поверхность частиц SiO2 … Металлургический словарь
КОЛЛОИДНЫЙ — КОЛЛОИДНЫЙ, коллоидная, коллоидное (хим.). прил. к коллоид. Коллоидный раствор. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Читайте также:

