Каково значение болевых рецепторов кратко
Обновлено: 05.07.2024
Ярослав Алексеевич Андреев — кандидат биологических наук, старший научный сотрудник лаборатории нейрорецепторов и нейрорегуляторов отдела молекулярной нейробиологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Научные интересы связаны с поиском и характеристикой модуляторов болевых рецепторов.
Юлия Александровна Логашина — младший научный сотрудник той же лаборатории. Занимается поиском и характеристикой новых лигандов TRPA1 рецептора.
Ксения Игоревна Лубова — студентка биологического факультета Московского государственного университета им. М. В. Ломоносова. Изучает TRP рецепторы и их модуляторы.
Александр Александрович Василевский — кандидат химических наук, руководитель группы молекулярных инструментов для нейробиологии отдела молекулярной нейробиологии Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Специалист в области ионных каналов и природных токсинов.
Сергей Александрович Козлов — доктор химических наук, руководитель лаборатории нейрорецепторов и нейрорегуляторов того же отдела. Область научных интересов — белковые рецепторы в нервной системе и их лиганды.
Говорят, что жизнь — это боль. Хотя в этой фразе содержится нечто негативное, связанное с неприятными ощущениями, переживаниями или даже тяжелыми страданиями, не стоит забывать, что боль (ноцицепция) предупреждает нас об опасности — сигнализирует о нарушениях в организме, который немедленно принимается их устранять. Вместе с тем существует и боль, которая приносит только мучения.
Основная причина появления такой боли — сбои в передаче болевых сигналов (нервных импульсов) от чувствительных нейронов к головному мозгу, который и формирует неприятные ощущения. Когда воздействие неопасных стимулов распознающие нейроны расценивают как опасное, развивается состояние, которое называется гиперчувствительностью. И это не всегда плохо, так как в нужный момент она играет важную роль в процессе выздоровления и восстановления организма. Однако бывает и так, что реального повода нет, а гиперчувствительность ведет к изнурительной хронической боли. В таком случае самые обычные безобидные стимулы (легкое прикосновение или тепло) вызывают аллодинию (от греч. άλλος — другой и οδύνη — мучение), а болезненные стимулы — боль еще большей интенсивности, гиперальгезию (от греч. ὑπέρ — сверх- и ἄλγος — боль). Часто аномально интенсивная и нередко хроническая боль, которая изматывает и физиологически, и психологически, а также затрудняет выздоровление, возникает в результате таких заболеваний, как артрит, опоясывающий лишай, СПИД, рак костей и др.
Прежде чем винить в аномалиях чувствительные нейроны (ноцицепторы), которые воспринимают, анализируют и передают болевые сигналы, разберемся, как они работают в здоровом организме и что происходит при патологиях.
Почему так больно?
Болевые сенсоры (или рецепторы) — это мембранные белки, которые распознают физическое или химическое воздействие на мембрану нейрона. При этом они являются катион-селективными ионными каналами, то есть обеспечивают проведение положительно заряженных ионов (натрия, калия, кальция) через клеточную мембрану. Активация рецепторов приводит к открытию катионных каналов и возбуждению чувствительных нейронов — возникновению нервного импульса. Подробнее о наиболее изученных болевых рецепторах мы расскажем ниже.
Описанная схема развития боли сильно упрощена (рис. 1). На самом деле, чтобы разобраться в деталях ноцицепции, ученые исследуют каждый рецептор отдельно в изолированных условиях. Эксперименты проводят на клеточных линиях, в которые методами генной инженерии встраивают гены определенных рецепторов. Расскажем немного об изучении и функциях нескольких наиболее важных болевых рецепторов. Как оказалось, они не всегда ориентированы на распознавание и генерацию болевого сигнала, но вовлечены в регуляцию многих других процессов, поэтому умение корректировать их работу различными лекарственными препаратами поможет лечить разнообразные болезни (рис. 2).
Рис. 2. Заболевания человека, при которых установлена неправильная работа болевых рецепторов
Рецепторы температуры и химических раздражителей
Исследования TRPV1 привели к интенсивному изучению подобных рецепторов. Так, был обнаружен еще один ванилоидный рецептор — TRPV3. Интересно, что он реагирует как на приятное тепло, так и на болезненный жар: активность TRPV3 регистрируется при температуре выше 33°C, причем его ответ сильнее на более высокую температуру и возрастает при повторяющейся тепловой стимуляции. Помимо температуры, этот рецептор также активируется камфорой, едкими экстрактами тимьяна, орегано и гвоздики. TRPV3 — еще один кандидат на роль участника в болевой гиперчувствительности, его активность регулируется медиаторами воспаления. Наконец, он напрямую активируется оксидом азота II (NO) — вторичным мессенджером, обеспечивающим увеличение чувствительности нейронов к стимуляции. Также следует отметить наличие TRPV3 в клетках кожи кератиноцитах, где его активация приводит к выбросу воспалительного медиатора интерлейкина-1, что подчеркивает важную роль этого рецептора в воспалительных заболеваниях кожи [6].
TRP-рецепторы — тетрамеры (рис. 3), то есть образованы четырьмя полипептидными цепочками. При этом могут собираться как гомомеры, то есть рецепторы, сформированные одинаковыми цепочками (например, TRPV1 или TRPV3, описанные выше), так и гетеромеры из разных цепей. Гетеромерные рецепторы (например, построенные из цепочек TRPV1 и TRPV3) обладают различной чувствительностью к тепловым стимулам, пороговая температура их активации лежит между значениями, пороговыми для гомомерных рецепторов.
Основная функция TRPA1 — распознавание химических и воспалительных агентов, и их ассортимент столь велик, что с правильной работой этого рецептора связаны почти все жизненные процессы нашего организма. В дыхательной системе он распознает летучие вредные вещества: слезоточивый газ, озон, альдегиды (акролеин, компоненты корицы), сераорганические соединения (жгучие компоненты горчицы, лука и чеснока), вызывая кашель, чихание и образование слизи. В кишечнике TRPA1 регистрирует присутствие воспалительных агентов. Гиперактивность мочевого пузыря при диабете вызвана активацией этого рецептора акролеином, который накапливается в моче. Выявлено участие TRPA1 в возникновении мигрени под влиянием сигаретного дыма и формальдегида у некоторых людей [11].
Воздействие на рецепторы чувствительных нейронов, участвующие в восприятии температуры, с помощью лекарственных средств приводит к облегчению боли и воспаления. Именно так, не зная о молекулярных мишенях, народная медицина в разное время применяла настойки перца (TRPV1), горчицы (TRPA1), мяты (TRPM8) и гвоздики (TRPV3) для лечения ряда воспалительных заболеваний.
Пуриновые рецепторы
Мы уже упоминали, что организму очень важно знать о повреждении тканей. При травмах, когда нарушается целостность органов и происходит гибель клеток, при ишемии или воспалении в межклеточное пространство попадают молекулы АТФ. Этот кофермент множества реакций обеспечивает энергией многие процессы в клетке; он слишком ценен для функционирования клеток, поэтому редко выбрасывается за их пределы. Восприятие повышения локальной концентрации АТФ осуществляют пуринергические рецепторы (P2X), являющиеся катион-селективными ионными каналами, они запускают болевой ответ, возникающий вследствие разрушения тканей, деформации органов и развития опухолей [12]. Для чувствительных нейронов характерны подтипы P2X2 и P2X3, важная роль последнего в развитии боли при воспалении показана в исследованиях на нокаутных мышах. Также известно, что P2X-рецепторы имеют принципиальное значение для многих физиологических процессов, таких как регуляция тонуса сосудов, вкусовая рецепция и т.д.
Рецепторы кислоты
В отличие от TRP-рецепторов, P2X-рецепторы и ASIC являются тримерами (рис. 3), т.е. собраны из трех полипептидных цепочек. Но точно так же эти рецепторы могут быть гомомерами и гетеромерами, что увеличивает их разнообразие и спектр выполняемых функций.
Как победить боль?
Так что же делать, если мы испытываем боль? Если это боль острая или хроническая, терпеть ее нельзя, и необходимо использовать обезболивающие средства, чтобы вернуть нашу систему ноцицепции в нормальное состояние, а себя — к жизни в самом прямом смысле этого слова. В настоящее время для обезболивания применяется множество лекарственных препаратов различных фармакологических групп. Основное место в этом ряду занимают нестероидные противовоспалительные средства (НПВС), антиконвульсанты и антидепрессанты, а также наркотические анальгетики (морфин и другие опиаты и опиоиды). Имеющиеся в настоящее время анальгетические средства влияют главным образом на пути передачи и распространения боли. Для специфичного регулирования рецепторов боли, описанных выше, пока препаратов на рынке лекарств нет.
Рецепторы чувствительных нейронов представляют собой заманчивую, но сложную мишень для создания лекарств. Препараты, если они обладают хорошей селективностью к этим рецепторам, будут приняты потребителями с большой радостью, так как почти все современные средства ограничены в применении из-за побочных эффектов. Работы по поиску селективных препаратов ведутся, в том числе и в нашей стране, и при благоприятном стечении обстоятельств такие лекарства уже скоро смогут появиться в аптеках. Долгих вам лет жизни без боли!
Работа выполнена при поддержке Российского научного фонда (проект № 14-24-00118).
Литература
1. Palermo N. N., Brown H. K., Smith D. L. Selective neurotoxic action of capsaicin on glomerular C-type terminals in rat substantia gelatinosa // Brain Res. 1981. V. 208. P. 506–510.
2. O’Neill J., Brock C., Olesen A. E. et al. Unravelling the mystery of capsaicin: a tool to understand and treat pain // Pharmacol. Rev. 2012. V. 64. P. 939–971.
3. Andreev Y. A., Vassilevski A. A., Kozlov S. A. Molecules to selectively target receptors for treatment of pain and neurogenic inflammation // Recent Pat. Inflamm. Allergy Drug Discov. 2012. V. 6. P. 35–45.
4. Caterina M. J., Schumacher M. A., Tominaga M. et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway // Nature. 1997. V. 389. P. 816–824.
5. Caterina M. J., Leffler A., Malmberg A. B. et al. Impaired nociception and pain sensation in mice lacking the capsaicin receptor // Science. 2000. V. 288. P. 306–313.
6. Nilius B., Bíró T., Owsianik G. TRPV3: time to decipher a poorly understood family member! // J. Physiol. 2014. V. 592. P. 295–304.
7. Tsavaler L., Shapero M. H., Morkowski S., Laus R. Trp-p8, a novel prostate-specific gene, is up-regulated in prostate cancer and other malignancies and shares high homology with transient receptor potential calcium channel proteins // Cancer Res. 2001. V. 61. P. 3760–3769.
8. McKemy D. D. The molecular and cellular basis of cold sensation // ACS Chem. Neurosci. 2013. V. 4. P. 238–247.
9. Zygmunt P. M., Högestätt E. D. TRPA1 // Handb. Exp. Pharmacol. 2014. V. 222. P. 583–630.
10. Kremeyer B., Lopera F., Cox J. J. et al. A gain-of-function mutation in TRPA1 causes familial episodic pain syndrome // Neuron. 2010. V. 66. P. 671–680.
11. Benemei S., Fusi C., Trevisan G., Geppetti P. The TRPA1 channel in migraine mechanism and treatment // Br. J. Pharmacol. 2014. V. 171. P. 2552–2567.
12. Surprenant A., North R. A. Signaling at purinergic P2X receptors // Annu. Rev. Physiol. 2009. V. 71. P. 333–359.
13. Xiong Z. G., Zhu X. M., Chu X. P. et al. Neuroprotection in ischemia: blocking calcium-permeable acid-sensing ion channels // Cell. 2004. V. 118. P. 687–698.
14. Осмаков Д. И., Андреев Я. А., Козлов С. А. Кислоточувствительные рецепторы и их модуляторы // Успехи биол. химии. 2014. Т. 54. С. 231–266.
15. Andreev Y. A., Kozlov S. A., Koshelev S. G. et al. Analgesic compound from sea anemone Heteractis crispa is the first polypeptide inhibitor of vanilloid receptor 1 (TRPV1) // J. Biol. Chem. 2008. V. 283. P. 23914–23921.
16. Козлов С. А., Андреев Я. А., Мурашев А. Н. и др. Новые полипептидные компоненты с анальгетической активностью из морской анемоны Heteractis crispa // Биоорг. химия. 2009. Т. 35. С. 789–798.
17. Andreev Y. A., Kozlov S. A., Korolkova Y. V. et al. Polypeptide modulators of TRPV1 produce analgesia without hyperthermia // Mar. Drugs. 2013. V. 11. P. 5100–5115.
18. Grishin E. V., Savchenko G. A., Vassilevski A. A. et al. Novel peptide from spider venom inhibits P2X3 receptors and inflammatory pain // Ann. Neurol. 2010. V. 67. P. 680–683.
19. Osmakov D. I., Kozlov S. A., Andreev Y. A. et al. Sea anemone peptide with uncommon β-hairpin structure inhibits acid-sensing ion channel 3 (ASIC3) and reveals analgesic activity // J. Biol. Chem. 2013. V. 288. P. 23116–23127.
20. Gao Y., Cao E., Julius D., Cheng Y. TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action // Nature. 2016. V. 534. P. 347–351.
21. Baconguis I., Bohlen C. J., Goehring A. et al. X-ray structure of acid-sensing ion channel 1-snake toxin complex reveals open state of a Na + -selective channel // Cell. 2014. V. 156. P. 717–729.

Обзор
Они знают, что такое боль.
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Какая бывает боль?

Классификация боли, предложенная Клиффордом Вульфом [1], включает в себя четыре типа: ноцицептивная, воспалительная, невропатическая и функциональная. Кроме того, стоит отметить и психогенную боль.
Эпизод I: Пойманная угроза
Чтобы определить любой сигнал, наш организм использует внушительный арсенал белков-рецепторов. Их задача заключается в том, что они реагируют на строго определенный внешний фактор и передают сигнал об этом связывании при помощи конформационных изменений [2], влекущих за собой и изменение биохимических свойств этого рецептора. Переданные от рецептора сигналы усиливаются каскадом белковых взаимодействий в клетке, могут передаваться с помощью нервной или эндокринной систем и, в конечном итоге, приводят к физиологическому ответу.
Нейроны, работающие в ноцицептивной системе, различаются по набору рецепторов. Среди этих нейронов выделяются четыре группы: несущие рецепторы температуры, химического воздействия, механического воздействия и полимодальные (с рецепторами всех раздражителей).
Одни из важнейших рецепторов, реагирующих на тепло, — белки группы TRP. Это ионные каналы, неспецифичные к катиону, — при открытии они пропускают в клетку натрий, магний и кальций, в результате чего в клетке возникает потенциал действия, необходимый для передачи нервного импульса. Этих доблестных воинов термочувствительности несколько: TRPV1–TRPV4 и TRPM8. Первые активируются при повышенной температуре, второй же реагирует на холод. Эти каналы обладают интересной особенностью — помимо температуры, они могут активироваться химическими стимулами.
Биохимические механизмы этой активации отличаются от температурной, но в мозге возникают в ответ на эти химические стимулы практически те же ощущения, что и на изменение температуры. А теперь вспомните, какие продукты питания вызывают ощущение обжигания, а какие — холода? Думаю, почти каждый читатель сталкивался с этими продуктами. Острота перца чили обусловлена тем, что содержащийся в нем капсаицин активирует рецептор TRPV1 (такие вещества называются агонистами) [3]. А ментол, содержащийся в мяте, — агонист TRPM8, и вызывает чувство прохлады (рис. 2) [4].

Но если можно с помощью небольших молекул заставить нас чувствовать эффект ноцицепции, то, может, с помощью других молекул можно этот рецептор заблокировать? Да! Разработка антагонистов TRPV1 [3], которые, блокируя рецептор, могут снижать болевые ощущения, например, от капсаицина, ведется с 1990-х годов, однако большинство препаратов пока не достигли рынка (рис. 3). Интересно, что эти препараты предлагается применять для лечения невропатической боли, то есть той, когда рецепторы активируются без внешней причины. Достигнут ли фармкомпании успеха — покажет время.

Рисунок 3. Один из первых разработанных антагонистов TPRV1 — капсазепин. Этот препарат находится сейчас на стадии клинических испытаний. Вообще, успех подобного рода лекарств может стать новой вехой в истории фармакологии анальгетиков — блокирование ноцицепторов вместо ослабления болевого импульса на более поздних стадиях.
Механоноцицепторы — куда более разнородная и многообразная группа рецепторов, чем терморецепторы. Среди них стоит отдельно выделить рецепторы, активируемые, помимо давления, сигнальным олигопептидом брадикинином. Его рецептор В-1 синтезируется в поврежденных клетках — например, при получении травмы. Связывая брадикинин, он активирует сигнальный каскад, приводящий к возникновению боли. Интересно, что в число прямых эффектов от связывания рецептора входит усиление воспаления — то есть поддержание стимула для дальнейшей активации болевых рецепторов: чем больше боли, тем больше боли. Поэтому частая активация В-1 (например, постоянным воспалением при аутоиммунных заболеваниях) может стать причиной развития хронической боли [5].
Рецепторы, воспринимающие различные химические раздражители (ирританты), тоже разнообразная, а местами малоизученная группа. Среди них особо примечателен член уже знакомого нам семейства TRP — TRPA1. Этот рецептор активируется совершенно разными молекулами, зачастую, вступая с ними в реакцию, что приводит к необратимости эффекта. В числе широко известных ирринантов, активирующих TRPA1, — аллилизоцианат, содержащийся в знаменитой японской приправе васаби, и аллицин, содержащийся в чесноке (рис. 4).

Рисунок 4. Вкус васаби сильно отличается от чесночного, однако за восприятие остроты этих приправ отвечает один рецептор — TRPA1. Серосодержащие летучие вещества этих растений способны активировать рецептор и дальнейшую ноцицептивную передачу. Эти агенты пригождаются ученым при изучении химических основ работы рецепторов.
Отдельно стоит упомянуть боль, возникающую при воспалении. Ключевое вещество, на которое реагируют ноцицепторы, — гистамин, который некоторые клетки нашей иммунной системы (например тучные) выбрасывают в кровь в ответ на стимулы к воспалению. Гистамин связывается со своими рецепторами (из семейства GPCR). Активация гистаминового рецептора 1 типа (H1) приводит к активации фосфолипазы С (PLC) и гидролизу фосфатидилинозитолбисфосфата (PIP2) с образованием инозитолтрифосфата (IP3), который затем запускает высвобождение Ca 2+ из эндоплазматической сети. Кальций, связавшись с кальмодулином, активирует протеинкиназу С, которая, при помощи дальнейшего фосфорилирования регуляторных киназ, подавляет экспрессию потенциал-зависимых калиевых каналов 7 типа (Kv1.7), что приводит к деполяризации мембраны и проведению болевого импульса [7]. Интересно, что гистаминовые рецепторы 3 типа, которые локализованы в ЦНС, могут ингибировать проведение определенных ноцицептивных импульсов [8].
Стоит отметить, что другие активные игроки воспалительного процесса — простагландины — действуют похоже: в результате связывания простагландина Е2 с рецептором PTGER2 активируется протеинкиназа А, которая, в свою очередь, увеличивает экспрессию уже знакомого нам TRPV1 [9].
Эпизод II: Атака нервных волокон | Кондукция
Aβ-волокна работают еще быстрее (30–100 м/с) и сильно миелинизированы. Механорецепторы, расположенные в этих волокнах, крайне чувствительны, поэтому функция этих волокон — проведение сигналов о слабых раздражителях. Избыточная активация волокон Aβ вызывает аллодинию — боль, возникающую от причин, обычно ее не вызывающих, — например, от сидения на стуле.
Волокна типа C проводят нервный импульс медленно (0,5–2 м/с); в основном это сигналы от высокочувствительных механорецепторов и хеморецепторов.
Волокна C и Aδ работают синергично, обеспечивая основную массу болевых ощущений.
Эпизод III: Месть эндорфинов
Сигнал о боли достиг нейронов задних рогов спинного мозга, и уже очень скоро будет жарко. Хотя постойте, может, можно что-нибудь сделать? Может, сигнал несет организму чрезмерные страдания, превышающие пользу? А может, наоборот, сигнал недостаточен для осознания всей беды? В спинном мозге происходит модуляция ноцицептивного сигнала. Это поле для нейрохимической битвы двух сил — тормозящей и усиливающей.
По своей природе опиоидные рецепторы тоже являются GPCR, однако — ингибиторными. Будучи активированными, они подавляют работу аденилатциклазы, снижают уровень внутриклеточного цАМФ и, через киназных посредников активируют работу калиевых каналов, которая приводит к реполяризации клеточной мембраны. В конечном итоге эти меры замедляют проведение нервного импульса.
Кроме описанной системы, в ослаблении боли принимают участие всем известные тормозные нейромедиаторы — гамма-аминомаслянная кислота (ГАМК) [11] и глицин [12]; а опосредованно — многие другие сигнальные молекулы.
Одним из очень интересных модуляторов боли является субстанция Р. Это олигопептидный нейромедиатор, связывающийся с метаботропными рецепторами нейрокинина (NKR). NK1R, являясь уже знакомым нам GPCR, вызывает каскад реакций фосфорилирования через протеинкиназу С. В результате в клетке возрастает экспрессия генов натриевого канала Nav1.8, а в нейроне-ноцицепторе увеличивается синтез и наших старых знакомых — NMDA и TRPV1. Кроме того, субстанция Р снижает активность низкопорогового калиевого канала (Kv1.4) в чувствительных к капсаицину нейронах спинального ганглия и, таким образом, сенсибилизирует ноцицепторы. Интересно, что знаменитые грызуны-долгожители — голые землекопы [14] — практически не имеют в ЦНС субстанции Р, благодаря чему становятся нечувствительными ко многим видам боли [15].
То, в каком виде сигнал дойдет до головного мозга, определяется балансом между противоборствующими сторонами и силой изначального сигнала.
Часть IV: Новая проекция
В сером веществе спинного мозга различают 10 слоев (пластин Рекседа), каждый из которых отличается от других функционалом входящих в его состав нейронов, и, как следствие, — выполняемыми функциями. Чтобы нервный импульс попал на кору больших полушарий, сначала он должен пройти по восходящим путям этих пластин.
Синапс волокон Aδ и C со вторичными афферентными нейронами находится в дорсальном роге спинного мозга. Волокна Aδ и C передают информацию ноцицептивно-специфическим нейронам в I и II пластинах. Кроме того, импульс проецируется и на нейроны других пластин. Это нужно для того, чтобы впоследствии задействовать вторичные системы реакции мозга на боль (благодаря этому боль запоминается).
После того, как импульс проходит модуляцию в задних рогах, он передается нейронам восходящих трактов спинного мозга, каждый из которых имеет определенную функцию в распознавании боли.
Наиболее важны среди них спиноталамический тракт, участвующий в узнавании боли, спинопарабрахиальный тракт, участвующий в вегетативной и мотивационной регуляции реакции на боль, и спиномезенцефалический тракт, участвующий в активации нисходящих анальгетических путей, о действии которых мы говорили раньше.
Часть V: Головной мозг наносит ответный удар
Обработка информации о боли в головном мозге — самая разнообразная и индивидуальная для каждого человека часть работы ноцицепторной системы.
Стоит отметить, что у боли есть два разных компонента, за восприятие которых отвечают разные области мозга. Сенсорно-дискриминационные аспекты включают силу боли и ее локализацию, в то время как аффективно-эмоциональный компонент боли включает неприятный характер восприятия.
Для того чтобы мозг правильно локализовал источник боли, нервный импульс затем обрабатывается соматосенсорной корой.
Часть VI: Возвращение к наболевшему
Дано понятие ноцицептивной боли. Описаны чувствительные нервы, иннервирующие мышцу, расположение болевых рецепторов мышц. Также описаны факторы, приводящие к активации болевых рецепторов мышц: механическая травма, нарушение целостности кровеносных сосудов и мышечных волокон, повышенная концентрация ионов водорода.
Болевые рецепторы мышц (ноцицепторы)
Понятие о ноцицептивной боли
Боль – особый вид чувствительности, связанный с действием патогенного раздражителя и характеризующийся субъективно неприятными ощущениями. Также боль характеризуется существенными изменениями в организме вплоть до серьезных нарушений его жизнедеятельности и даже смерти.
Ноцицептивной называют боль, обусловленную воздействием какого-либо фактора (механическая травма, ожог, воспаление и т.д.) на периферические болевые рецепторы при отсутствии повреждений других отделов нервной системы.
Чувствительные нервы и рецепторы
Нервы, иннервирующие мышцы, помимо двигательных (эфферентных) содержат четыре типа чувствительных (афферентных) волокон. Три типа чувствительных волокон имеют миелиновую оболочку и относятся к волокнам типа A. Четвертый тип чувствительных волокон не имеет миелиновой оболочки. Он относится к чувствительным волокнам типа С (С-волокна). Количество С-волокон в 2,5 раза превышает число миелинизированных волокон.
За болевую чувствительность отвечают чувствительные волокна типа Аδ и С-волокна. Эти волокна возбуждаются только при очень сильной болевой стимуляции. При их блокаде болевая чувствительность полностью исчезает. Окончания волокон Аδ и С представляют собой болевые рецепторы. Эти волокна иннервируют кожу, глубокие ткани, внутренние органы и мышцы.
Расположение болевых рецепторов мышц (ноцицепторов)
Болевые нервные окончания расположены в организме неравномерно. Они, как сетью, покрывают весь кожный покров. В мышцах они присутствуют в меньшем количестве. Болевые рецепторы мышц расположены диффузно между мышечными волокнами, в соединительно-тканных оболочках, окружающих мышечные волокна и мышцу в целом и в области мышечно-сухожильного соединения. Они проводят болевые импульсы от мышцы по Аδ-волокнам и С-волокнам к коре больших полушарий, где повышение импульсной активности от ноцицепторов воспринимается как чувство боли.
Активация ноцицепторов мышц
Мышечные ноцицепторы легко возбуждаются интенсивным повреждающим механическим воздействием. Активацию и повышение чувствительности болевых рецепторов расположенных между мышечными волокнами и в сухожилии могут вызывать разнообразные патофизиологические состояния. Наиболее известный вариант – острая травма.
Активация болевых рецепторов мышц может быть обусловлена не только механическим путем, но и нарушением целостности кровеносных сосудов и мышечных волокон. В результате этого происходит увеличение концентрации в ткани эндогенных веществ, вызывающее повышение чувствительности ноцицепторов. К веществам, вызывающим чувство жжения и боли, относят высокую концентрацию ионов водорода (Н + ). Известно, что при выполнении силовых упражнений, направленных на гипертрофию мышечных волокон в них накапливается лактат и повышается концентрация ионов водорода. Это является одной из причин, вызывающей болезненные ощущения в мышцах.
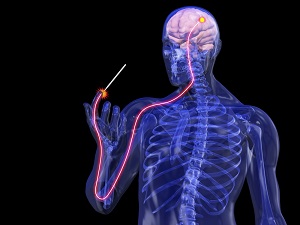
Все люди рано или поздно сталкиваются с болью, но мало кто знает где и как формируется болевое ощущение.
В данной статье нам хотелось бы приоткрыть завесу тайны механизмов передачи боли.
Как мы чувствуем боль? Давайте на минутку представим себе, что кто-то, конечно же, не Вы, порезал палец острым кухонным ножом. По какому же пути необходимо пройти болевому импульсу от поврежденного пальца, чтобы достигнуть головного мозга, где в конечном итоге и формируется ощущение боли?
Болевые рецепторы, находящиеся в коже в результате травмы активируются, благодаря выходу из поврежденных клеток различных химических веществ, таких как гистамин, субстанцию Р, серотонин (5HT), брадикинин и простагландины.
Болевые импульсы, генерируемые этими рецепторами, передаются затем по чувствительным спинномозговым (сенсорным) нервам, клеточные тела которых сгруппированы в небольшое образование, именуемое спинномозговым ганглием (узлом).
Поступившие в спинной мозг болевые импульсы обрабатываются в заднем роге, после чего ответно формируются импульсы, летящие через двигательные нервы к мышцам руки, приводя к её быстрому отдергиванию от повреждающего агента, в данном случае лезвия ножа. Такую основу имеет под собой безусловный (автоматический) рефлекс, не требующий участия головного мозга, или сознательной деятельности.
В зависимости от функционального состояния заднего рога спинного мозга (см. о воротной теории боли и феномене сенситизации заднего рога ниже), болевые сигналы вместе с тем направляются вверх по спино-таламическому пути спинного мозга к специфической структуре головного мозга, называемой таламус.
В дальнейшем, таламус, обработав посупившие к нему импульсы, отправляет специфические сигналы в центры, контролирующие кровяное давление, пульс, дыхание и эмоции. Вот почему в случае остро возникшей боли происходит учащение сердцебиения и дыхания, повышается кровяное давление, а также происходят знакомые всем нам эмоциональные и поведенческие изменения: появляется болезненная гримаса, человек дует на поврежденный палец или быстро трясет им в воздухе.
Между тем, болевые импульсы не останавливаются в таламусе, а передаются дальше в первичную сенсорную кору – специфическую область полушарий головного мозга, где происходит конечная обработка полученных сигналов.
Принято считать, что в таламусе все же происходит частичное восприятие поступающих болевых импульсов, однако их наиболее тонкая дискриминация (распознавание), происходит в первичной сенсорной коре полушарий головного мозга.
Важно отметить, что сперва, сразу после воздействия болевого раздражителя, формируется острое, с мгновенным началом, кратковременное болевое ощущение, передаваемое от области повреждения к задним рогам спинного мозга по толстым быстропроводящим сенсорным (чувствительным) волокнам - А-дельта волокнам.
За ним следует тупая, имеющая медленное начало, более длительная боль, передающаяся от травмированного участка в задний рог по волокнам меньшего диаметра с низкой скоростью проведения - C волокнам. Почему это важно? Предлагаем Вам ознакомиться с воротной теорией боли.
Воротная теория боли
Почему, получив то или иное повреждение мы незамедлительно потираем травмированный участок?
Потирание поврежденного участка приводит к возбуждению тактильных рецепторов (реагирующих на прикосновение) кожи, которые активируются и начинают посылать импульсы в задний рог спинного мозга через А-бета волокна. Эти сигналы, поступив в спинной мозг, блокируют проведение болевых импульсов, поступающих по С-волокнам, то есть закрывают ворота на боль.
На механизме блокирования ворот на боль основаны многие методы лечения, такие как иглоукалывание – стимулирут А-дельта волокна, а также ряд физиопроцедур (чрезкожная нейростимуляция, электромышечная стимуляция и т.д.). Ниже хотелось бы рассмотреть еще один, обратный воротному механизму феномен – сенситизацию заднего рога.
Феномен сенситизации заднего рога
В течение часа после травмы, происходят специфические изменения в заднем роге спинного мозга, получившие название феномена сенситизации, основной смысл которого заключается в том, что все поступающие в спинной мозг стимулы более легко проводятся по спинному мозгу в головной, а не блокируются на уровне заднего рога, препятствуя тем самым информационной перегрузке головного мозга.
Сенситизация обусловлена активацией Н-метил-Д-аспартам (NMDA) рецепторов. На блокаде этих рецепторов основан обезболивающий эффект ряда лекарственных препаратов.
Клинически сенситизация проявляется снижением порога восприятия как болевой, так и любой другой, будь то температурной, тактильной, вибрационной чувствительности в той области, за которую ответственен сенситизированный задний рог.
Порог болевой чувствительности изменяется по двум направлениям:
Стимулы, которые ранее расценивались как безболезненные, воспринимаются как боль;
Самые незначительные болевые импульсы воспринимаются как интенсивная боль.
Обычно, после травмы, явления сенситизации проходят одновременно с заживленинем поврежденных тканей. Напротив, у определенной части людей она сохраняется гораздо дольше, что в определенной степени можеть объяснять развитие хронических болевых синдромов. В ряде случаев, длительная сенситизация объясняется сохранением активного очага в поврежденной когда-то ткани, который посылает болевые импульсы в спинной мозг, поддерживая тем самым произошедшие в нем перестройки. В других - точная причина этого феномена неизвестна. Однако замечено, что существует тесная взаимосвязь между эмоциями и феноменом сенситизации заднего рога. Наличие у человека тревожных и депрессивных расстройств приводит к ослаблению нисходящих тормозных влияний на спинной мозг со стороны головного, что может приводить к поддержанию сенситизации.
Исходя из выше сказанного, методами лечения хронических болевых синдромов являются:
Читайте также:

