Каково экспериментальные подтверждение хаотического движения молекул кратко
Обновлено: 05.07.2024
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов. Молекулы могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов.
2. Атомы и молекулы находятся в непрерывном хаотическом движении. Это движение называется тепловым движением.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую.
Еще одно доказательство хаотичного движение молекул вещества – явление диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10 –10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше. Оценка размеров молекул была сделана при наблюдении расплывания капельки масла по поверхности воды.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров – положений равновесия.
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем.
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода . Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число молекул. Это число называется числом Авогадро NА:
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к числу Авогадро NА:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на число Авогадро:

Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода . Она называется атомной единицей массы (а. е. м.):
1 а.е.м. = 1,66·10 –27 кг. (7.4)
Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной атомной или молекулярной массой.
В основе молекулярной физики или молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов. Молекулы могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов.
2. Атомы и молекулы находятся в непрерывном хаотическом движении. Это движение называется тепловым движением.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую.
Еще одно доказательство хаотичного движение молекул вещества – явление диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10 –10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше. Оценка размеров молекул была сделана при наблюдении расплывания капельки масла по поверхности воды.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров – положений равновесия.
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем.
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода . Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число молекул. Это число называется числом Авогадро NА:
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к числу Авогадро NА:
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на число Авогадро:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода . Она называется атомной единицей массы (а. е. м.):
1 а.е.м. = 1,66·10 –27 кг. (7.4)
Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной атомной или молекулярной массой.

Любишь теорию – люби и задачи решать. Во всяком случае, лучше полюбить, ведь заниматься этим все равно придется. Сегодня занимаемся решением задач по молекулярно-кинетической теории и радуемся.
А прежде чем приступать к решению задач, вспомните памятку по решению задач по физике и держите наготове основные формулы.
Задачи по молекулярно-кинетической теории
Задача №1. Средняя квадратичная скорость молекул и температура
Условие
При какой температуре средняя квадратичная скорость молекул кислорода больше их наиболее вероятной скорости на 100 м/с.
Решение
Находим разницу скоростей, используя формулы для средней квадратичной и наиболее вероятной скорости молекул:
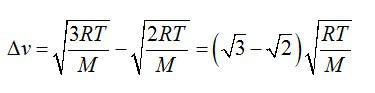
Отсюда выражаем температуру:
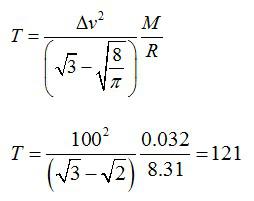
Ответ: 121 К.
Задача №2. Изопроцессы
Условие
На диаграмме V – T изображены процессы перехода идеального газа постоянного количества из состояния 1 в состояние 3. Каким соотношением связаны конечное давление Р3 и начальное давление Р1?
Решение
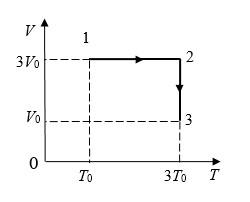
При изохорном процессе:
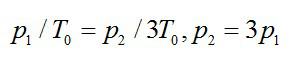
Далее при изотермическом:
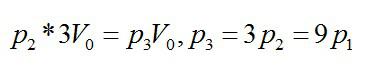
Ответ: Р3=9Р1
Задача №3. Приращение энтропии
Условие
Найти приращение энтропии при переходе массы m=8 г углекислого газа от объема V1=10 л при температуре t1=80° С к объему V2=40 л при температуре t2=300° С.
Решение
Рассмотрим процесс перехода между состояниями вначале по
изохоре, а затем по изотерме:
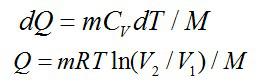
Соответствующие изменения при каждом процессе:
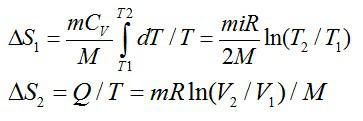
В сумме получаем общее изменение энтропии:
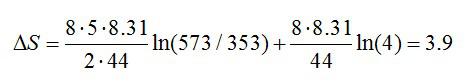
Ответ: 3,9 Дж/К.
Задача №4. Молярная масса
Условие
Каковы масса и молярная масса одной молекулы воды.
Решение
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Их относительные атомные массы берем в таблице Менделеева, а затем вычисляем относительную молярную массу молекулы:
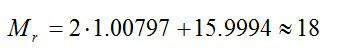
Молярная масса воды:
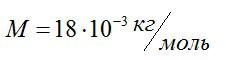
Чтобы найти массу одной молекулы, разделим массу моля воды на количество молекул, содержащихся в нем (число Авогадро):
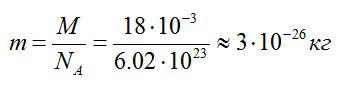
Ответ: 3*10^-26 кг.
Задача №5. Основное уравнение молекулярно-кинетической теории
Условие
Каково давление газа на стенки сосуда, если известны средний квадрат скорости его молекул (2*10^6 м2/с2), концентрация молекул (4*10^24 1/м^3) и масса одной молекулы (3*10^-25 кг).
Решение
Используем основное уравнение МКТ:
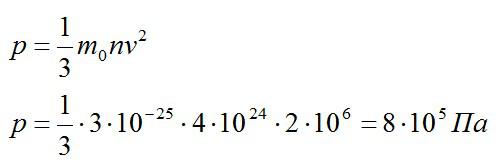
Ответ: 800 кПа.
Вопросы по молекулярно кинетической теории
Вопрос 1. Что такое основное уравнение МКТ?
Ответ. Основное уравнение МКТ – это уравнение, которое связывает макроскопические параметры системы (давление, объем, температура) с микроскопическими (масса молекул, скорость движения молекул)
Вопрос 2. Сформулируйте основные положения МКТ.
Ответ. Основные положения молекулярно-кинетической теории:
- Все вещества могут быть в жидком, твердом и газообразном состоянии. Вещество состоит из частиц (молекулы, атомы, ионы). Элементарные молекулы могут иметь сложное строение, то есть иметь в своем составе несколько атомов. Молекулы и атомы – электрически нейтральные частицы, которые в определенных условиях приобретают дополнительный электрический заряд и переходят в положительные или отрицательные ионы.
- Частицы вещества постоянно находятся в хаотическом движении.
- Силы, с которыми частицы взаимодействуют между собой, имеют электрическую природу. Гравитационным взаимодействием между частицами можно пренебречь.
Вопрос 3. Что такое 1 моль вещества?
Ответ. Это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода.
Вопрос 4. Каково экспериментальные подтверждение хаотического движения молекул?
Ответ. Броуновское движение – наиболее очевидное подтверждение второго положения МКТ.
Броуновское движение – это тепловое хаотическое движение микроскопических частиц, взвешенных в жидкости или газе.
Было открыто ботаником Робертом Броуном в 1827 году на примере пыльцы, но первые сведения об описании подобных явлений относятся к Древнему Риму.
Вопрос 5. Что происходит с кинетической энергией теплового движения молекул при спаде температуры.
Ответ. С ростом температуры кинетическая энергия теплового движения увеличивается, а при спаде температуры – наоборот, уменьшается.
В 19 веке существовала гипотеза тепловой смерти Вселенной, согласно которой в определенный момент, при достижении абсолютного нуля температуры, все процессы остановятся, и Вселенная придет в состояние термодинамического равновесия. В настоящее время эта теория опровергнута.
Нужна помощь в решении задач и других заданий по учебе? Профессиональный студенческий сервис и его лучшие специалисты всегда к вашим услугам и справятся с любой темой.
Какие явления доказывают существование движения молекул? Прежде всего, это явление диффузии и броуновское движение.
Диффузия — самопроизвольное перемешивание веществ. Объясняется тем, что молекулы одного вещества из-за теплового движения проникают в промежутки между молекулами другого вещества. Скорость диффузии зависит от температуры и агрегатного состояния вещества.
Диффузия — это явление самопроизвольного проникновения молекул одного вещества в промежутки между молекулами другого вещества. Диффузия происходит в твердых, газообразных и жидких телах
Наиболее быстро диффузия происходит в газах, а наиболее медленно — в твердых телах. В газах время диффузии составляет порядка минут, в жидкостях — порядка часов, в твердых телах — порядка нескольких лет.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Броуновское движение — беспорядочное движение мелких частиц, взвешенных в жидкости или газе. Это явление было открыто английским ботаником Р. Броуном (1827 г.). Теория броуновского движения была создана А. Эйнштейном (1905 г.). Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена (1908—1911 гг.).
Броуновские частицы движутся под влиянием беспорядочных ударов молекул вещества, которые нескомпенсированы. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по направлению и по значению, описывает сложные зигзагообразные траектории. Броуновское движение непрерывно и беспорядочно, оно зависит от свойств вещества, в котором частицы взвешены.
Броуновское движение доказывает существование молекул, их движение и непрерывный и хаотический характер этого движения.
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Вещество может находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Молекулярная физика - раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения.
Молекулярно-кинетическая теория зародилась в XIX-м веке с целью объяснить строение и свойства вещества на основе представлений о том, что вещество состоит из мельчайших частиц - молекул, которые непрерывно движутся и взаимодействуют друг с другом. Особых успехов эта теория достигла во время объяснения свойств газов.
^ Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представлений о существовании атомов и молекул как наименьших частиц химических веществ.
В основе MKT лежат три основных положения: 1) все вещества образованы из мельчайших частиц - молекул, которые сами состоят из атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительного электрического заряда и превращаться в положительные или отрицательные ионы;
2) атомы и молекулы находятся в непрерывном хаотическом движении;
3) частицы взаимодействуют друг с другом силами, имеющих электрическую природу.
Ярким экспериментальным подтверждением представлений о молекулярно-кинетическую теорию (беспорядочное движение атомов и молекул) является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. броуновское частицы движутся под влиянием беспорядочных ударов молекул. Через хаотическое тепловое движение молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновского частицы беспорядочно меняется по модулю и направлению, а ее траектория образует сложную зигзагообразную кривую.
Читайте также:

