Изучение фиксированных клеток кратко
Обновлено: 02.07.2024
Стандартная световая микроскопия осуществляется путем изучения препарата в проходящем свете. Свет в световом микроскопе собирается в конденсоре и пропускается через препарат. Далее свет входит в объектив, в фокальной плоскости которого формируется изображение. Окуляр увеличивает это изображение и направляет его в глаз. Главными характеристиками микроскопа служат разрешающая способность и увеличение.
Разрешающая способность (разрешение) микроскопа — это минимальное расстояние между двумя точками объекта, которые видны в нем раздельно. Эта величина обусловлена объективом и зависит от длины световой волны (390–710 нм или 0,39–0,7 мкм) и от оптической характеристики объектива — числовой апертуры. Теоретическое разрешение светового микроскопа — 0,2 мкм, практически — около 0,4 мкм (1 мкм (микрометр) = 10 -6 м).
Увеличениемикроскопа рассчитывается как произведение увеличений объектива и окуляра. Оно оценивается соотношением между линейными размерами создаваемого им изображения изучаемого объекта и самого объекта. Общее увеличение светооптического микроскопа равно 2000–2500, однако полезное увеличение (способствующее выявлению деталей объекта) составляет до 1500 раз.В световом микроскопе можно видеть отдельные клетки размером от 4 до 150 мкм, внутриклеточные структуры — органеллы, включения.
Специальными методами световой микроскопии являются:
— темнопольная микроскопия (микроскопия в темном поле). При этом используется специальный конденсор, который освещает препарат косыми лучами, не попадающими в объектив. Если объектов нет, то поле зрения темное. При наличии объектов часть света отражается ими в объектив и изображение появляется в окуляре. Метод позволяет обнаружить структуры клеток, имеющие размеры меньшие, чем разрешение светового микроскопа.
— фазово-контрастная микроскопия. Метод служит для получения контрастных изображений прозрачных и бесцветных живых объектов. При этом в конденсор помещают специальную кольцевую диафрагму, а в объектив — фазовую пластинку. Фазовые изменения прошедшего через препарат света преобразуются в изменение его амплитуды, то есть яркости получаемого изображения. Повышение контраста позволяет видеть все структуры, различающиеся по показателю преломления света. Этот метод дает возможность непосредственного изучения живых клеток без их фиксации и окрашивания, позволяет видеть объемные структуры без искажения.
— поляризационная микроскопия. Метод используется для изучения структур, обладающих способностью двойного лучепреломления (анизотропия). В поляризационном микроскопе установлены 2 поляризационных фильтра — 1-й (поляризатор) между пучком света и объективом, 2-й (анализатор) — между линзой объектива и глазом. На объект направляется поляризованный пучок света, а 2-й фильтр имеет главную ось, которая располагается перпендикулярно 1-му фильтру, он не пропускает свет. Получается эффект темного поля. Если анализатор повернуть на 90 о по отношению к поляризатору, то свет проходить через низ не будет. Структуры, содержащие продольно ориентированные молекулы — коллаген, микротрубочки, микрофиламенты, а также кристаллические структуры при изменении оси вращения проявляются как светящиеся. Способность кристаллов или других структур к раздвоению световой волны на обыкновенную и перпендикулярную к ней называется двойным лучепреломлением. Метод служит для выявления закономерного пространственного расположения молекул в объекте.
— ультрафиолетовая микроскопия. Изучаемый объект освещается ультрафиолетовыми лучами, которые имеют более короткую длину волны по сравнению с лучами видимой части спектра, поэтому разрешающая способность микроскопа повышается примерно в два раза (0,1 мкм). Полученное в ультрафиолетовых лучах невидимое глазом изображение, преобразуется в видимое с помощью регистрации на фотопластинке или путем применения специальных устройств.
— флюоресцентная (люминисцентная) микроскопия. В этом методе используют способность некоторых веществ излучать видимый свет при освещении объекта ультрафиолетовыми лучами. Различают первичную (собственную) и вторичную (наведенную) флюоресценцию. Первичной флюоресценцией обладают серотонин, катехоламины (адреналин, норадреналин), содержащиеся в нервных и тучных клетках, после фиксации тканей в парах формальдегид при 60–80 о С (метод Фалька). Вторичная флюоресценция возникает при обработке препаратов специальными красителями — флюорохромами.
Электронная микроскопия. В электронном микроскопе используется поток электронов с более короткими, чем в световом микроскопе, длинами волн — 0,0056 нм. Теоретически рассчитанная разрешающая способность электронного микроскопа составляет 0,002 нм, практически разрешающая способность в современных микроскопах около 0,1–0,7 нм. В настоящее время используются трансмиссионные (просвечивающие) электронные микроскопы (ТЭМ) и сканирующие электронные микроскопы (СЭМ). Первым способом получают плоскостное изображение изучаемого объекта, вторым — пространственное представление о строении определенных структур.
Методы исследования химического состава и метаболизма клеток и тканей
Цитохимические и гистохимические методы исследования
Методы цито- и гистохимии направлены на выявление в клетках и тканях конкретных химических веществ (например, железа, кальция, белков, липидов, нуклеиновых кислот, гликогена, ферментов) или химических групп (например, альдегидных, сульфгидрильных, аминогрупп). Эти методы основаны на специфическом связывании красителей с определенными химическими соединениями (например, РНК и ДНК) или образовании окрашенных продуктов из неокрашенных. Методами цито- и гистохимии изучают распределение и оценивают содержание в клетках и неклеточных компонентах тканей веществ, относящихся к различным группам — ДНК или РНК, белков, аминокислот, липидов, углеводов, минеральных веществ, оценивают активность ферментов.
Наиболее используемый гистохимический метод — ШИК- или PAS-реакция. Название метода происходит от сокращения терминов Шиффа (реактив) — Иодная Кислота (по англ. Periodic Acid Schiff). Этот метод используется для выявления соединений, богатых углеводными группами — гликогена, гликопротеинов, мукопротеинов, протеогликанов. Он основан на окислении иодной кислотой гидроксильных групп сахаров до альдегидных, с которыми связывается бесцветный реактив Шиффа (содержит фуксин), превращаясь в стабильное соединение красного цвета.
Иммуноцитохимические и иммуногистохимические методы исследования
Иммуноцито- и иммуногистохимические методы обеспечивают наиболее специфическое выявление веществ в клетках и тканях. При этом мазки и срезы обрабатываются маркированными специфическими антителами к выявляемому веществу — оно является антигеном. С помощью этих методов производится идентификация клеток различных типов по их маркерным признакам, изучаются синтетические и секреторные процессы, выявляются гормоны и их рецепторы.
Метод гибридизации in situ
Данный метод позволяет выявить определунную последовательность нуклеотидов в молекуле РНК или ДНК и благодаря этому изучить локализацию генов и продуктов их транскрипции. При этом вводятся зонды — маркированные фрагменты РНК или ДНК, которые содержат последовательности нуклеотидов, комлементарные искомым.
Метод авторадиографии
Метод основан на выявлении в тканях веществ, меченных радиоактивными изотопами. Меченое вещество вводится в организм экспериментального животного или в инкубационную среду in vitro, в которую помещают свежеудаленный кусочек ткани. В качестве изотопов наиболее часто используют 3 Н, 14 С, 32 Р, 35 S, 127 I, 131 I. Срезы материала с меченым веществом в темноте покрывают фотоэмульсией, которая после определенной экспозиции оказывается засвеченной в участках расположения радиоактивного изотопа. При проявке эмульсии серебро, выпавшее в таких участках, имеет вид зерен. Получен препарат — радиоавтограф. Его окрашивают, а зерна серебра выявляют локализацию меченого вещества.
Авторадиография позволяет проследить ход включения меченого предшественника в макромолекулы, транспорт макромолекул, ход синтеза и секреции различных веществ, локализацию рецепторов, деление клеток и кинетику клеточных популяций.
Фракционирование клеточного содержимого – ультрацентрифугирование, хроматография, электрофорез.
Световая микроскопия
Электронная микроскопия
Другие методы
Современная биология располагает большим разнообразием ме- тодов, позволяющих изучать структуру и функции живых и фиксированных клеток на микроскопическом и субмикроскопическом уровнях. Наиболее широко применяются следующие методы:
• прижизненное окрашивание;
• темнопольная микроскопия;
• флуоресцентная микроскопия;
• фазово-контрастная микроскопия;
• культивирование клеток и тканей;
• электронная микроскопия;
• рентгеноструктурный анализ;
• цито- и гистохимия;
• цитоспектрофотометрия;
• дифференциальное центрифугирование;
• гистоавторадиография.
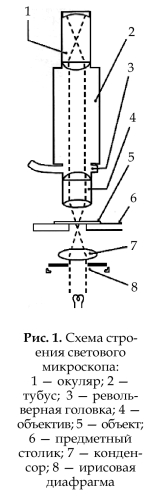
Световая микроскопия Схема строения светового микроскопа представлена на рис. 1. Окуляр (1): увеличивает изображение, получаемое в линзах объектива; в окуляр может быть вставлена измерительная сетка, если необходимо измерить размеры объекта.
Тубус (2): трубка, по которой свет проводится от объектива к окуляру; может перемещаться в штативе для фокусировки изображения объекта.
Револьверная головка (3): в нее вставлены 2, 3 или 4 объектива. Головка поворачивается так, чтобы можно было использовать объективы с разным фокусным расстоянием (а значит, и с разным увеличением).
Объектив (4): увеличивает изображение объекта.
Объект исследования (5): закреплен на прозрачной стеклянной пластине (предметное стекло).
Предметный столик (6): удерживает объект в нужной позиции по отношению к оптической системе микроскопа.
Конденсор (7): фокусирует лучи света от осветителя на объекте исследования.
Ирисовая диафрагма (8): регулирует вели- чину светового потока к объекту. Лучшее разрешение достигается при уменьшении осве- щения (а не при увеличении). Для освещения чаще всего используется белый свет. Для повышения разрешения применяется свет коротковолновой части спектра (например, синий), излучаемый специальной лампой или системой фильтров. Свет на объект должен падать только из-под предметного столика. Диаметр типичной клетки приблизительно 10–20 мкм, что в 5 раз меньше размеров мельчайшей видимой частицы глазом, так как разрешающая способность человеческого глаза 100 мкм (0,1 мм).
Метод сравнительной микроскопиии используется для исследования двух объектов путем визуального наблюдения или фотографирования. В поле зрения микроскопа сравниваемые объекты видны одновременно. Метод используется в различных областях биоло- гии и медицины.
Метод прижизненного (витального) окрашивания основан на использовании очень низких концентраций красителя (растворы от 0,1% до 0,01%). В такой концентрации красители являются малотоксичными для клеток. Чаще используют конгорот, нейтральный красный, трипановый синий и другие соединения ароматического ряда. В живой клетке при введении красителя наблюдается гранулообразование, в погибающей — диффузное окрашивание. По способности клеточных структур воспринимать краситель можно судить о степени повреждения клетки. Таким образом, метод позволяет судить о жизнедеятельности клеток при различных внешних воздействиях.
Метод микроскопирования в темном поле (темнопольная микроскопия) используется для рассматривания особо мелких структур (менее 0,2 мкм). Метод основан на том, что мелкие структуры, невидимые при обычном микроскопировании, светятся в отраженных лучах (эффект Тиндаля: светящиеся пылинки в луче солнечного света). Используется специальный конденсор, который пропускает только косые краевые лучи источника света. Поскольку краевые лучи имеют сильный наклон, они не попадают в объектив и поле зрения оказывается темным, а объект — светлым.
Флуоресцентная микроскопия основана на том, что некоторые вещества и структуры способны светиться (флуоресцировать, люминисцировать) при поглощении световой энергии. Для наблюдения флуоресценции используют либо фильтры, дающие освещение в сине-фиолетовой области, либо ультрафиолетовые и люминисцентные микроскопы. Собственной (естественной) флуоресцен- цией обладают: хлорофилл, витамины А, В12, некоторые гормоны. Хлорофилл при освещении в ультрафиолетовых лучах светится красным цветом. Для изучения структур и веществ, не обладающих естественной флуоресценцией, можно использовать флуорохромы (флуоресцирующие красители). Флуорохром акридиновый оранжевый избирательно соединяется с нуклеиновыми кислотами и при рассмотрении срезов в ультрафиолетовых лучах ДНК светится зеленым, а РНК — красным цветом. Таким образом, этот метод позво- ляет изучать локализацию различных химических веществ в живой и фиксированной клетке. Существуют флуорохромы, избирательно связывающиеся с липидами, полисахаридами, кератином и др.
Фазово-контрастная микроскопия основана на том, что отдельные структуры прозрачной в целом клетки отличаются друг от друга по плотности и светопреломлению. Проходя через структуры различной плотности, луч света изменяет свою фазу, но наш глаз не способен улавливать этот сдвиг фазы. Глаз чувствителен только к изменениям интенсивности света (яркости), последняя зависит от величины амплитуды световой волны. Специальный объектив вызы- вает дополнительный сдвиг фазы колебания. При построении изображения взаимодействуют уже лучи, находящиеся в одной фазе, но обладающие разной амплитудой. Тем самым создается черно-белое контрастное изображение объекта.
Методы цито- и гистохимииоснованы на способности красителей избирательно окрашивать химические вещества. Методы используют- ся для изучения химического состава тканей и клеток при сохранении их структуры, а также для определения локализации химических ве- ществ. Например, реакция Фельгена на ДНК или окраска метиловым- зеленым-пиронин на нуклеиновые кислоты (метод Браше). В основе реакции Фельгена лежит кислотный гидролиз ДНК на срезе фиксиро- ванной ткани, в процессе которого от ДНК отщепляется альдегидная группа, которая и реагирует с реактивом Шиффа (фуксинсернистой кислотой). В итоге ДНК хроматина приобретает яркую красно-фио- летовую окраску. При окраске по методу Браше пиронин связывается с РНК, окрашивает ее в розовый цвет, а метиловый зеленый связывает- ся только с ДНК, окрашивая ее в сине-зеленый цвет.
Метод цитоспектрофотометрии основан на том, что интенсивность поглощения лучей прямо пропорциональна концентрации вещества. При помощи специального прибора (микроспектрофотометра) измеряется оптическая плотность окрашенных цито- и гисто- химическими методиками субстратов (нуклеиновых кислот, белков, углеводов, ферментов). Величина оптической плотности характе- ризует концентрацию изучаемого вещества в структурах. Для количественного анализа необходимо знать площадь и объем структур (ядер, цитоплазмы), в которых измеряется оптическая плотность субстрата. Количество вещества выражается в условных единицах (ДНК можно выразить в единицах плоидности, если отфотометрировать в качестве стандарта сперматиды семенников (n) или лимфоциты крови (2n)). Метод применяется для изучения плоидности ядер, для изучения концентрации РНК, полисахаридов, белков и других веществ при развитии патологического процесса или при экспериментальном воздействии.
Метод гистоавторадиографии основан на использовании радиоактивных изотопов: трития (Н3), S35, С14 и др. Когда какое-либо вещество, содержащее радиоактивный атом, вводят в живую клетку, то клетка использует его наравне с нерадиоактивными изотопами для синтеза новых веществ. Меченый атом, таким образом, становится изотопным индикатором. Тритий используют в составе тимидина (для ДНК), уридина (для РНК), S35в составе метионина (для белка). Следы разлета частиц, которые испус кают распадающиеся радиоактивные изотопы, регистрируют путем нанесения светочувствительной эмульсии на гистологический препарат. В местах прохождения частиц светочувствительная эмульсия засвечивается, а после проявления эти участки выглядят как черные точки (треки). Чем интенсивнее изотоп включается в метаболизм, тем больше треков будет на препарате. Треки видны только над теми структурами, в составе которых появились радиоактивные молекулы. Так, например, Н3-тимидин входит в состав только молекулы ДНК, а основная масса ДНК локализована в ядре — следовательно, треки будут только над ядрами, и только над теми, в которых идет синтез ДНК. Метод используется для изучения обменных процессов (репликации ДНК, синтеза белка) на клеточном и тканевом уровнях.
Метод культивирования клеток и тканей основан на выращивании (эксплантации) изолированных клеток, кусочков тканей, орга- нов вне организма (in vitro). Различают клеточное, тканевое и органное культивирование. При клеточном и тканевом культивировании отдельные клетки или кусочки ткани выращивают погруженными в питательную среду. Такой способ позволяет сохранить морфологическую структуру культивируемых клеток, тканей. Культуры клеток дают возможность получить однородный клеточный материал в больших количествах. На клеточных культурах можно изучать физические и химические воздействия. На культурах клеток разработан комплекс специальных методов, в том числе гибридизация соматических клеток и образование гетерокарионов. При органном культивировании клетки кусочки ткани или органа (чаще всего взятые у эмбриона) выращивают на поверхности питательной среды. Кусочек органа или ткани в стерильных условиях извлекают из эмбриона, измельчают (до 0,2 мм), промывают в растворе Хенкса и помещают на поверхность мембранного фильтра, расположенного на плотике из органического стекла. Плотик помещают в чашку Петри с питательной средой так, чтобы нижняя поверхность фильтра касалась поверхности питательной среды. Питательная среда включает сбалансированный состав аминокислот, всех необходимых солей, сюда добавляется бычья сыворотка, куриный эмбриональный экстракт, витамин С, глюкоза, антибиотики. Чашки Петри помещают в термостат при 37 °С. Смена питательной среды проводится каждые два дня. При этом в стерильных условиях плотик с фильтрами и с кусочками тканей переносят в новую чашку Петри со свежей питательной средой. В таких условиях можно наблюдать за эксплантатом в течение длительного времени (28 и более суток). Органное культивирование позволяет сохранить морфологическую структуру выращиваемого органа, свойственную ему в условиях целого организма. При этом сохраняется не только морфологическая структура, но и функциональные свойства ткани, что позволяет наблюдать процессы дифференцировки, пролиферации, выявлять действие биологически активных веществ на культуру, проследить за динамикой возникающих изменений.
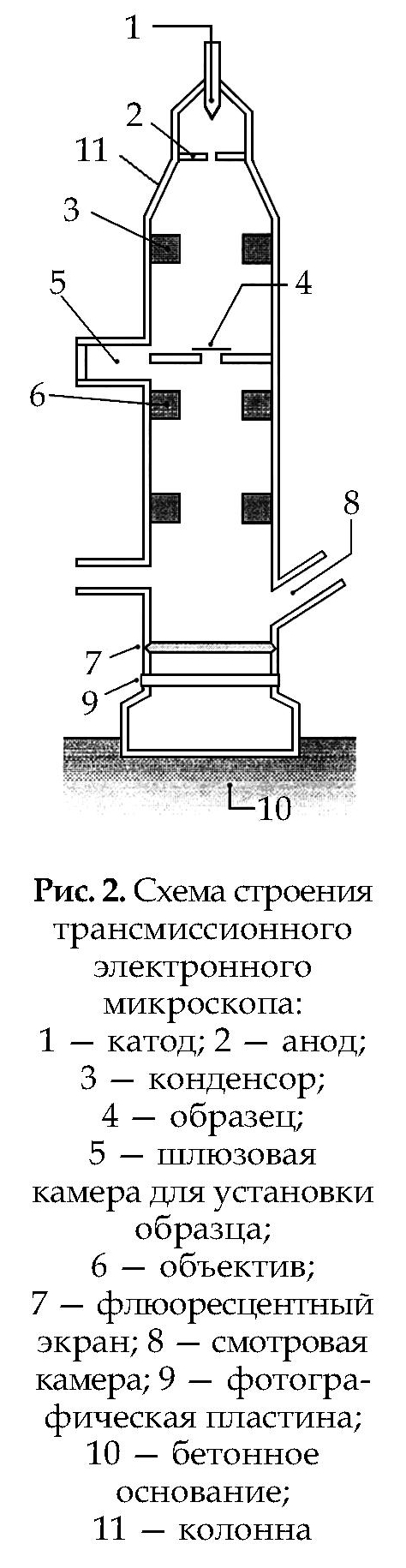
Электронная микроскопия Схема строения трансмиссионного электронного микроскопа представлена на рис. 2.
Катод (1): металлический электрод (обычно платиновый), который излучает мощный высокоскоростной электронный луч. Электроны — отрицательно заряженные частицы (e–).
Анод (2): положительно заряженный электрод с напряжением 50 кВ относительно катода. Служит для ускорения электронного луча.
Конденсор (3): электронная линза, фокусирующая электронный луч на образце (4).
Шлюзовая камера для установки образца (5): позволяет поместить образец (исследуемый материал) в микроскоп без потери вакуума внутри аппарата.
Объектив (6): электромагнитная линза, которая фокусирует первое изображение и увеличивает его (в зависимости от прилагаемого напряжения).
Флюоресцентный экран (7): покрыт составом, чувствительным к столкновению с электронами. Необходим для перевода электронного изображения в световое, так как преломленный электронный луч (изображение) не может наблюдаться непосредственно.
Фотографическая пластина (9): позволяет зафиксировать черно-белое изображение. При печати на фотобумагу изображение еще больше увеличивается.
Бетонное основание (10): жестко закреплено для уменьшения вибрации и нежелатель- ных отклонений электронного луча. Электронная микроскопия основана на рассмотрении объекта в проходящем пучке электронов. Длина волны электронов при напряжении в 100 000 Вт (100 кВт) составляет 0,04–0,05 Å1(0,004–0,005 нм) и разрешающая способность для биологических объектов в данном случае — 20 Å (2 нм, 0,002 мкм), т. е. в 100 раз выше, чем у светового микроскопа и достигается при увеличении в 250 000 раз, которое и является мак- симально полезным. Последние модели электронных микроскопов позволяют достигнуть разрешающей способности в 1 Å. Для исследования структуры клетки в электронном микроскопе требуются ульт ратонкие срезы толщиной 400–1200 Å (40–120 нм; в среднем — 0,1 мкм), так как электроны обладают низкой проникающей способностью.

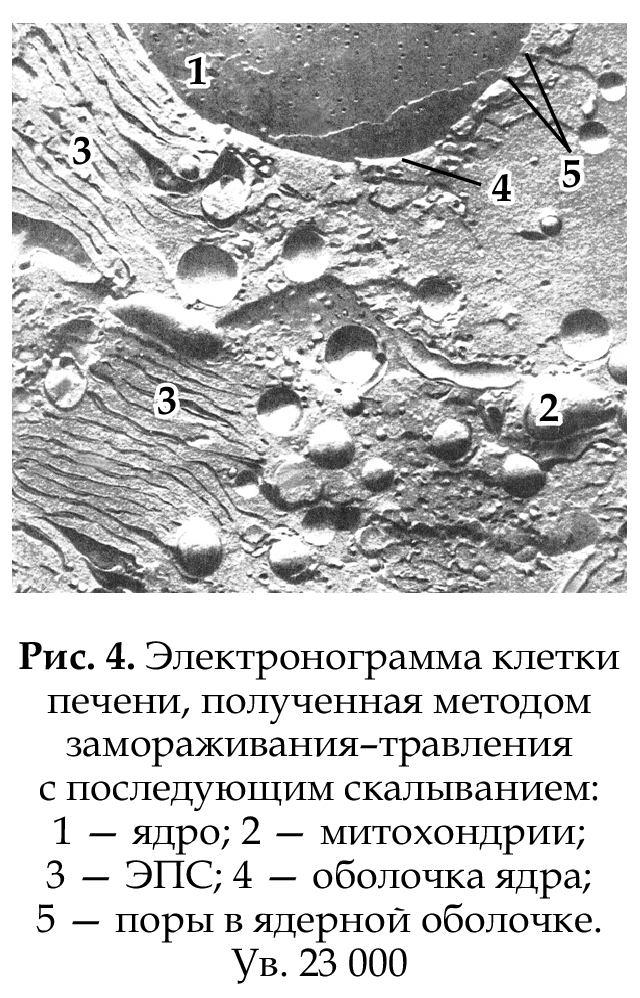
Таким образом, разрешающая способность электронного микроскопа в 106 раз выше разрешающей способности глаза и в 103 выше, чем разрешающая способность светового микроскопа. Различают трансмиссионную (просвечивающую), сканирующую и высоковольтную электронную микроскопию. Трансмиссионная микроскопия принципиально сходна со световой, но в колонне микроскопа создается вакуум, так как электроны, сталкиваясь с молекулами газов, отклоняются и могут не достигать объекта. Использование вакуума не позволяет исследовать живые объекты. Сканирующий микроскоп создает эффект трехмерности и способен охватывать большие поверхности. Материал фиксируют, специальным образом высушивают, покрывают тонким слоем испаренного металла (чаще всего золота), от которого электроны отражаются и попадают в приемное устройство, передающее сигнал на электронно-лучевую трубку. Используется в биологии для изучения поверхности лейкоцитов, про- стейших. Высоковольтныймикроскоп позволяет изучать более толстые (до нескольких микрометров) объекты. Это обусловлено усилением проникающей способности электронов в результате увеличения их скорости под воздействием высокого напряжения. Использование ускоренного пучка электронов и герметичных микрокамер позволяет изучать живые объекты (бактерии), хотя и в течение короткого времени. Объекты, изображенные на экране, можно фотографировать и получать электронограммы. Объемное изображение внутреннего строения клетки можно получить методом замораживания-травления с последующим скалыванием материала охлажденным ножом в специальной вакуумной установке. Поверхность скола последовательно покрывается тонким слоем испаренного углерода, а затем проводят напыление металлом. Таким образом получают пленкреплику, которую и изучают в электронном микроскопе (рис. 4).
Другие методы Метод рентгеноструктурного анализа основан на явлении дифракции рентгеновских лучей и дает возможность определить про- странственное расположение молекул. Применяется для изучения структуры белков, нуклеиновых кислот и других веществ, входящих в состав цитоплазмы и ядра клетки.
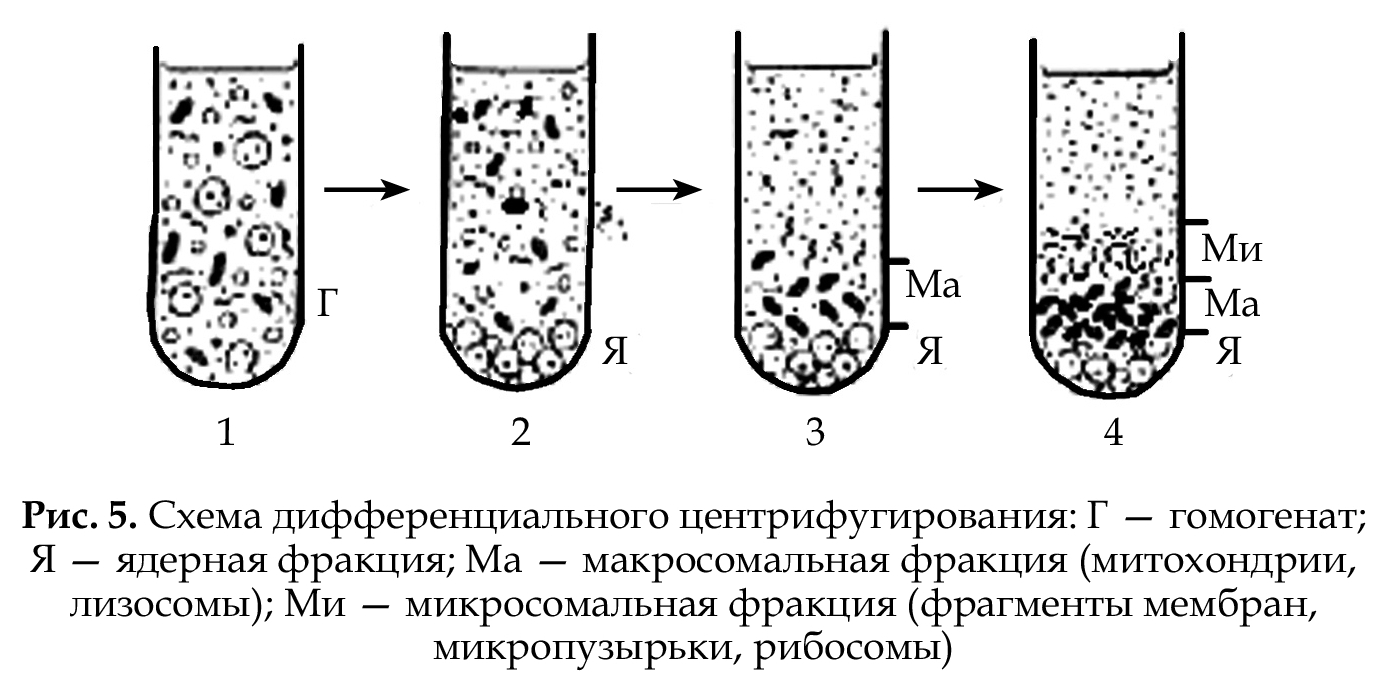
Метод дифференциального центрифугирования основан на разной скорости осаждения (седиментации) отдельных частиц под действием центробежной силы и используется для разделения внутриклеточных структур. Коэффициент седиментации (S) определяется скоростью движения макромолекул в поле с ускорением, равным I, измеряется в единицах, называемых СВЕДБЕРГАМИ. Для определения S используется центрифугирование при высокой скорости (30 000–60 000 об./мин). Исследуемый материал предварительно измельчают в гомогенизаторе. При скоростной седиментации используется среда одинаковой плотности. Компоненты клетки, вначале равномерно распределенные по всему объему пробирки, при центрифугировании оседают каждый со своей скоростью. В результате, содержимое пробирки разделяется на фракции (слои), из которых нижняя представлена самыми тяжелыми структурами, а верхняя — самыми легкими (рис. 5).
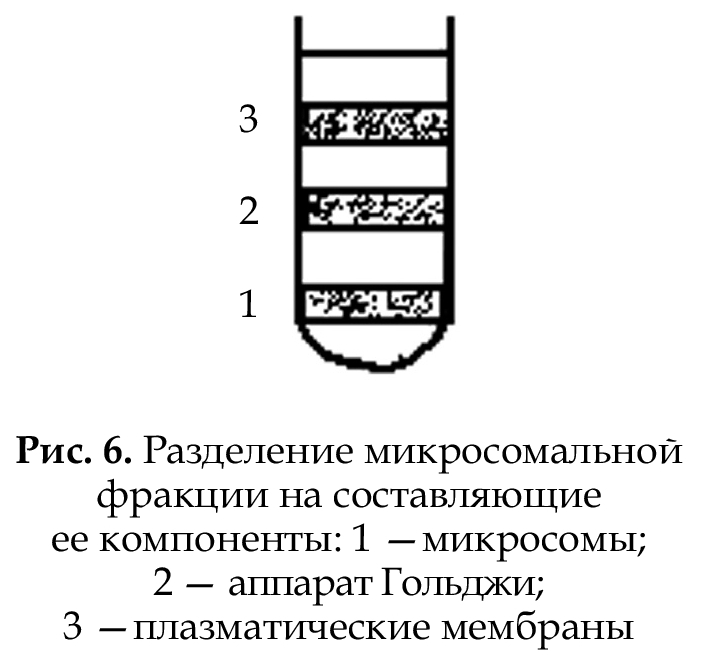
В последующем фракции (макросомальную и микросомальную) разделяют на отдельные компоненты, исполь- зуя методы седиментации в градиенте плотности среды. Наиболее распространенным компонентом для получения градиента среды является сахароза. В процессе центрифугирования субклеточные структуры, входящие в одну фракцию, концентрируются в виде отдельных зон в той части пробирки, где молярная концентрация сахарозы обеспечива- ет такую плотность раствора, при которой дальнейшее оседание частиц уже не происходит (рис. 6). Помимо перечисленных методов в цитологии используются и так называемые пограничные методы:
― гибридизация нуклеиновых кислот на срезах;
― иммуноцитохимия с при менением моноклональных антител на световом и электронно-микроскопическом уровне;
― микрохирургия и др.
Несмотря на важность и достаточную простоту витальных наблюдений, большая часть сведений о структуре и свойствах клеток получена на фиксированном материале. Если клетку повредить, она начинает претерпевать ряд изменений, а после смерти клетки в ней активируются автолитические ферменты, что приводит к грубым изменениям клеточной структуры. Следовательно, задачи фиксации – это убить клетку, прекратить активность внутриклеточных ферментов, предотвратить распад клеточных компонентов, а также избежать потери структур и веществ, препятствовать появлению структур, отсутствующих в живой клетке (артефактные структуры). К сожалению, еще не найден такой химический фиксатор, который бы удовлетворял всем этим требованиям.
Часто для фиксации используются альдегиды и их смеси с другими веществами. В качестве фиксаторов применяют также спирты, вызывающие необратимую денатурацию белков, осаждение нуклеиновых кислот и полисахаридов. Осаждающим действием обладают такие сулемовые фиксаторы и фиксаторы с пикриновой кислотой. Фиксаторы, содержащие четырехокись осмия (OsO4), хорошо сохраняют липиды.
После фиксации объекты в дальнейшем можно подвергать дополнительной обработке. Одной из главных таких обработок является окрашивание клеток. Именно дополнительное окрашивание клеток позволило выявить в них массу деталей.
Стекла с фиксированными мазками одноклеточных организмов или с клетками культуры ткани можно непосредственно помещать в красители. Но для окрашивания клеток в составе органов необходимо получить их срезы. Изучают такие срезы и отдельных клеток.
Для этого после фиксации кусочки органов обезвоживают в спиртах возрастающей концентрации, спирт замещают ксилолом, а ксилол – парафином. Таким образом, фиксированная ткань, минуя высушивание на воздухе, оказывается заключенной в твердую массу парафина, которую можно нарезать.
Срезы толщиной до 5-10 мкм получают на специальном приборе – микротоме. Такие срезы приклеиваются на предметное стекло: парафин растворяется в ксилоле, ксилол удаляется спиртами, которые замещаются водой. Теперь срезы можно окрашивать водными растворами красителей. Для изготовления постоянных препаратов окрашенные срезы снова обезвоживаются и заливаются в канадский бальзам под покровным стеклом, эти препараты можно длительно хранить.
Для окраски фиксированных тканей и клеток применяют различные натуральные и главным образом синтетические красители. Натуральные красители (гематоксилин, кармин и др.) употребляют в сочетании с протравами (окислы различных металлов), с которыми они образуют комплексные соединения (лаки).
Синтетические красители подразделяют на кислые и основные. Основные краски представляют собой соли красящих оснований, содержащие в своем составе аминогруппы, которые и определяют их щелочность. Такие красители образуют солевые связи с кислотными группами в структурах клетки. Следовательно, участки клеток, богатые кислотными группами, свяжутся с основными красителями, будут, как их называют, базофильными. Кислотные красители содержат в своем составе гидроксильные группы, или группы SO2OH. Структуры клеток с основными (щелочными) свойствами связываются с кислотными красителями и называются ацидо- или оксифильными. Существует множество смесей таких красителей, которые одновременно могут окрашивать различные участки клеток в разные цвета и тем самым повышать контрастность клеточных и внеклеточных компонентов. Таким образом, используя всевозможные красители, исследователи не только добиваются четкости морфологической картины клетки, но получают некоторые сведения о химизме той или иной структуры.
Ряд красочных приемов, направленных на выявление специфических химических веществ, получил название гистохимических и цитохимических. Методов цитохимического анализа очень много.
Существует целый ряд специфических красочных приемов, прямо выявляющих те или иные вещества. Это собственно гистохимические (цитохимические) реакции. Основные требования, предъявляемые к такого рода реакциям, следующие: специфичность связывания красителя, неизменность локализации вещества.
Примером такого рода цитохимических реакций может быть широко применяемая реакция на ДНК, реакция Фёльгена (рис. 8). Суть ее в том, что после специфического кислотного гидролиза только на ДНК в результате отщепления пуринов на дезоксирибозе образуются альдегидные группы. Эти группы могут взаимодействовать со специфическим индикатором , реактивом Шиффа (обесцвеченное основание фуксина), давая красное окрашивание в местах локализации ДНК. Связывание красителя в этом случае строго количественное, что позволяет не только обнаружить и указать места, где есть ДНК, но и измерить ее количество. Используя этот же принцип выявления альдегидных групп, можно в клетках видеть расположение полисахаридов после гидролиза их периодной кислотой (так называемая PAS-реакция).
Также специфически можно определить локализацию белков реакциями на отдельные аминокислоты (тирозин, триптофан, аргинин и др.). Липиды и жиры обнаруживают в клетках специальными красителями (судан черный), хорошо растворяющимися и аккумулирующимися в жировых включениях.
Целая группа цитохимических реакций связана с обнаружением ферментов. Общий принцип этих реакций в том, что в микроскоп видны не сами белковые ферменты, а места их локализации, которые обнаруживаются по продуктам их специфической ферментативной активности.
Количество конечного продукта цитохимической реакции можно определить с помощью метода цитофотометрии. Основу его составляет определение количества химических веществ по поглощению ими света определенной длины волны. Было найдено, что интенсивность поглощения лучей пропорциональна концентрации вещества при одной и той же толщине объекта. Следовательно, оценивая степень поглощения света данным веществом, можно узнать его количество. Для такого рода исследований используют приборы – микроскопы-цитофотометры; у них за объективом расположен чувствительный фотометр, регистрирующий интенсивность прошедшего через объект светового потока. Зная площадь или объем измеряемой структуры и значение поглощения, можно определить как концентрацию данного вещества, так и его абсолютное содержание. Широко используется метод цитофотометрии при определении количества ДНК на клетку после реакции Фёльгена. В данном случае фотометрируется не сама ДНК, а содержание красно окрашенного фуксина, количество которого прчямо пропорционально содержанию ДНК. Сравнивая полученные величины поглощения со стандартами, можно получить точные значения количества ДНК, выраженные в граммах. Этот метод позволяет измерять количество ДНК до 10 -12 – 10 -14 г, в то время как микрохимические методы имеют чувствительность не более 10 -6 г. С помощью цитофотометрии содержание ДНК в клетках определяется намного точнее обычных биохимических методов.
Количественную оценку получают не только поглощающие свет объекты и вещества, но и излучающие (светящиеся ). Так, разработаны приемы количественной флурометрии, позволяющие по степени свечения определить содержание веществ, с которыми связываются флуорохромы.
Для выявления специфически белков применяют иммунохимические реакции с использованием флуоресцирующих антител. Этот метод иммунофлуоресценции обладает очень большой специфичностью и чувствительностью. Его можно использовать для выявления не только белков, но и отдельных последовательностей нуклеотидов в ДНК или для определения мест локализации РНК-ДНК гибридных молекул. Для этого сначала на белок (например, тубулин) получают специфические сыворотки, содержащие антитела. Очищенные антитела химически соединяют с флуорохромами. Такие препараты наливают на объекты и с помощью люминесцентного микроскопа по свечению флуорохрома находят места локализации искомых белков в клетке. Однако для того, чтобы меченные флуорохромами антитела проникли в клетку, необходимо плазматическую мембрану сделать проницаемой. Обычно это достигается фиксацией клеток и частичной экстракцией липидов из мембран. Для изучения с помощью этого метода цитоскелетных белков прибегают к растворению клеточных мембран различными детергентами.
Для выяснения локализации мест синтеза биополимеров, для определения путей переноса веществ в клетке, для наблюдения за миграцией или свойствами отельных клеток широко используют метод радиоавтографии – регистрации веществ, меченных изотопами (рис. 9). Принцип этого метода очень прост, он повторяет метод Беккереля, открывшего радиоактивный распад. При радиоавтографическом исследовании клеткам в среду вводится предшественник одного из макромолекулярных соединений (например, аминокислота или нуклеотид), один из атомов которого замещен радиоактивным изотопом. Например, вместо 12 С введен атом 14 С, вместо водорода – тритий 3 Н и др. В процессе синтеза в биополимер включится и меченая молекула предшественника. Регистрировать ее место в клетке можно с помощью фотоэмульсии. Если клетки в пласте или на срезе покрыть фотоэмульсией, то через некоторое время в результате распада изотопа – частицы, разлетающиеся хаотично в разных направлениях, попадут в зону чувствительного фотослоя и активируют в нем зерна бромистого серебра. Чем больше будет время экспозиции, т.е. контакта такой меченой клетки с фотоэмульсией, тем больше зерен AgBr будет засвечено. После экспозиции надо проявить препарат, при этом происходит восстановление серебра только в засвеченных гранулах, при фиксации препарата незасвеченные гранулы AgBr растворяются. В результате из массы гранул, которые покрывали объект, останутся только те, которые были активированы -излучением. Просматривая в микроскоп такие препараты, поверх которых нанесен слой фотоэмульсии, исследователь находит места локализации зерен серебра, которые располагаются напротив мест, где содержится меченое вещество (рис. 9).
Этот метод имеет ограничения: точность его будет зависеть от величины зерна AgBr и от энергии частицы. Чем больше величина зерна, тем с меньшей точностью можно узнать место расположения изотопа. И чем выше энергия частицы и длиннее ее пробег, тем дальше от места распада будет происходить активация зерен AgBr . Поэтому для метода радиоавтографии используют особые мелкозернистые фотоэмульсии (0,2-0,3 мкм) и изотопы с малой энергией -частиц, главным образом изотоп водорода, тритий ( 3 Н). Тритием могут быть мечены любые предшественники биологических макромолекул: нуклеотиды, аминокислоты, сахара, жирные кислоты. Используются также для радиоавтографических исследованных меченые гормоны, антибиотики, ингибиторы и др. Радиоавтографически нельзя изучать растворимые в воде соединения, так как в процессе обработки клеток водными растворами (фиксация, проявление и т.д.) они могут потеряться. Другим ограничением метода является достаточно высокая концентрация данных веществ, так как при низкой концентрации радиоактивного вещества время экспозиции увеличивается, при этом растет опасность появления фона засвеченных гранул AgBr за счет космического излучения.
Метод радиоавтографии – один из основных методов, позволяющих изучать динамику синтетических процессов, сравнить их интенсивность в разных клетках на одном и том же препарате. Так, например, с помощью этого метода при использовании меченых предшественников РНК было показано, что вся РНК синтезируется только в интерфазном ядре, а наличие цитоплазматической РНК является результатом миграции синтезированных молекул из ядра.
Метод радиоавтографии используется также для определения расположения определенных типов нуклеиновых кислот или отдельных нуклеотидных последовательностей в составе клеточных ядер или хромосом – метод молекулярной гибридизации. Для этого раствор с меченной нуклеиновой кислотой (например с рибосомной РНК) или с ее фрагментом (например, с сателитной ДНК) наносят на препарат, предварительно обработанный так, чтобы денатурировать ДНК (разорвать водородные связи в нативной ДНК) в составе хромосом или ядер, что достигается щелочной или температурной обработкой образца,. В процессе ренатурации ДНК происходит образование молекулярного гибрида между меченой нуклеиновой кислотой из раствора и комплементарным ему участком ДНК в препарате. Место такой гибридизации определяется радиоавтографически. Этот метод молекулярной гибридизации нуклеиновых кислот позволяет с большой точностью локализовать на хромосоме места с данной нуклеотидной последовательностью или даже расположение определенных генов.
Метод молекулярной гибридизации нуклеиновых кислот используется также при окраске их флуорохромами. Например, если выделенную ядрышковую ДНК, ответственную за синтез рибосомных РНК, предварительно связать с каким-либо флуорохромом, то после проведения ренатурации ДНК на препаратах с этой флуоресциирующей рибосомной ДНК, можно видеть, что флуоресценция будет наблюдаться только в ядрышках интерфазных клеток или только в зонах ядрышковых организаторов митотических хромосом. Таким образом можно в клетках локализовать любые последовательности ДНК и даже расположение в ядрах отдельных хромосом. Этот прием называется FISH-метод (флуоресцентная in situ гибридизация).
1. Фазово-контрастная микроскопия — позволяет резко повысить контрастность изображения объекта.
2. Поляризационная микроскопия — в поле зрения поляризационного микроскопа в результате двойного лучепреломления (“анизотропии”) объекты оказываются ярко светящимися на темном фоне.
3. Интерференционная микроскопия — при микроскопии свет разделяется на два пучка. Один из них проходит через объект, другой — мимо него. Вследствие этого свет, прошедший через объект, испытывает фазовый сдвиг и изображение строится таким образом, что участки клетки, обладающие разной плотностью, будут отличаться друг от друга по степени контрастности.
4. Микроскопия в темном поле — изображение попадает в объектив в результате отражения света от объекта, благодаря чему мельчайшие частицы выглядят светящимися точками на темном фоне.
5. Ультрафиолетовая микроскопия — компоненты объекта, совершенно не поглощающие видимый свет, обладают специфическим поглощением УФ-лучей с определенной длиной волны, что позволяет выявить подобные вещества без всякого окрашивания.
6. Флуоресцентная микроскопия — метод позволяет изучить как собственную (первичную) флуоресценцию ряда веществ, так и “вторичную”, вызванную окрашиванием клеточных структур флуорохромами.
1. Трансмиссионная электронная микроскопия — изображение на флуоресцирующем экране электронного микроскопа создается при рассеивании пучка электронов объектом, причем чем больше рассеивающая способность того или иного участка, тем более темным выглядит он на экране (рис. 1.1).
Рис. 1.1. Ход лучей в световом (а) и электронном (б) микроскопах: 1 — конденсорная линза; 2 — объект; 3 — объективная линза; 4 — окуляр (проекционная линза)

2. Сканирующая (растровая) электронная микроскопия — метод позволяет изучить трехмерную картину поверхности клетки в результате пробегания пучка электронов по поверхности объекта.
Метод фракционирования клетки — дифференциальное ультрацентрифугирование. Метод основан на разделении субклеточных фракций соответственно их массе, поверхности и плотности после гомогенизации ткани или разрушении клеточных границ различными механическими способами (рис. 1.2).
Изучение фиксированных клеток. Объектом являются клетки тканей, изучаемые с использованием специфической обработки и применением различных красителей.
Рис. 1.2. Схема фракционирования клетки: 1 — гомогенат; 2 — осаждение ядер; 3 — осаждение макросомальной фракции (митохондрии, лизосомы); 4 — осаждение микросомальной фракции (мембран, микросом)

Рентгеноструктурный анализ. Позволяет изучить конфигурацию молекул белка, нуклеиновых кислот и т. д. (рис. 1.3).
Рис. 1.3. Рентгенограмма. Связь между расстоянием и углом содержит информацию о кристаллической структуре

Витальное (прижизненное) изучение клеток. Объектом изучения являются свободноживущие простейшие организмы, клетки культуры ткани, а также клетки крови.
Изучение фиксированных клеток. Объектом являются клетки тканей, изучаемые с использованием специфической обработки и применением различных красителей.
1. Цитохимические методы исследования основаны на принципе специфического связывания красителей с определенными компонентами или веществами клетки.
2. Метод авторадиографии основан на регистрации веществ, меченных радионуклидами.
3. Иммуногистохимические методы применяются как для определения различных антигенов в клетках, так и для обнаружения тканевых антител.
4. Цитоспектрофотометрия основана на определении количества веществ в клетке и их составных элементов в зависимости от поглощения ими световых лучей определенной длины волны.
Микрохирургия. Метод позволяет выполнить с помощью специальных манипуляторов различные операции на клетке и ее органоидах.
Прижизненное окрашивание. Применяется для окрашивания живых клеток красителями в диапазоне концентраций, не вызывающих токсического эффекта.
Патофизиологический метод. Позволяет изучить физиологические процессы на отдельных изолированных клетках — мышцы, нервные стволы, ганглии и т. д.
Метод культуры тканей. Дает возможность исследовать живые клетки, помещенные в соответствующую среду, в которой они способны к автономному росту.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:

