История открытия серной кислоты кратко
Обновлено: 05.07.2024
Серная кислота представляет собой чрезвычайно агрессивное химическое соединение с формулой H 2 S O 4 . Это химическое соединение , которое производится больше всего в мире, поэтому оно используется в качестве одного из многих показателей промышленного потенциала стран. Большая часть используется для получения удобрений . Он также используется для синтеза других кислот и сульфатов и в нефтехимической промышленности .
Обычно его получают из диоксида серы путем окисления оксидами азота в водном растворе. Обычно затем проводят процессы для достижения более высокой концентрации кислоты. Раньше его называли маслом или купоросным спиртом , по имени, под которым были известны сульфатные соли, из которых его производили.
Молекула имеет пирамидальную структуру с атомом серы в центре и четырьмя атомами кислорода в вершинах. Два атома водорода связаны с атомами кислорода, не связанными двойными связями с серой. В зависимости от раствора эти атомы водорода могут диссоциировать. В воде он ведет себя как сильная кислота при первой диссоциации, давая анион гидросульфата , и как слабая кислота при второй, давая анион сульфата .
Он оказывает сильное обезвоживающее действие на молекулы углеводородов, таких как сахароза. Это означает, что он способен захватывать свои молекулы в виде воды, оставляя атомы углерода свободными с последующим образованием чистого углерода.
История
Открытие серной кислоты относится к 7 веку и алхимику Джабиру ибн Хайяну . Его исследовал позже, в IX веке, алхимик Ибн Закария ар-Рази , который получил вещество сухой перегонкой минералов, в том числе смеси сульфата железа (II) (FeSO 4 ) с водой и сульфатом меди (II) , (CuSO 4 ). При нагревании эти соединения разлагаются на оксид железа (II) и оксид меди (II) соответственно с образованием воды и оксида серы (VI). , что в совокупности дает разбавленный раствор серной кислоты. Этот метод стал популярным в Европе благодаря переводу арабских и персидских трактатов и книг европейских алхимиков 13-го века, таких как святой Альберт Великий .
Купорос считался важнейшим химическим веществом, и его пытались использовать как философский камень. Высокоочищенный купорос использовался как среда для взаимодействия в нем веществ.
В 17 веке немецкий химик Иоганн Глаубер получил серную кислоту путем сжигания серы с нитратом калия (KNO 3 ) в присутствии пара. По мере разложения нитрата калия сера окислялась до SO 3 , который в сочетании с водой образовывал серную кислоту. В 1736 году Джошуа Уорд, лондонский фармацевт, использовал этот метод для производства серной кислоты в больших количествах. [ 3 ]
В 1746 году в Бирмингеме Джон Робак начал производить его таким образом в свинцовых камерах, которые были прочнее и устойчивее и дешевле, чем стеклянные, использовавшиеся до того. Этот процесс со свинцовой камерой позволил эффективно индустриализировать производство серной кислоты, что, с небольшими улучшениями, поддерживало этот метод производства в течение как минимум двух столетий. [ 3 ]
Полученная таким образом кислота имела концентрацию всего 35-40%. Более поздние усовершенствования, проведенные французом Жозефом-Луи Гей-Люссаком и британцем Джоном Гловером, позволили увеличить этот показатель до 78%. Однако производство некоторых красителей и других химических продуктов, требующих более высокой концентрации в своих процессах, было достигнуто в 18 веке с помощью сухой перегонки минералов с использованием техники, аналогичной той, что использовалась алхимиками-предшественниками. При сжигании пирита (дисульфида железа) с сульфатом железа при 480°С получали серную кислоту любой концентрации, но этот процесс был чрезвычайно дорогим и невыгодным для крупномасштабного или промышленного производства.
В 1831 году продавец уксуса Перегрин Филлипс запатентовал гораздо более дешевый процесс производства оксида серы (VI) и концентрированной серной кислоты, теперь известный как контактный процесс . В настоящее время большая часть поставок серной кислоты производится этим методом. [ 4 ] [ 3 ]
физические свойства
Марки серной кислоты
Серная кислота реагирует со своим ангидридом SO
3 , чтобы сформировать H
2 С
2 НАШИ
7 , называемая серной кислотой , дымящейся серной кислотой , дисульфуровой кислотой или олеумом или, реже, кислотой Нордгаузена . Концентрации олеума выражены в % SO .
3 . (называемый % олеум) или как % H
2 ТАК
4 или как % H
2 ТАК
4 (количество, полученное, если добавить H
2 ИЛИ ; обычные концентрации составляют 40% олеума (109% H
2 ТАК
4 ) и 65% олеума (114,6% H
2 ТАК
4 ).Пуро Х
2 С
2 НАШИ
7 Это твердое вещество с температурой плавления 36 °C.
Чистая серная кислота имеет давление паров [ 7 ] , а 98% серная кислота имеет давление паров [ 8 ] >.
Коммерческая серная кислота продается в нескольких различных классах чистоты. Технический сорт Н
2 ТАК
4 он нечист и часто окрашен, но пригоден для изготовления удобрений. Чистые сорта, такие как Фармакопея США (USP), используются для изготовления фармацевтических препаратов и окрашивания вещей. Также доступны рейтинги аналитики .
Известно девять гидратов, но подтверждено, что три из них являются тетрагидратом (H 2 SO 4 -4H 2 O), гемигексагидратом (H 2 SO 4 - 6 1/2 H 2 O) и октагидратом (H 2 SO 4 -8H ). 2 ИЛИ).
Полярность и проводимость
| Разновидность | ммоль/кг |
|---|---|
| HSO − 4 | 15,0 |
| ЧАС 3 ТАК + 4 | 11.3 |
| ЧАС 3 НАШИ + | 8,0 |
| ГС 2 НАШИ − 7 | 4.4 |
| ЧАС 2 С 2 НАШИ 7 | 3,6 |
| ЧАС 2 НАШИ | 0,1 |
Безводный H _
2 ТАК
4 это высокополярная жидкость с диэлектрической проницаемостью около 100. Она обладает высокой электропроводностью , вызванной самодиссоциацией на протонированный ион и ион гидросульфата в процессе, известном как автопротолиз . [ 9 ]
2 часа
2 ТАК
4 ЧАС
3 ТАК +
4 + ХСО −
4
Константа равновесия автопротолиза равна
К ар (25 °С) = [ Н
3 ТАК +
4 ][ ХСО −
4 ] = 2,7 × 10–4
Для сравнения, константа равновесия для воды K w составляет 10 -14 , что в 10 10 (10 миллиардов) раз меньше.
Несмотря на вязкость кислоты, эффективная проводимость ионов H
3 ТАК +
4 и ХСО −
4 они высоки из-за внутримолекулярного механизма переключения протонов, аналогичного механизму Гротгуса в воде, поэтому серная кислота является хорошим проводником электричества. Он также является отличным растворителем для многих реакций. [ 9 ]
Кислотообразование
Серная кислота коммерчески доступна в большом количестве концентраций и степеней чистоты. Существует два основных процесса производства серной кислоты: метод со свинцовой камерой и контактный процесс. Процесс со свинцовой камерой является более старым из двух процессов и в настоящее время используется для производства большей части кислоты, используемой в производстве удобрений. Этот метод дает относительно разбавленную кислоту (62-78% H 2 SO 4 ). Контактный процесс дает более чистую, более концентрированную кислоту, но требует более чистого сырья и использования дорогих катализаторов. В обоих процессах диоксид серы (SO 2 ) окисляется и растворяется в воде. Оксид серы (IV) получают путем сжигания серы, обжига пирита ( дисульфида железа ), обжига других сульфидов цветных металлов или путем сжигания газообразного сероводорода (H 2 S). Исторически до них существовал еще один метод, но сегодня он не используется - процесс купороса. [ 10 ]
Получено в лаборатории
Этот раствор концентрируют путем выпаривания воды .
Ведущий камерный процесс
В процессе со свинцовой камерой горячий газообразный диоксид серы (SO 2 ) поступает через нижнюю часть реактора, называемого башней Гловера, где он промывается азотистым купоросом (серная кислота с оксидом азота (NO) и диоксидом азота (NO 2 ), растворенными в это), и смешанный с газообразным оксидом азота (NO) и оксидом азота (IV) (NO 2 ). Часть оксида серы (IV) окисляют до оксида серы (VI) (SO 3 ) и растворяют в кислотной ванне с образованием башенной кислоты или кислоты Гловера (примерно 78% H 2 SO 4 ).
Из башни Гловера смесь газов (включая оксиды серы (IV) и (VI), оксиды азота, азот, кислород и пар) переносится в камеру со свинцовой футеровкой, где она обрабатывается дополнительным количеством воды. Камера может представлять собой большое коробчатое пространство или корпус в форме усеченного конуса. Серная кислота образуется в результате сложной серии реакций; конденсируется на стенках и скапливается на полу камеры. Последовательно может быть от трех до шести камер, при этом газы последовательно проходят через каждую из камер. Кислота, производимая в камерах, обычно называемая камерной кислотой или удобрительной кислотой, содержит от 62% до 68% H 2 SO 4 .
После того, как газы прошли через камеры, они поступают в реактор, называемый башней Гей-Люссака, где промываются охлажденной концентрированной кислотой (из башни Гловера). Оксиды азота и непрореагировавший диоксид серы растворяются в кислоте с образованием азотистого купороса, используемого в башне Гловера. Остальные газы обычно выбрасываются в атмосферу.
контактный процесс
Процесс основан на использовании катализатора для превращения SO 2 в SO 3 , из которого гидратацией получают серную кислоту.
В этом процессе смесь сухих газов содержит от 7 до 10 % SO 2 , в зависимости от источника получения SO 2 (меньшее значение соответствует установкам, обжигающим пирит, а большее — установкам, сжигающим серу), и от 11 до 14 % O 2 , предварительно нагревается и после максимальной очистки поступает в конвертер с одним или несколькими каталитическими слоями, обычно пятиокисью платины или ванадия (V 2 O 5 ), где образуется SO 3 . Обычно используются два или более преобразователей.
Эффективность преобразования SO 2 в SO 3 в установке при нормальной работе находится в диапазоне от 96 до 97%, поскольку начальная эффективность 98% [ 11 ] снижается с течением времени. Этот восстановительный эффект более выражен в установках, где используются исходные пириты с высоким содержанием мышьяка, который полностью не устраняется и сопровождает газы, подвергающиеся катализу, вызывая отравление катализатора. Поэтому в отдельных случаях производительность может опускаться до значений, близких к 95%.
Во втором конвертере температура колеблется от 500 до 600 °С. Это выбрано для получения оптимальной константы равновесия с максимальной конверсией при минимальных затратах. Время пребывания газов в конвертере составляет примерно 2-4 секунды.
Газы от катализа охлаждаются примерно до 100 °C и проходят через колонну с олеумом для достижения частичного поглощения SO 3 . Отходящие газы проходят через вторую башню, где оставшийся SO 3 промывается 98%-ной серной кислотой. Наконец, неабсорбированные газы выбрасываются в атмосферу через дымовую трубу.
Существует заметная разница между производством SO 2 путем сжигания серы и путем обжига пирита, особенно если он содержит мышьяк. Пыль, образующаяся в процессе обжига, никогда не может быть полностью удалена и вместе с примесями, в основном мышьяком и сурьмой, значительно влияет на общую производительность установки.
Производство серной кислоты путем сжигания элементарной серы представляет собой лучший энергетический баланс, поскольку не нужно приспосабливаться к жестким системам очистки, которые обязательно необходимы на установках для обжига пирита.
Приложения
Сера в форме сульфата является важным источником питания для растений. Около 60 % всего производства серной кислоты используется в производстве удобрений. большая часть его используется в производстве фосфорной кислоты , которая, в свою очередь, используется для производства удобрений, таких как суперфосфаты извести, которые облегчают поглощение фосфатов растениями. Меньшие количества используются для производства нитросульфата аммония , простого азотного удобрения, получаемого химическим путем в результате реакции азотной и серной кислот с аммиаком . [ 9 ] [ 12 ] Другими важными областями применения являются нефтепереработка, производство пигментов, обработка стали, добыча цветных металлов, производство взрывчатых веществ, моющих средств, пластмасс и волокон.
Серная кислота в значительных количествах используется также в качестве реакционной среды в нефтехимических и органохимических процессах, включающих такие реакции, как нитрование, конденсация и дегидратация. В нефтехимической промышленности он используется для рафинирования, алкилирования и очистки дистиллятов сырой нефти.
В неорганической химической промышленности серная кислота используется в производстве пигментов оксида титана (IV) , соляной кислоты и плавиковой кислоты , которая заменила хлорфторуглероды в холодильной промышленности. [ 9 ]
В металлообработке серная кислота используется для обработки стали, меди, урана и ванадия, а также при приготовлении электролитических ванн для очистки и гальваники цветных металлов.
Для некоторых процессов в деревообрабатывающей и бумажной промышленности требуется серная кислота, а также для некоторых текстильных процессов, химических волокон и обработки шкур и шкур.
Что касается прямого использования, вероятно, наиболее важным применением является сульфид, который включается в результате органического сульфирования, особенно в производстве моющих средств. Автомобильные аккумуляторы содержат разбавленные растворы серной кислоты. Литий-серные батареи представляют интерес, поскольку они хранят больше энергии, чем литий-ионные батареи. [ 9 ]
меры предосторожности
Приготовление раствора кислоты может быть опасным из-за выделяющегося в процессе тепла. Крайне важно, чтобы концентрированная кислота добавлялась в воду (а не наоборот), чтобы использовать преимущества высокой теплоемкости воды и более высокой температуры кипения кислоты. Кислоту можно нагреть до температуры выше 100°C, что приведет к быстрому закипанию капли. Если к концентрированной кислоте добавить воду, могут появиться брызги кислоты. [ 13 ] [ 14 ]
Серная кислота является одним из важнейших продуктов, характеризующий общий уровень развития химической промышленности страны. Объем производства серной кислоты исчисляется десятками миллионов тонн и среди продуктов химической промышленности она по праву занимает первое место. Это объясняется ее широким использованием в различных отраслях промышленности. Серная кислота одна из самых сильных минеральных кислот и самая дешевая. Самый крупный ее потребитель – производство минеральных удобрений (≈41% вырабатываемой в России кислоты): она необходима для получения двойного суперфосфата, фосфорной кислоты и сульфата аммония.
Другие области применения серной кислоты: нефтепереработка, производство синтетических волокон, металлургия, производство красителей и пигментов, текстильная и кожевенная промышленности, гальваника, производство взрывчатых веществ и т.д.
Исходным веществом для производства серной кислоты является сернистый ангидрид SO2, который образуется в результате сжигания серы или серосодержащего сырья. Переработка сернистого ангидрида в серную кислоту включает обязательное его окисление до серного ангидрида и последующую адсорбцию его водой.
Скорость взаимодействия сернистого ангидрида с кислородом в обычных условиях очень мала, поэтому в промышленности эту реакцию проводят:
1. Контактным методом – это окисление SO2 кислородом на катализаторе
2. Нитрозным методом окисления с помощью оксидов азота, содержащихся в серной кислоте.
В настоящее время контактным методом получают более 80% всего объема серной кислоты и олеума.
Серную кислоту получают уже более 1000 лет.
Первое упоминание о серной кислоте обнаружено в сочинениях персидского алхимика в 940 году.
Первое упоминание о кислых газах, получаемых при прокаливании квасцов или купороса, встречается в сочинениях, приписываемых арабскому алхимику Джафар аль-Суфи (Гебер), жившему в VIII в. Некоторые ученые приписывают честь открытия серной кислоты персидскому алхимику Абубекеру аль-Рази, жившему в Х в. Более определенно говорит о серной кислоте алхимик Альберт Великий.
В 15 веке серную кислоту получали совместным сжиганием серы и селитры в сосудах большого объема, стенки которого смачивали водой. Этим способом ее и получали более 300 лет, но небольшими количествами в ретортах – стеклянных колбах.
Таким способом получали кислоту на первом промышленном заводе в Англии. Сжигали в металлических сосудах, а выделяющиеся газы поглощали водой в другом аппарате – стеклянном.
И только в середине XVIII в. (в 1746гю), когда обнаружили, что свинец является материалом весьма стойким против серной кислоты, стали постепенно переходить от стеклянной лабораторной аппаратуры к большим свинцовым коробкам или камерам, отчего пошло название – камерный способ.. В них сжигалась смесь серы и селитры. Образовавшийся оксид серы(VI) SO3 здесь же поглощался водой или раствором кислоты, налитой в камеры. Процесс приходилось прерывать для загрузки камер.
Контактный метод возник в 1831г. когда англичанин Филипс предложил окислять SO2 кислородом, пропуская через раскаленный платиновый катализатор.
Промышленное производство серной кислоты получило быстрое развитие в начале XIX в. Этот рост был вызван развитием производства соды и других продуктов, для которых была необходима серная кислота. В это время химики Н. Клеман и Ш. Б. Дезорм выяснили сущность процесса. Они показали, что оксиды азота играют роль передатчиков кислорода воздуха диоксиду серы, и предложили питать камеры непрерывным током сернистого газа SO2, для чего стали сжигать серу в отдельных печах. Вместо селитры употребляли азотную кислоту. Кроме того, в камеры вводили водяной пар. Производство стало непрерывным, однако кислота обходилась дорого до тех пор, пока единственным сырьем для него была сера, а расход азотной кислоты был велик, т.к. оксиды азота безвозвратно терялись с отходящими газами.

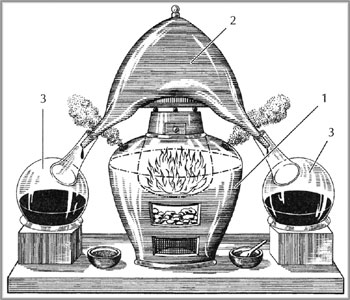
Рис. 1 Установка для получения серной кислоты сжиганием серы в присутствии селитры, XVIII в.: 1 – печь, разогреваемая углями; 2 – стеклянный сосуд, где образующиеся газы взаимодействуют с парами воды; 3 – колбы, в которые собирают олеум
Дальнейшие работы химиков устранили эти недостатки. Ж.Л.Гей-Люссак предложил улавливать оксиды азота при помощи серной кислоты, стекающей в установленную после камер башню навстречу отходящим газам.
Получающуюся в башнях кислоту называют нитрозой. Английский технолог Дж. Гловер предложил выделять оксиды азота из нитрозы в башне, в которой навстречу кислоте проходят газы обжига. Эту башню ставят перед камерами. Оксиды азота поступают в камеры, и таким образом совершается их круговорот. Таким образом, осуществлялся нитрозный способ (оксиды азота выделялись за счет разложения селитры).
Еще в XV–XVI вв. извлекать серу умели из пирита FeS2 – более дешевого и распространенного сырья, чем сера. В 1833 г. было предложено использовать этот минерал для получения из него сернистого газа и построить для этой цели специальную печь.
Благодаря всем этим усовершенствованиям серная кислота стала дешевым продуктом.
Производство кислот
Серная кислота является одним из важнейших продуктов, характеризующий общий уровень развития химической промышленности страны. Объем производства серной кислоты исчисляется десятками миллионов тонн и среди продуктов химической промышленности она по праву занимает первое место. Это объясняется ее широким использованием в различных отраслях промышленности. Серная кислота одна из самых сильных минеральных кислот и самая дешевая. Самый крупный ее потребитель – производство минеральных удобрений (≈41% вырабатываемой в России кислоты): она необходима для получения двойного суперфосфата, фосфорной кислоты и сульфата аммония.
Другие области применения серной кислоты: нефтепереработка, производство синтетических волокон, металлургия, производство красителей и пигментов, текстильная и кожевенная промышленности, гальваника, производство взрывчатых веществ и т.д.
Исходным веществом для производства серной кислоты является сернистый ангидрид SO2, который образуется в результате сжигания серы или серосодержащего сырья. Переработка сернистого ангидрида в серную кислоту включает обязательное его окисление до серного ангидрида и последующую адсорбцию его водой.
Скорость взаимодействия сернистого ангидрида с кислородом в обычных условиях очень мала, поэтому в промышленности эту реакцию проводят:
1. Контактным методом – это окисление SO2 кислородом на катализаторе
2. Нитрозным методом окисления с помощью оксидов азота, содержащихся в серной кислоте.
В настоящее время контактным методом получают более 80% всего объема серной кислоты и олеума.
Серную кислоту получают уже более 1000 лет.
Первое упоминание о серной кислоте обнаружено в сочинениях персидского алхимика в 940 году.
Первое упоминание о кислых газах, получаемых при прокаливании квасцов или купороса, встречается в сочинениях, приписываемых арабскому алхимику Джафар аль-Суфи (Гебер), жившему в VIII в. Некоторые ученые приписывают честь открытия серной кислоты персидскому алхимику Абубекеру аль-Рази, жившему в Х в. Более определенно говорит о серной кислоте алхимик Альберт Великий.
В 15 веке серную кислоту получали совместным сжиганием серы и селитры в сосудах большого объема, стенки которого смачивали водой. Этим способом ее и получали более 300 лет, но небольшими количествами в ретортах – стеклянных колбах.
Таким способом получали кислоту на первом промышленном заводе в Англии. Сжигали в металлических сосудах, а выделяющиеся газы поглощали водой в другом аппарате – стеклянном.
И только в середине XVIII в. (в 1746гю), когда обнаружили, что свинец является материалом весьма стойким против серной кислоты, стали постепенно переходить от стеклянной лабораторной аппаратуры к большим свинцовым коробкам или камерам, отчего пошло название – камерный способ.. В них сжигалась смесь серы и селитры. Образовавшийся оксид серы(VI) SO3 здесь же поглощался водой или раствором кислоты, налитой в камеры. Процесс приходилось прерывать для загрузки камер.
Контактный метод возник в 1831г. когда англичанин Филипс предложил окислять SO2 кислородом, пропуская через раскаленный платиновый катализатор.
Промышленное производство серной кислоты получило быстрое развитие в начале XIX в. Этот рост был вызван развитием производства соды и других продуктов, для которых была необходима серная кислота. В это время химики Н. Клеман и Ш. Б. Дезорм выяснили сущность процесса. Они показали, что оксиды азота играют роль передатчиков кислорода воздуха диоксиду серы, и предложили питать камеры непрерывным током сернистого газа SO2, для чего стали сжигать серу в отдельных печах. Вместо селитры употребляли азотную кислоту. Кроме того, в камеры вводили водяной пар. Производство стало непрерывным, однако кислота обходилась дорого до тех пор, пока единственным сырьем для него была сера, а расход азотной кислоты был велик, т.к. оксиды азота безвозвратно терялись с отходящими газами.

Рис. 1 Установка для получения серной кислоты сжиганием серы в присутствии селитры, XVIII в.: 1 – печь, разогреваемая углями; 2 – стеклянный сосуд, где образующиеся газы взаимодействуют с парами воды; 3 – колбы, в которые собирают олеум
Дальнейшие работы химиков устранили эти недостатки. Ж.Л.Гей-Люссак предложил улавливать оксиды азота при помощи серной кислоты, стекающей в установленную после камер башню навстречу отходящим газам.
Получающуюся в башнях кислоту называют нитрозой. Английский технолог Дж. Гловер предложил выделять оксиды азота из нитрозы в башне, в которой навстречу кислоте проходят газы обжига. Эту башню ставят перед камерами. Оксиды азота поступают в камеры, и таким образом совершается их круговорот. Таким образом, осуществлялся нитрозный способ (оксиды азота выделялись за счет разложения селитры).
Еще в XV–XVI вв. извлекать серу умели из пирита FeS2 – более дешевого и распространенного сырья, чем сера. В 1833 г. было предложено использовать этот минерал для получения из него сернистого газа и построить для этой цели специальную печь.
Благодаря всем этим усовершенствованиям серная кислота стала дешевым продуктом.
Не очень часто нам приходится иметь дело непосредственно с серной кислотой. Может показаться, что не так уж она нам и нужна. А между тем трудно найти другой продукт, который был бы так важен, как серная кислота.
Посмотрим повнимательнее вокруг. Предмет первой необходимости для нас – растительная пища: хлеб, овощи, крупа и т.п. Удовлетворить эту насущную потребность можно при хорошем урожае. Получить же такой урожай возможно при помощи минеральных удобрений. На их изготовление тратится около половины всей серной кислоты, получаемой на химических заводах. Без нее мы не могли бы получать питательные вещества в достаточной мере.
Наша одежда, белье сделаны из хлопчатобумажной, шерстяной или льняной ткани. Хлопок, лен, идущие на изготовление соответствующей ткани, тоже нуждаются в удобрениях, получаемых при помощи серной кислоты.
Кроме того, ткань требует после выхода с ткацкой машины последующей обработки – аппретуры, только тогда она получает свой настоящий вид. Аппретурная обработка производится особой массой, состоящей из сульфатов алюминия и бария, получаемых при помощи серной кислоты.
Чтобы окрасить шерстяную или хлопчатобумажную ткань, требуется протравливание, т.е. пропитка ткани такими солями, главным образом сульфатами, которые прочно соединяются как с самой тканью, так и с красителями, благодаря чему окрашенная ткань не линяет при стирке. Эти соли без серной кислоты изготовить, конечно, невозможно. Сами красители тоже не могут быть изготовлены без серной кислоты.
Мы носим кожаную обувь. Для получения ее из сырых шкур требуется освобождение их от волоса, смягчение, дубление, окраска. Все эти операции не могут обойтись без серной кислоты и ряда ее солей, например квасцов, изготовляемых при ее помощи.
Современное человеческое общество никоим образом без серной кислоты обойтись не может. Оказывается, помыться, быть чистым тоже нельзя без косвенного участия серной кислоты. Мы моемся мылом, стирка белья без мыла или стирального порошка невозможна. Мыло и порошки готовят из соды и жирных кислот. Чтобы получить жирные кислоты из жиров и очистить их, нужна серная кислота.
Вы читаете книгу, напечатанную на проклеенной бумаге, пишете на такой бумаге. Проклейка бумаги производится при помощи сульфата алюминия, т.е. опять при участии серной кислоты. Чернила готовили при помощи железного купороса, получаемого обработкой серной кислоты железом. Значит, и распространение культуры немыслимо без применения серной кислоты.
Ни один двигатель, ни одна машина, ни один станок не может работать без смазочных масел, керосина и других продуктов, получаемых из нефти, очистка которой производится при помощи серной кислоты. Значит, работа наших фабрик, заводов, движение поездов, пароходов, полет самолетов находятся в зависимости от нее.
Лужение, никелирование, серебрение, меднение проводятся при помощи сульфатов. Очистка некоторых металлов (серебра, меди и др.) проходит также при участии серной кислоты.
Для производства кислот, например уксусной, солей, неорганических и органических красок требуется серная кислота. Фармацевтическая отрасль промышленности, производство искусственного волокна не могут обойтись без серной кислоты. Взрывчатые вещества готовятся при участии концентрированной серной кислоты.
Некоторые области применения серной кислоты
Легко убедиться, что области применения серной кислоты очень обширны. Однако некоторые позиции у серной кислоты отвоеваны. Долгое время соду получали из сульфата натрия Na2SO4 – продукта, получаемого одновременно с соляной кислотой при действии серной кислоты на поваренную соль. К концу XIX в. осуществлен другой, более выгодный, так называемый аммиачный метод получения соды:
После этого содовое производство перестало зависеть от производства серной кислоты.
Другая независимая от серной кислоты важная крупная отрасль, возникшая в начале XX в. и колоссально разросшаяся в настоящее время, – производство аммиака и азотной кислоты из воздуха. До того времени азотную кислоту получали из чилийской селитры с помощью серной кислоты:
Азотная кислота частично заменила серную в производстве фосфорных удобрений. Распространены методы очистки органических продуктов, не требующие серной кислоты.
Таким образом, крупные отрасли химической отрасли промышленности – содовая и азотная – вышли полностью из-под власти серной кислоты, но в других областях серная кислота продолжает в настоящее время господствовать, поэтому огромное ее значение для всей нашей промышленности является несомненным.
История производства серной кислоты
Первое упоминание о кислых газах, получаемых при прокаливании квасцов или купороса, встречается в сочинениях, приписываемых арабскому алхимику Джафар аль-Суфи (Гебер), жившему в VIII в. Некоторые ученые приписывают честь открытия серной кислоты персидскому алхимику Абубекеру аль-Рази, жившему в Х в. Более определенно говорит о серной кислоте алхимик Альберт Великий.
В XV в. алхимики открыли, что серную кислоту можно получить, сжигая смесь серы и селитры. Этим способом ее и получали более 300 лет, но небольшими количествами в ретортах – стеклянных колбах. И только в середине XVIII в., когда обнаружили, что свинец является материалом весьма стойким против серной кислоты, стали постепенно переходить от стеклянной лабораторной аппаратуры к большим свинцовым коробкам или камерам. В них сжигалась смесь серы и селитры. Образовавшийся оксид серы(VI) SO3 здесь же поглощался водой или раствором кислоты, налитой в камеры. Процесс приходилось прерывать для загрузки камер.
Производство серной кислоты получило быстрое развитие в начале XIX в. Этот рост был вызван развитием производства соды и других продуктов, для которых была необходима серная кислота. В это время химики Н.Клеман и Ш.Б.Дезорм выяснили сущность процесса. Они показали, что оксиды азота играют роль передатчиков кислорода воздуха диоксиду серы, и предложили питать камеры непрерывным током сернистого газа SO2, для чего стали сжигать серу в отдельных печах. Вместо селитры употребляли азотную кислоту. Кроме того, в камеры вводили водяной пар. Производство стало непрерывным, однако кислота обходилась дорого до тех пор, пока единственным сырьем для него была сера, а расход азотной кислоты был велик, т.к. оксиды азота безвозвратно терялись с отходящими газами.
Установка для получения серной кислоты
сжиганием серы в присутствии селитры, XVIII в.:
1 – печь, разогреваемая углями; 2 – стеклянный сосуд,
где образующиеся газы взаимодействуют с парами воды;
3 – колбы, в которые собирают олеум
Дальнейшие работы химиков устранили эти недостатки. Ж.Л.Гей-Люссак предложил улавливать оксиды азота при помощи серной кислоты, стекающей в установленную после камер башню навстречу отходящим газам.
Получающуюся в башнях кислоту называют нитрозой. Английский технолог Дж.Гловер предложил выделять оксиды азота из нитрозы в башне, в которой навстречу кислоте проходят газы обжига. Эту башню ставят перед камерами. Оксиды азота поступают в камеры, и таким образом совершается их круговорот.
Еще в XV–XVI вв. извлекать серу умели из пирита FeS2 – более дешевого и распространенного сырья, чем сера. В 1833 г. было предложено использовать этот минерал для получения из него сернистого газа и построить для этой цели специальную печь.
Благодаря всем этим усовершенствованиям серная кислота стала дешевым продуктом.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
«Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота… (Д. И. Менделеев )

Серная кислота (или старое название — купоросное масло) была известна с давних времен.

2. Средние века. Алхимикам удалось получить серную кислоту в 10 веке при прокаливании солей - сульфатов (купоросов). Отсюда произошло историческое название серной кислоты - купоросное масло.



3 . Андреас Либавий (16 век) – технический способ получения серной кислоты.


4. 1746 год (Англия)-первый камерный завод по производству серной кислоты. В основе лежит реакция гореия на воздухе смеси серы и калийной селитры. Процесс проводился в камерах, обитых свинцом, нерастверимым в серной кислоте. Продуктами горения являлись оксиды азота, соли калия и SO 3 . Последний поглощался водой, находящийся в камере. Таким образом, удалось получить кислоту небольшой крепости, которую концентрировали известными методами.
5. 1805 год (0Москва)- получение серной кислоты на заводе князя Галицына.
6. Современные заводы по производству серной кислоты


Свободная серная кислота встречается в природе очень редко. В атмосфере она образуется из диоксида серы, который образуется при сгорании серосодержащих веществ или вулканических извержений. Диоксид серы окисляется гидроксильными радикалами и кислородом с образованием триоксида серы, который вступая в реакцию с атмосферной влагой образует кислоту. В кислотных дождях она выступает в разбавленном виде. Небольшое количество свободной серной кислоты также можно найти в некоторых вулканических источниках, которые называются сольфатары.
Велики запасы серной кислоты в озерах вулканического происхождения.
Наибольшее количество серной кислоты в мире содержит озеро в кратере вулкана Иджен в Индонезии.

В восточной части острова Ява, что находится в Индонезии, есть удивительное по красоте, но очень опасное по своей природе место – это вулкан Kawah Ijen. Вулкан находится на высоте около 2400 метров над уровнем море, диаметр его кратера 175 метров, а глубина – 212 метров. В его жерле расположено, наверное, самое странное и пугающее озеро прекрасного яблочно-изумрудного цвета, в котором рискнет искупаться разве что Терминатор, поскольку вместо воды в нем серная кислота . А точнее сказать – смесь серной и соляной кислоты объемом 40 млн. тонн .

Вулкан Головнина находящейся на юге острова Кунашир представляет собой обширную вулканическую котловину, окруженную гребнем, достигающим высоты более 540 м. Вулкан является действующим.

Температура воды в озере Кипящее достигает 80 градусов, местами доходя до более высоких показателей. Озерные осадки насыщены серой, которая соединяясь с металлами, образует на поверхности озера чёрную сульфидно-серную пену. Из-за чего цвет воды становится свинцово-серым. Берег же покрыт изжелта-чёрным песком. Японцы в начале прошлого столетия добывали здесь серу. С тех времён в окрестностях Кипящего озера сохранились большие чугунные котлы, в которых ее выплавляли.
В составе воды Кипящего озера имеются большие концентрации мышьяка, сурьмы, а также солей тяжелых металлов, что делает купание в этой воде опасным, не говоря уже о том, что здесь можно запросто свариться. Но панорама озера столь красива и необычна, что стоит посетить его хотя бы раз в жизни.

Среди самых необычных природных достопримечательностей России -ярко-голубое кислотное озеро, образовавшееся в кратере вулкана Малый Семячик на Камчатке - озеро Троицкого (1952г). В одном из трех кратеров Малый Семячик образовалось озеро шириной 500 метров и длиной 140 метров. Это озеро состоит из подогретого до 40 градусов растворов серной и соляной кислот средней концентрации. Несмотря на то, что вулкан считается активным, кислотное озеро стало одним из самых популярных туристических мест на Камчатке.


У берегов озера не растут растения, там не живут рыбы или другие живые организмы, а птицы там никогда не летают. Даже насекомые не рискуют подходить близко к этому месту. Любой, кто нечаянно попадает в озеро, сразу умирает. Если на пару секунд опустить в озеро руку, то моментально кожа на руке покраснеет, покроется волдырями, и начнет облазить, обнажая мышечную ткань. Озеро Смерти в Сицилии – совершенно пустынное место, где не встречается ни один живой организм, а на его берегах нет даже самой скудной растительности. Близкое пребывание близ этого водоема грозит все живым существам большой опасностью. Если окунуть человека в эту свинцово-серую пучину, то за считанные минуты от него не останется даже костей.

Думаете, это история фильма ужасов? Нет, это самая настоящая картинка из жизни. И это произойдет из-за того, что озеро представляет собой ни что иное, как резервуар агрессивной опасной серной кислоты. В 1999 г. исследователи после кропотливого и опасного изучения дна этого озера выяснили, что эта кислота поступает через два подземных источника. На дне озера находится два источника, которые выбрасывают ядовитое вещество в воду, тем самым делая ее непригодной для жизни.
Читайте также:

