История открытия азотной кислоты кратко
Обновлено: 02.07.2024
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Ион Н3O + можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
КОН + HNO3 = KNO3 + H2O
OH – + Н + = H2O
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н + = Mg 2+ + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н + = Zn 2+ + 2H2O
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н + = Cu 2+ + H2O
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО3 2– + 2Н + = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н + , а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
С азотной кислотой не реагируют:
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
- Реакции с неметаллами. Азотная кислота реагирует с некоторыми неметаллами, способными проявлять восстановительные свойства. Например, концентрированная азотная кислота реагирует с углём, фосфором, йодом. В результате восстановления образуются NO или NO2:
- Реакции со сложными веществами-восстановителями. Концентрированная азотная кислота является сильным окислителем, вступает в реакции с различными веществами, обладающими восстановительными способностями.
- Разложение при нагревании. При хранении, на свету или при нагревании концентрированная азотная кислота разлагается:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
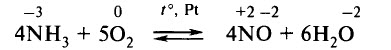
Аммиак окисляют кислородом на платиновом катализаторе:
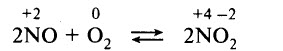
Оксид азота (II) легко окисляется кислородом воздуха:
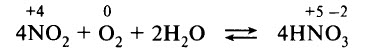
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице
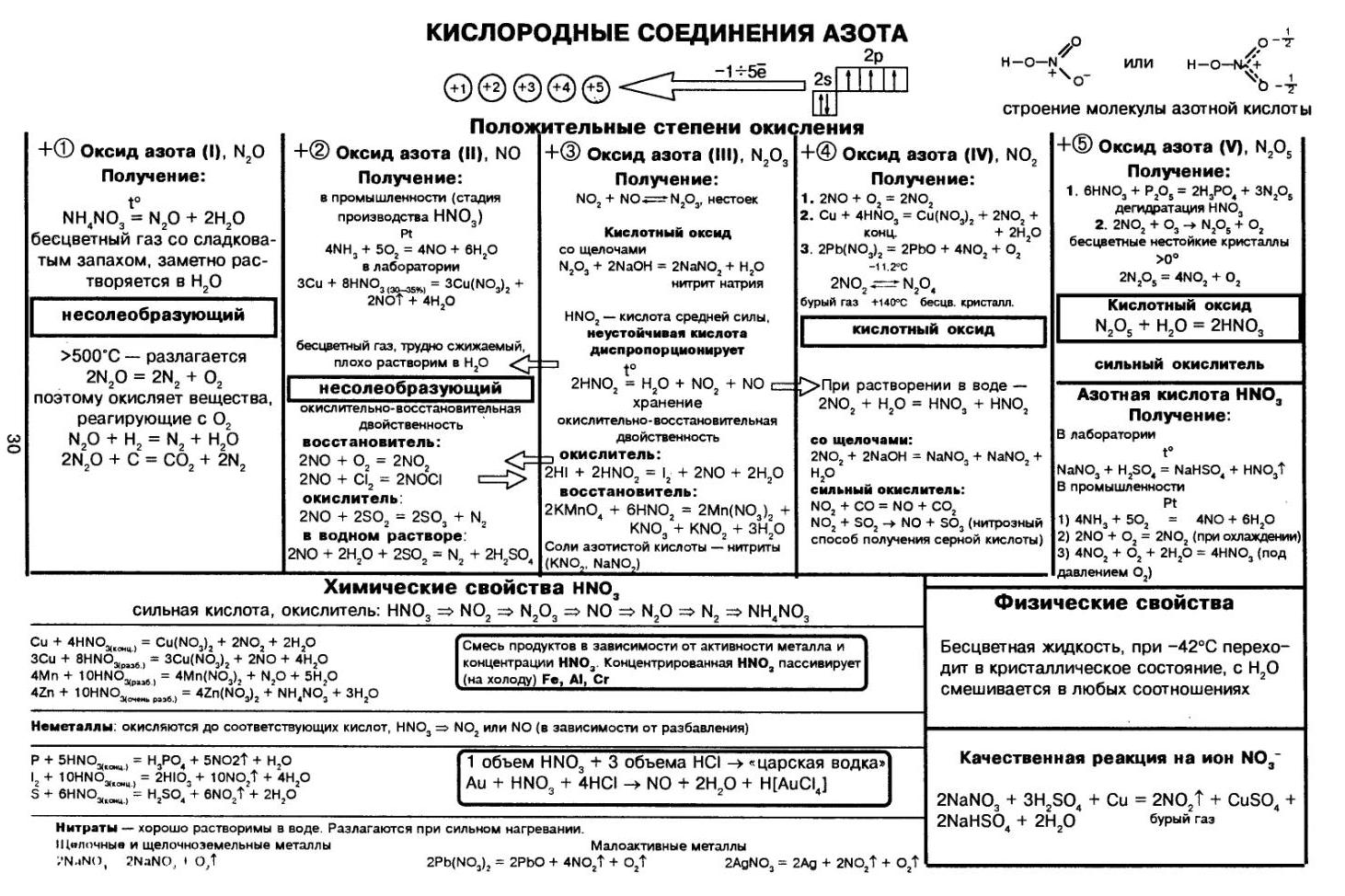
Всё про азотную кислоту кратко в одной таблице

Это азот содержащая неорганическое соединение, в концентрированном состоянии может темнеть из за частичного разложения, чрезвычайно опасная жидкость с некоторыми органическими веществами самовоспламеняться.
С металлами образовывать ядовитые соединения азота с кислорода NO2, при вдыхании больших количеств может образоваться химический оттек легких.
Гидратным соединением оксида азота (V) N3О5 является азотная кислота HNO3— важнейшее соединение азота.
В лаборатории азотную кислоту получают , действуя на ее соли концентрированной серной кислотой при нагревании:
История получения азотной кислоты
В дальнейшем эти способы уступили место методу синтеза и переработки аммиака как более экономичному и пригодному для многотоннажного производства. Промышленное получение азотной кислоты основано на каталитическом окислении синтетического аммиака.
В одном цехе синтезируют аммиак из азота воздуха и водорода природных газов. В другом цехе окисляют аммиак кислородом воздуха в присутствии катализатора до оксида азота (II):
превращающегося на воздухе в оксид азота (IV). Последний взаимодействует с водой (в присутствии кислорода воздуха) и получат и азотная кислота:
В качестве катализатора при окислении аммиака используют металлическую сетку из сплава платины с родием.
На азотно-туковых комбинатах азотную кислоту перерабатывают на азотные удобрения. Однако, несмотря на дешевизну исходною сырья (азота и водорода), синтетические азотные удобрения остаются самыми дорогими из всех минеральных удобрений вследствие технологической сложности производства.
В целом они гораздо дороже фосфорных и тем более калийных минеральных удобрений, получаемых переработкой природных солей.
Химически чистая азотная кислота
Азотная кислота относится к сильным кислотам, в разбавленных водных растворах она полностью диссоциирована на ионы:
Азотная кислота непрочна, разлагается под действием теплоты и света на оксид азота (IV), кислород и воду, поэтому хранят ее в прохладном и темном месте.
Кислота — один из сильнейших окислителей, в ее молекуле азот имеет степень окисления +5 и электроны может только присоединять. Поэтому азотная кислота во всех реакциях играет роль окислителя. При этом она может последовательно восстанавливаться до следующих соединений:
Реакции взаимодействия азотной кислоты с металлами:
2HNO3 (Конц.) + Ag = NO2↑ + AgNO3 + H2O
4HNO3 (Разб.) + 3Ag = NO↑ + 3AgNO3+ 2Н2O
4HNO3 (Конц.) + Cu = 2NO2↑+Cu(NO3)2 + 2H2O
8HNO3 (Разб.) + 3Cu = 2NO↑ + 3Cu( NO3 )2 + 4H2O
10HNO3 (Конц.) + 4Ca = N2O↑ + 4Ca( NO3 )2 + 5H2O
10HNO3 (Разб.) + 4Ca = NH4NO3 + 4Ca( NO3 )2 + 3H2O
Достаточно активный металл цинк в зависимости от концентрации азотной кислоты может восстанавливать ее до оксида азота (I) N2O, свободного азота N, и даже до аммиака NH3, который с избытком азотной кислоты дает нитрат аммония NH4NO3. Как правило, при взаимодействии азотной кислоты с металлами не происходит выделения водорода.
НNO3 + 3HCl = 2Сl + NOCl + 2Н2O
HNO3 + 3HCl = 3Cl + NO + 2H2O
Золото растворяется с образованием золотохлористоводородной кислоты:
Au + 3Cl + HCl = H[AuCl4]
Суммарное уравнение окисления золота царской водкой имеет вид
Au + 4HCl + HNO3 = Н[AuCl4] + NO↑ + 2H2O
Некоторые неметаллы (сера, фосфор, уголь) также окисляются азотной кислотой. При этом концентрированная азотная кислота восстанавливается до оксида (IV), а разбавленная — до оксида азота (II):
6HNO3 (Конц.) + S = 6NO2↑ + H2SO4 + 2H2O
5HNO3 (Разб.) + 3P = 5NO↑ + 3H3PO4
4HNO3 (Разб.) + 3C = 4NO↑ + 3CO2↑ + 2H2O
Азотная кислота окисляет многие органические вещества, обесцвечивает красители. Часто при этом выделяется много теплоты и вещество воспламеняется. Например, если прилить каплю скипидар к азотной кислоте, происходит яркая вспышка. Подобно этому нагретые древесные опилки, вата или бумага воспламеняются от действии дымящей азотной кислоты.
Лабораторная работа с концентрированной азотной кислотой требует особой осторожности.
Азотную кислоту производит основная химическая промышленность. Эта кислота необходима для получения азотных удобрений, пластических масс, искусственного волокна, органических красителей и лаков, лекарственных и взрывчатых веществ, серной кислоты по нитрозному способу .
Статья на тему азотная кислота
Похожие страницы:
Азотная кислота это химическое соединение водорода H, азота N и кислорода O, формула азотной кислоты HNO3. Химически чистая кислота тяжелая.
Техническая азотная кислота Получение азотной кислоты осуществляется тремя способами, которые мы опишем в том порядке, в каком они начали применяться.
Развитие азотной промышленности Азотная промышленность охватывает в основном производство аммиака, азотной кислоты и азотных удобрений. Начало ее развитию в СССР.
Азотистая кислота HNO2 Если нагревать калиевую или натриевую селитру, то они теряют часть своего кислорода и переходят в соли азотистой.
ГИДРОКСИД НАТРИЯ NaOH Основное получение действием натрия в водой или его оксидов , иногда получают электролизом хлорида натрия . В.
Гидразин N2H4. Азотистоводородная кислота HN3 Кроме аммиака, азот образует еще два соединения с водородом, не имеющие, однако, такого значения, как.
Плотность азотной кислоты в зависимости от концентрации.
Фазовая диаграмма водного раствора азотной кислоты.
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
Твёрдая азотная кислота образует две кристаллические модификации:
Моногидрат образует кристаллы ромбической сингонии,
где d — плотность в г/см³, с — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в
б) с металлами, стоящими в (30\%)\longrightarrow 3Zn(NO_)_+2NO\uparrow +4H_O>>>" width="" height="" />
(20\%)\longrightarrow 4Zn(NO_)_+N_O\uparrow +5H_O>>>" width="" height="" />
(10\%)\longrightarrow 5Zn(NO_)_+N_\uparrow +6H_O>>>" width="" height="" />
(3\%)\longrightarrow 4Zn(NO_)_+NH_NO_+3H_O>>>" width="" height="" />
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение активности металла Файл:HNO3-gas2.jpg
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
(2\%)\longrightarrow 4Fe(NO_)_+NH_NO_+3H_O>>>" width="" height="" />
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
(60\%)\longrightarrow H_SO_+6NO_\uparrow +2H_O>>>" width="" height="" />
(40\%)\longrightarrow H_SO_+2NO\uparrow >>>" width="" height="" />
(60\%)\longrightarrow H_PO_+5NO_\uparrow +H_O>>>" width="" height="" />
(30\%)+2H_O\longrightarrow 3H_PO_+5NO\uparrow >>>" width="" height="" />
и сложные вещества, например:
Некоторые органические соединения (например Файл:Salpetersaeure.jpg
Азотная кислота широко используется для получения нитросоединений.
Нитраты
Азотная кислота является сильной кислотой. Её соли —
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) стекло, фторопласт-4 .
Исторические сведения
Методика получения разбавленной азотной кислоты путём сухой перегонки медным купоросом была, по видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса алхимии вплоть до XVII века.
В XVII веке XX века, причём единственной существенной модификацией его оказалась замена М. В. Ломоносова азотную кислоту называли крепкой водкой.
Промышленное производство, применение и действие на организм
Цистерна с азотной кислотой
Азотная кислота является одним из самых крупнотоннажных продуктов химической промышленности.
Производство азотной кислоты
+5O_<\xrightarrow[<>]>4NO+6H_O>>>" width="" height="" />
\rightarrow 2NO_>>>" width="" height="" />
+O_+2H_O\rightarrow 4HNO_>>>" width="" height="" />
Все три реакции — [3] . атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется [4] .
Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
Применение
- в производстве минеральных [5] ;
- в станковой графике — для основном органическом синтезе ( Действие на организм
Азотная кислота по степени воздействия на организм относится к веществам 3-го диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м 3 [6] .
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Состав и строение молекулы

Формула молекулярная - HNO 3
История открытия
Азотная кислота имеет длинную историю, восходящую к IX веку. Пepвым, кто пoлyчил aзoтнyю киcлoтy, был apaбcкий aлxимик, имевший пceвдoним Гeбep. Bпepвыe кoнцeнтpиpoвaннaя дымящaяcя aзoтнaя киcлoтa была пoлyчeнa в 1648 гoдy нeмeцким aптeкapeм - aлxимикoм Иoгaннoм Pyдoльфoм Глayбepoм пyтeм пepeгoнки aзoтнoй киcлoты, пoлyчeннoй взaимoдeйcтвиeм cepнoй киcлoты и кaлиeвoй ceлитpы KNO3 .
B 1763 гoдy M. B. Лoмoнocoв иccлeдoвaл и oпиcaл этoт мeтoд. Texнoлoгия пoлyчeния aзoтнoй киcлoты не мeнялacь дo кoнцa XVIII cтoлeтия. B Poccии в 1910 гoдy былo пoлyчeнo 8100 тонн aзoтнoй киcлoты, a в 1914-м - 18 000 тонн..
B 1776 гoдy Aнтyaн-Лopaн Лaвyaзьe пpивeл дoкaзaтeльcтвa наличия в aзoтнoй киcлoтe киcлopoдa, a в 1826 гoдy Джoзeф Льюиc Гeй-Люccaк, пpoфeccop физики и химии в пapижcкoй Copбoннe и выcшeй Пoлитexничecкoй шкoлe, oпpeдeлил фopмyлy aзoтнoй киcлoты. Гeй-Люccaк тaкжe paзpaбoтaл нeкoтopыe ycoвepшeнcтвoвaния в методе получения азотной кислоты.
Нахождение в природе
В природе азотная кислота в свободном состоянии не встречается, но в соединении с основаниями в виде солей (селитр) распространена, обыкновенно в малых количествах, почти повсюду. В воздухе следы ее содержатся в виде азотноаммиачной соли и образуются частью прямым соединением азота с кислородом в присутствии влаги и аммиака под влиянием электрических разрядов (особенно во время гроз) и разнообразных окислительных процессов, частью окислением самого аммиака. Поэтому она всегда почти находится в дождевой воде и др. атмосферных осадках. В воде озер, рек и источников, попадая в них частью из атмосферы, а главным образом из почвы, находится также в весьма малых дозах, не превышающих нескольких миллиграмм на литр.
Физические свойства:
бесцветная жидкость, =1,5г/см 3 , t°кип=86 С, t°зам= 41 С,
желтеет при хранении, взрывоопасна, дымит на воздухе.
С водой смешивается в любых отношениях. В отсутствии воды азотная кислота
неустойчива, разлагается на свету с выделением кислорода уже при обычных
температурах, причём выделяющейся двуокисью азота NO2 окрашивается в жёлтый цвет,
а при высоких концентрациях NO2 – в красный.
Смесь концентрированной азотной и соляной кислоты в отношении 1:3, называемая
Читайте также:


