История открытия алкенов кратко
Обновлено: 13.06.2024
> > This page is based on a Wikipedia article written by contributors (read/edit).
Text is available under the CC BY-SA 4.0 license; additional terms may apply.
Images, videos and audio are available under their respective licenses.
Tell your friends about Wikiwand!
- Введение
- Гомологический ряд и изомерия
- Электронное строение двойной связи
- История открытия
- Нахождение в природе и физиологическая роль алкенов
- Физические свойства
- Химические свойства
- Реакции электрофильного присоединения
- Реакции радикального присоединения
- Реакции присоединения карбенов
- Гидрирование (реакция Сабатье — Сандеран)
- Реакции радикального замещения
- Окисление
- Реакция карбонилирования
- Реакции полимеризации
- Метатезис алкенов
- Методы получения алкенов
- Дегидрирование алканов
- Дегидрогалогенирование и дегалогенирование алканов
- Дегидратация спиртов
- Гидрирование алкинов
- Реакция Виттига
- Реакция Кнёвенагеля
- Реакция Чугаева
- Реакция Гофмана
- Реакция Коупа
- Прочие методы синтеза
- Идентификация алкенов
- Химические методы идентификации алкенов
- Масс-спектрометрические методы анализа алкенов
- УФ-спектроскопические методы анализа алкенов
- ИК-спектроскопические методы анализа алкенов
- ЯМР-спектроскопические методы анализа алкенов
- Применение алкенов
- Промышленное использование этилена
- Промышленное использование пропилена
- Промышленное использование прочих алкенов
- См. также
- Дополнительные внешние источники
- Общие лекции по химии алкенов
- Учебная литература
- Механизмы реакций с участием алкенов
- Использование алкенов в промышленности
- Примечания
Suggest as cover photo
Would you like to suggest this photo as the cover photo for this article?
Thank you for helping!
Your input will affect cover photo selection, along with input from other users.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
А Л К Е Н Ы
Туганова Диана Владиславовна
Воронаев Иван Геннадьевич
Рисунок 1 - Структурная формула n-алкенов
Алкены - ненасыщенные ациклические углеводы, называемые также олефинами, имеющих общую формулу CnH2n, структурная формула представлена на рисунке 1. Алкены имеют один или более двойных связей между атомами углерода, поэтому называются ненасыщенными. Другое название - олефины.
Этилен, являющийся простейшим алкеном, плоский с валентными углами, близкими к 1200. Это соответствует sp2-гибридизации обоих атомов углерода. В рамках модели гибридных орбиталей связи С-Н образуются путем перекрывания sp2-гибридных АО углерода и 1S-орбиталей водорода. Связь С-Н в этилене (1,076Е , 108ккал/моль) короче и прочнее связи С-Н в этане (1,095Е , 98 ккал/моль), которая образована перекрыванием sp3-гибридной орбитали углерода и 1S-орбитали водорода. Это означает, что sp2-орбиталь более короткая и более электроотрицательная по сравнению с sp3-орбиталью атома углерода. -Связь двух атомов углерода в этилене образуется за счет перекрывания двух эквивалентных sp2-гибридных орбиталей каждого из атомов углерода, тогда как -связь возникает при перекрывании двух негибридизованных рz-орбиталей каждого из углеродных атомов. Эти орбитали параллельны, что обеспечивает их максимальное перекрывание. -Связь имеет плоскость симметрии, перпендикулярную плоскости всей молекулы этилена.
Суммарное распределение электронной плотности - и -связей между атомами углерода в этилене сильно отличается от того, которое можно представить на основании только -связи или только -связи. Вращение вокруг углерод-углеродной связи должно сопровождаться нарушением перекрывания рZ-орбиталей и, следовательно, энергетический барьер для такого вращения должен быть достаточно высок. Известны, например, два 1,2-дидейтероэтилена, резко различающихся по своим спектральным характеристикам и другим физическим свойствам.[1]
Впервые этилен был получен в 1669 немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт. Ученый установил, что его "воздух" более химически активный, чем метан, однако, идентифицировать полученный газ он не смог и названия ему не дал [2].
Во второй и тем же способом "воздух Бехера" был получен и описан голландские химики Дейман, Потс-ван-Трооствиком, Бондом и Лауверенбургом в 1795. Они назвали его "маслородным газом" так как при взаимодействии с хлором, он образовывал маслянистую жидкость - дихлорэтан (об этом стало известно позже). Французский химик Антуан Фуркруа ввел этот термин в практику, а когда были обнаружены другие углеводороды такого же типа, это название стало нарицательным для всего класса олефинов (или, по современной номенклатуре, алкенов) [3].
В начале XIX века французский химик Ж. Гей-Люссак обнаружил, что этанол состоит из "маслородного" газа и воды. Этот же газ он проявил и в хлористый этил [4] 1828 года Ж. Дюма и П. Булле предположили, что этилен представляет собой основу, способную давать соли подобно аммиака. Якоб Берцелиус принял эту идею, назвав состав "етерином" и обозначив буквой E [5].
Определив, что этилен состоит из водорода и углерода, долгое время химики не могли выписать его истинную формулу. В 1848 Кольбе писал формулу этилена как С 4 Н 4, этого же мнения придерживался и Либих. Ж. Дюма правильно определил состав вещества, но его структура и ранее была описана неверно: В2НН3 [6] .
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при повышенном давлении.

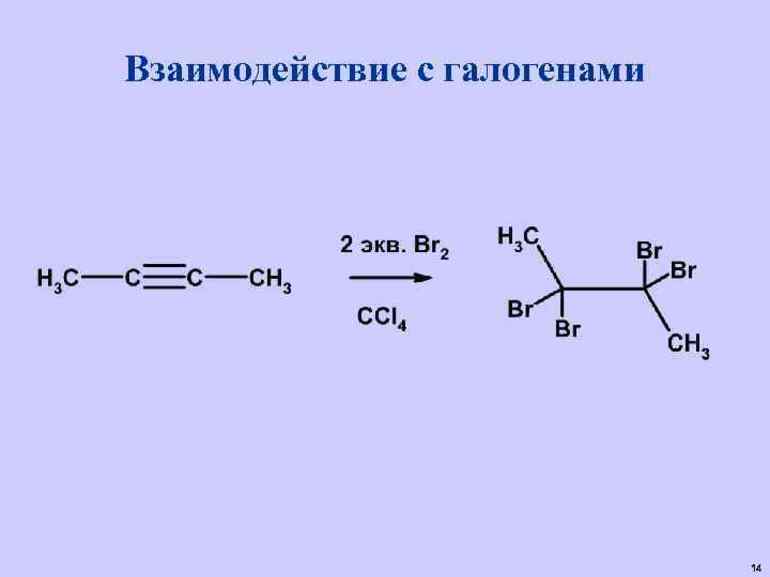
Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:
![]()

При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.


Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.
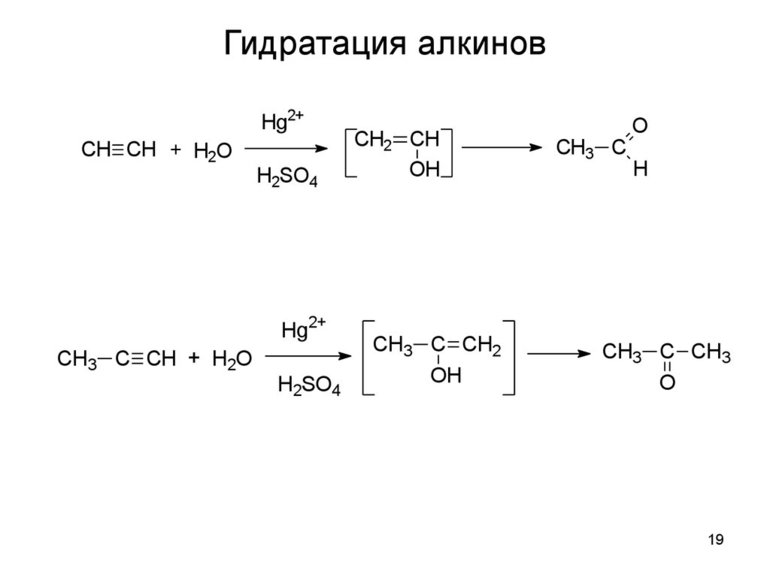
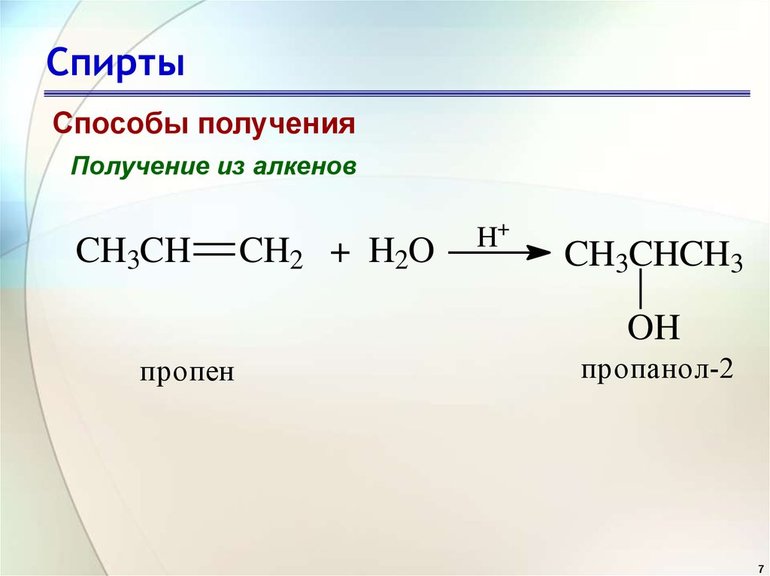
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
![]()

Присоединение воды к несимметричным алкенам идет по правилу Марковникова.

Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
А) Полное (избыток О2).
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду [7]:
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
Главные свойства алкенов:
1. Непредельные углеводороды активно вступают в реакции присоединения.
2. Реакционная активность алкенов связана с тем, что - связь под действием реагентов легко разрывается.
3. В результате присоединения происходит переход атомов углерода из sp2 – в sp3- гибридное состояние. Продукт реакции имеет предельный характер.
4. При нагревании этилена, пропилена и других алкенов под давление или в присутствии катализатора их отдельные молекулы соединяются в длинные цепочки – полимеры. Полимеры (полиэтилен, полипропилен) имеют большое практическое значение.
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.
Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука. [8]
Курц А.Л., Ливанцов М.В., Ливанцова Л.И. АЛКЕНЫ (Часть I). Методическая разработка для студентов III курса – М., 1998
Меншуткин Н. Очеркъ развития химическихъ воззри Ҍ ней. - С-Петербургъ: Тип. В.Демакова, 1888. - С. 252-264.
Фигуровский Н. А. История химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. - М.: Просвещение, 1979. - С. 102.
Меншуткин Н. Очеркъ развития химическихъ воззри Ҍ ней. - С-Петербургъ: Тип. В.Демакова, 1888. - С. 252-264.
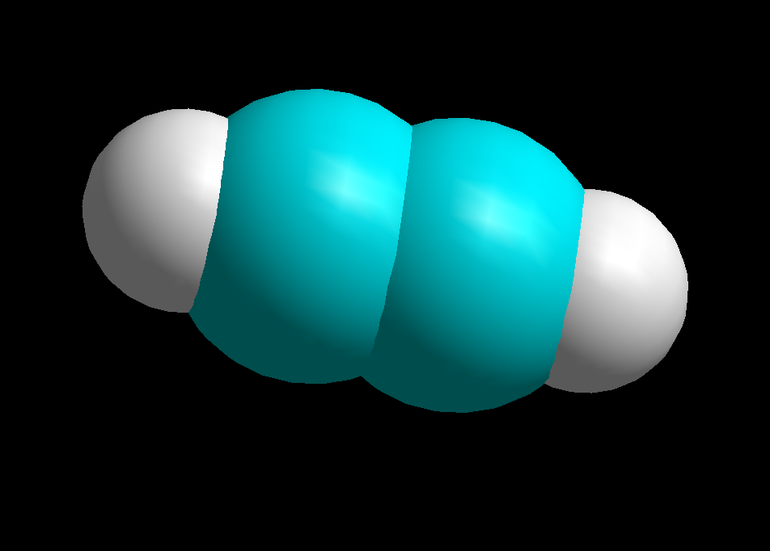
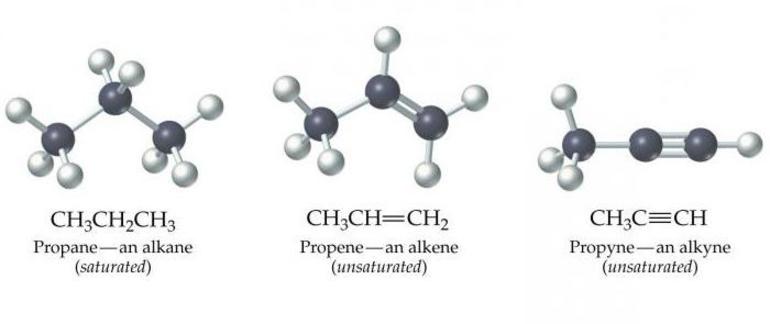
Химические соединения алкины — это ацетиленовые углеводороды, которые содержат тройную связь углеродных атомов. Они создают общий ряд и находятся в состоянии гибридизации sp. Вещества отличаются реакциями нуклеофильного присоединения, что обусловлено характером их связи. Атом водорода в их составе подвижен, поэтому в замещении алкины проявляют кислотные свойства.
История открытия
В 1836 году двоюродный брат химика-англичанина Гемфри Дэви — Эдмунд — получил первый ацетилен.
Для этого он нагрел древесный уголь вместе с уксуснокислым калием, добавил в раствор воду. В результате образовался карбид калия. Дэви назвал полученный газ двууглеродистым водородом.

Второй раз вещество получил немецкий врач Велер в 1862 году. Он воздействовал на карбид калия водой, в результате получил ацетилен. А через год французский химик Бертло провел ряд других опытов. Он пропустил водород над графитовыми электродами, которые предварительно раскалил электрической дугой. Назвал он образовавшийся газ ацетиленом. Это слово состоит из двух корней латинского и греческого языков, в переводе означает уксусное дерево. А в русском языке название появилось благодаря Дмитрию Менделееву.
В конце девятнадцатого века изучением непредельных углеводородов занялся Фаворский, а в 1895 году Ле Шателье обнаружил одно интересное свойство, которым они обладают. Ацетилен во время сгорания в кислороде дает горячее пламя, благодаря чему его впоследствии начали использовать в сварке и резке металлов. Согласно номенклатуре, названия веществ образуются как производные от алканов путем замены суффикса.
Простейший непредельный углеводород — это этин, он превращается в этан. Гомологический ряд алкинов включает:

- децин — С10Н18;
- нонин — С9Н16;
- октин — С8Н14;
- гептин — С7Н12;
- гексин — С6Н10;
- пентин — С5Н8;
- бутин — С4Н6;
- пропин — С3Н4;
- ацетилен — С2Н2.
У всего структурного ряда алкинов формула общая — С (n) Н (2 n — n).
Физические свойства
У алкинов есть определенные физические свойства. Они могут находиться в нескольких агрегатных состояниях:
- от С2 до С4 — газы;
- С5-С16 — жидкости;
- свыше С17 — твердые углеводороды.
Вещества закипают при температуре, которая гораздо выше той, что необходима для нагрева других производных. Растворимость в воде очень мала, хотя и больше, чем у алканов и алкенов. Но алкины легко расщепляются на атомы в неполярных органических жидкостях.
Есть несколько способов получения углеводорода, их разделяют на промышленные и лабораторные. В условиях производства используют карбидный метод, пиролиз или крекинг.
При первом нужно в электрической печи прокалить смесь кокс с оксидом кальция, постоянно поддерживая температуру 1800−2000 градусов. В результате получится карбид кальция, который вступает во взаимодействие с водой, образуя ацетилен и гидроксид.
Можно получить алкины, пропуская природный газ с кислородом через огнеупорную насадку. Он сгорает, повышает температуру воздуха и приводит к пиролизу метана. Крекинг делится на два метода — электрический и термоокислительный. При первом метан пропускают через два металлических электрода с высокой скоростью при температуре в 1500 градусов. А во время второго способа газ сгорает, окисляясь при этом.
В лабораторных условиях ацетилен добывают с помощью прямого синтеза. Это исторический метод, который применял еще Бертло в 1863 году. Он нагревал водород с углеродом при большой температуре. Кекуле в 1864 получал вещество с помощью электролиза малеата натрия и фумарата. А также можно поддать его реакции дегидрогалогенирования, а в качестве агента-галогеналкана лучше использовать аммиачный амид натрия. В лабораториях ученые алкилируют ацетилен, а также используются группировки Кучерова, Кори-Фукса, Фрича-Буттенберга-Вихелля.
Химические особенности
Алкины вступают в реакции с другими веществами лучше, чем алкены и алканы. Терминальные соединения, у которых тройная связь расположена в конце цепи, подвергаются замещениям. Водород с атомами углерода, гибридизированными в sp, могут проходить протонизацию, благодаря чему они и получают кислую природу.
Основным химические свойства алкинов:
- гидрирование;
- галогенирование;
- гидратация;
- присоединение меркаптанов, хлоридов, кислот и спирта;
- полимеризация;
- окисление.
При гидрировании активные катализаторы никель или платина восстанавливают алкины до состояния алканов, а процесс с гомологами ацетилена дает цис-олефины. Галогенирование происходит в два этапа, водород вступает в реакцию с хлором. Во время гидрогалогенирования на первом шаге образуется хлористый винилацетилен, на втором — дихлорэтан. Уравнение составляется по правилу Марковникова.
Гидратация образует ацетальдегид и кетоны из его гомологов, процесс протекает по реакции Кучерова. Спирты и меркаптаны присоединяются к водороду под воздействием едкого калия и монозамещенных ацетиленов. Для уксусной кислоты потребуется гетерогенный катализ, полученный винилацетат полимеризируется. К нему присоединяется синильное вещество, что образует акрилонитрил.
Для димеризации необходимы соли Купрума, затем происходит взаимодействия с соляной кислотой. Так получают хлоропреновый каучук, изобутилен, катализатором выступает никель с хлоридом цинка. Тримеризация требует активный уголь и температуры в 600 градусов, в результате образуется бензол.
На тетрамеризацию влияют комплексные соли никеля, а для окисления нужно использовать раствор пергаманата калия и карбоновые кислоты. Качественный раствор становится розовым, но через несколько минут обесцвечивается. При соблюдении мягких условий окисления связи не разрываются. Продуктом реакции становится щавелевая кислота, но в нейтральной среде процесс можно остановить на стадии появления дикетонов. Если алкины горят, то они окисляются полностью до воды и углекислого газа. В результате экзотермической реакции выделяется много тепла.
Взаимодействия с веществами
Изомеры вступают в реакцию с другими веществами. Они взаимодействуют с разными солями и щелочами:
-
;
- кетонами;
- солями тяжелых металлов;
- щелочноземельными реактивами;
- металлическим натрием.
Качественная реакция с солями тяжелых металлов приводит к появлению нерастворимых осадков ацетиленидов. Монозамещенные гомологи взаимодействуют при этом с оксидами полухлористой меди и серебра. Первое вещество белое или бесцветное, второе — красно- или желто-бурое. Ацетилениды могут взрываться, под действием кислот происходит их разложение на металлические соли и ацетилен.
Гомологи вступают в реакцию со щелочными металлами, которые берут из жидкого аммиака. Производные натрия действуют по правилам реактива Иоцича или Ревьяра, поэтому их часто используют в органическом синтезе. Под небольшим давлением вещество взаимодействует с едким калием и кетонами, такую реакцию изучал Фаворский.
Ацетилинед меди также реагирует с гомологами и дает в результате бутиндиол. Перегруппировка Фаворского происходит только во время нагревания ацетиленов с натрием, тройная связь из центра цепи переместится в конец.
А если она изначально занимает это положение, то во время реакции со спиртовым щелочным раствором перейдет в середину молекулы.
Применение углеводородов
Из всех непредельных углеводородов ацетилен имеет наибольшее применение. Он используется как один из главных видов химического сырья. Вещество применяют для синтеза нескольких видов продуктов:

- растворителей;
- пластификаторов;
- каучуков;
- полимеров.
При хлорировании ацетилена получаются дихлорэтилен, тетрахлорэтан и трихлорэтилен, которые используют в качестве сильных растворителей. Акрилонитрил добывают при изомерии вещества с циановодородом, так образуется полиакрилонитрил. Полиакриламид можно получить в результате конденсации ацетилена с аммиаком и углекислым газом. Сырье для уретановых полимеров делают из тетрагидрофурана.
Поливинилхлорид получается в результате гидрохлорирования вещества, а уксусная кислота превращает его в характерный поливинилацетат. Класс альдегидов образуется при гидратации ацетилена, что дает возможность изготовить ацетон, уксусную кислоту и другую продукцию. Синтез полимеров осуществляется с помощью винилацетилена — результата димеризации вещества. Каучуки содержат хлоропрен и бутадиен.
Ацетилен во время горения выделяет тепло, его используют для сварки и резки тугоплавких металлов. В начале прошлого века применялись светильники, сырьем для которых служил карбид кальция — дешевое вещество. Их можно было увидеть на вечерних улицах, в домах, на водном и железнодорожном транспорте. Сегодня их используют туристы как походное снаряжение, хотя изготовляют в небольших количествах.

Ациклические непредельные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейший алкен – этилен (C2H4), образующий гомологический ряд.
Описание
Алкены – класс веществ органической химии. Второе название класса – олефины. Общая формула алкенов – CnH2n.
Алкены обязательно содержат одну двойную связь, которая может располагаться в любом месте молекулы. Атомы, связанные двойной связью, находятся в состоянии sp 2 -гибридизации, т.е. в соединении атомов участвуют одна s- и две р-орбитали. При этом одна р-орбиталь остаётся свободной.
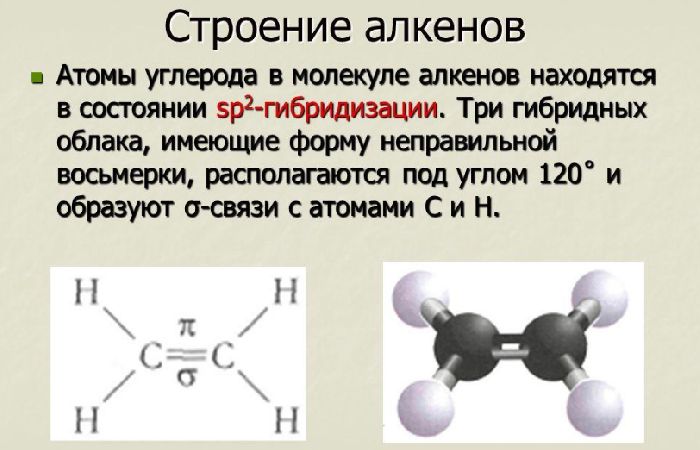
Рис. 1. Строение алкенов.
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Номенклатура
Название
Формула
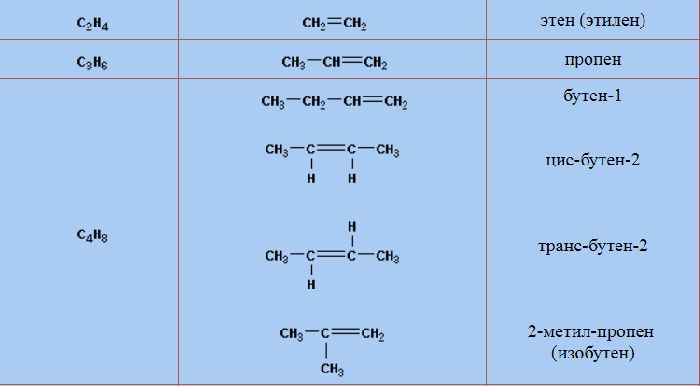
Рис. 2. Примеры записи структурных формул алкенов.
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Получение
Алкены в отличие от алканов практически не встречаются в природе. Небольшое количество этилена содержат растения. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют промышленным и лабораторным путём. В промышленности применяется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
- дегидратация спиртов в присутствии сильных кислот;
- дегидрогалогенирование – отщепление галогенводорода при нагревании;
- дегалогенирование дигалогеналканов – отщепление галогенов в присутствии цинка;
- синтез Гофмана – разложение аммониевых оснований;
- реакция Чугаева – взаимодействие спиртов с сероуглеродом и гидроксидом натрия;
- метод Виттига – взаимодействие карбонильных соединений и алкилиденфосфоранов;
- метод Коупа – разложение N-окисей третичных аминов.
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Химические свойства
Алкены – активные вещества. Они реагируют:
Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Что мы узнали?
Читайте также:

