Индуктивный эффект это кратко
Обновлено: 05.07.2024
Индукти́вный эффе́кт (полярный эффект) — смещение электронной плотности химической связи по σ-связям. Является разновидностью эффекта поля.
Понятие об индуктивном эффекте было введено К. Ингольдом [1] , им же были введены обозначения:
- +I-эффект в случае повышения заместителем электронной плотности;
- –I-эффект в случае понижения заместителем электронной плотности
В качестве вещества сравнения берут незамещённое соединение, то есть нулевой индуктивный эффект принимается для атома водорода.
Характерной особенностью индуктивного эффекта по сравнению с мезомерным эффектом является его быстрое затухание по цепочке связей.
Среди наиболее характерных +I-групп можно выделить: алкильные группы, металлы, металлоидные группы (силильные, борные, фосфорные и пр.); среди наиболее характерных групп с –I-эффектом выделяются заряженные группы (из-за эффекта поля), такие как триалкиламмониевые, диалкилсульфониевые и прочие ониевые соли, нитрогруппа, гидроксигруппа, алкоксигруппа, аминогруппа, галогены и т. п.
Фактически эффект обусловлен в первую очередь атомом, с которым непосредственно связан исходный атом углерода и определяется, таким образом, разницей электроотрицательностей атомов.
Количественная оценка индуктивного эффекта может быть произведена при помощи уравнения Тафта [2] .
Примечания
- Химическая связь
- Физическая органическая химия
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Индуктивный эффект" в других словарях:
индуктивный эффект — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN effect of inductivity … Справочник технического переводчика
ИНДУКТИВНЫЙ ЭФФЕКТ — (индукционный эффект) (позднелат. inductivus, от лат. inductio наведение, побуждение), вид взаимного влияния атомов в молекулах, заключается в электростатич. воздействии зарядов на атомах или электрич. диполей связей на реакц. центр или к. л.… … Химическая энциклопедия
ЦИТОПАТИЧЕСКИЙ ЭФФЕКТ — цитопатогенное действие вируса, специфич. морфологич. деструкция (разрушение) и функциональная патология заражённых вирусами клеток, культивируемых вне организма. Вирус, вызывающий Ц. э., наз. цитопатогенным. Различают 3 типа Ц. э. вирусов:… … Ветеринарный энциклопедический словарь
Спирты — Отличительная особенность спиртов гидроксильная группа при насыщенном атоме углерода на рисунке выделена красным (кислород) и серым цветом (водород). Спирты (от лат. … Википедия
ЭЛЕКТРОФИЛЬНЫЕ РЕАКЦИИ — гетеролитич. р ции орг. соед. с электроф. реагентами (электрофилами, от греч. elektron электрон и phileo люблю). К электрофилам относят ионы и молекулы, к рые имеют достаточно низкую по энергии вакантную орбиталь (льюисовские к ты) Н +, D+, Li+,… … Химическая энциклопедия
Уравнение Тафта — График зависимости константы скорости реакции от свойств вещества в координатах уравнения Тафта (окисление органических сульфидов диоксидом хлора Р. Тафтом был предложен ряд уравнений для количественного описания влияния соседних заместителей на… … Википедия
Иванов, Владимир Иванович — (14.IV.1904 2.VIII.1987) Сов. химик, акад. АН КиргССР (с 1960). Р. в пос. Сюгинского стекольного з да (ныне Удмуртской АССР). Окончил Московское высшее техн. училище. До 1936 работал в Военной акад. хим. защиты, одновременно в 1930 1939 в Ин те… … Большая биографическая энциклопедия
МАТЕРИЯ — одно из наиболее многозначных филос. понятий, которому придается один (или некоторые) из следующих смыслов: 1) то, определяющими характеристиками чего являются протяженность, место в пространстве, масса, вес, движение, инерция, сопротивление,… … Философская энциклопедия
ОКСИКИСЛОТЫ — (гидроксикарбоновые к ты, гидроксикис лоты), содержат в молекуле карбоксильную и гидроксиль ную группы. В статье рассмотрены алифатические О. (см. также Оксибензойные кислоты и Оксинафтойные кислоты). В зависимости от взаимного расположения групп … Химическая энциклопедия
Функциональная группа — Бензил ацетат имеет эфирную функциональную группу (показанно красным), ацетильную группу (зелёная) и бензильную группу (оранжевая). Функциональная группа структурный фрагмент органическо … Википедия
В одной из предыдущих серий , посвящённых базисной теории органической химии - Теории строения органических соединений А.М. Бутлерова, мы упомянули, что одним из основных её постулатов является мысль, согласно которой атомы и группы атомов в молекуле оказывают друг на друга особенное влияние. В чём же выражается это влияние? В перераспределении электронной плотности!
В этой части мы поговорим о, так называемых, электронных эффектах, вызывающих перераспределения электронной плотности в молекуле, что проистекает из взаимного влияния атомов и групп атомов в молекуле друг на друга.
Индуктивный эффект (+I , -I)
Индуктивный эффект - эффект смещения электронной плотности (обобществлённой электронной пары) вдоль σ(сигма)-связи . (Подробнее о σ- и π(пи)- связях здесь .)
Чтобы лучше понять вкладываемый в данное определение смысл необходимо владеть базовыми сведениями относительно природы так называемой ковалентной химической связи (об этом тут ).
Индуктивный эффект, оказываемый атомом или группой атомов в молекуле, может быть положительным +I или отрицательным -I , в зависимости от электроотрицательности атомов (так как органическая химия - химия соединений углерода, то и сравнение электроотрицательности будет происходить с атомом углерода) (подробнее об электроотрицательности здесь ).
Положительным индуктивным эффектом ( +I )
обладают электронодонорные (отталкивающие электронную плотность) атомы или группы атомов. В соответствии с электроотрицательностью - это атомы элементов, находящиеся в периодической системе левее атома углерода, а так же алкильные заместители.
Таким образом указанные выше атомы или группы атомов подают электронную плотность на атом углерода, то есть смещают обобществлённую электронную пару в его сторону. В пределах химических формул направление индуктивного эффекта обозначают прямой стрелкой .
Так как обобществлённая электронная пара в случае +I смещается в сторону атома углерода, то именно на этом атоме углерода концентрируется электронная плотность, и он приобретает частичный повышенный отрицательный заряд δ- (электроны несут отрицательный заряд).
Отрицательным индуктивным эффектом ( -I)
обладают электроноакцепторные атомы или группы атомов. Чем правее и выше в периодической системе находится химический элемент, тем больший -I он будет проявлять.
Таким образом, указанные выше группы оттягивают электронную плотность от атома углерода вдоль σ-связи , что при отсутствии других электронных эффектов приводит к формированию на нём частичного положительного заряда δ+ .
Особенностью индуктивного эффекта является то, что он сильнее всего проявляется на атоме углерода, непосредственно связанном с соответствующим заместителем, и затухает с ростом расстояния от него, что объясняется малой подвижностью σ-связи (об этом было здесь ).
И самое главное!
Индуктивный эффект вызывает статическую поляризацию молекулы и появление дипольного момента. Наличие диполя в молекуле с полярной ковалентной связью является причиной многих гетеролитических реакций .
Почувствовать вклад индуктивного эффекта в реакционную способность органических молекул мы сможем чуть позднее.
В следующей же части мы поговорим о мезомерном эффекте . Спасибо. Пока.
Индуктивный (индукционный) эффект (I) – это смещение электронной плотности вдоль σ–связи от одного атома к другому вследствие их разной электроотрицательности. При этом происходит поляризация связи.
Наличие в молекуле полярной σ–связи вызывает поляризацию ближайших двух-трех σ–связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта минус) на соседних атомах.
Направление смещения электронной плотности всех σ-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов.
Из-за слабой поляризуемости σ-связей I-эффект быстро затухает с удалением от заместителя и через 3-4 связи становится практически равным нулю.

Атомы и группы атомов, электроотрицательность которых больше электроотрицательности атома углерода, в связах с ним оттягивают на себя электроны связи и обладают отрицательным индуктивным эффектом –I (электроноакцепторы). При этом заместитель приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+).
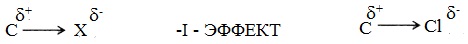
Атомы и группы атомов с меньшей электротрицательностью отталкивают от себя электроны в связях с углеродом и обладают положительным индуктивным эффектом +I (электронодоноры). При этом заместитель приобретает частичный положительный заряд (δ+), а атом углерода частичный отрицательный заряд (δ-).
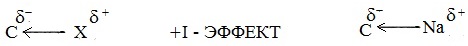
Заместители, вызывающие отрицательный индуктивный эффект:
Заместители, вызывающие положительный индуктивный эффект:
Рубрики: Электронные эффекты Теги: Электронные эффекты
Охарактеризуйте взаимное влияние заместителей и ароматического кольца в молекулах толуола , анилина , п — гидроксибензолсулыр ° кислоты , коричной кислоты(C6H5-CH=CH-COOH)
Индуктивным эффектом называется смещение электронной плотности химической связи вдоль $\sigma $-связей. Это явление характерно для органических соединений. Возникновение смещения электронной плотности в молекуле органического соединения обусловлено наличием дипольного момента у этой молекулы, т.е. присутствием в ее составе заместителей, электроотрицательность которых отличается от электроотрицательности атома углерода. Различают положительный $+I$- эффект и отрицательный $-I$-эффект. В первом случае электронная плотность смещается в сторону заместителя, во втором - от него (рис. 1). Характерной особенностью индуктивного эффекта является его быстрое затухание по мере удаления от заместителя.

Рисунок 1. Знак индуктивного эффекта
Дипольный момент молекулы может рассматриваться с двух точек зрения:
общий дипольный момент как векторная сумма диполей отдельных связей;
молекула как система нескольких фрагментов, поляризующихся в поле, создаваемом диполем полярной группы.
Первый подход удобен при оценке наличия дипольного момента у симметричных молекул и их несимметричных изомеров (рис. 2).

Рисунок 2. Дипольный момент изомеровдихлорбензола
Однако рассчитанные таким образом значения дипольных моментов могут существенно отличаться от экспериментально определенных, что связано с внутримолекулярным взаимодействием полярных групп, которое выражается в увеличении дипольного момента с увеличением размеров алкильной группы.
Индуктивный эффект
Готовые работы на аналогичную тему
В основе теории Льюиса лежит предположение, что электроны в молекуле смещаются не поодиночке, а парами. Рассмотрим молекулу н-пропилхлорида (рис. 3). Из-за большого заряда ядра атома хлора электронная пара $\sigma $-связи $C-Cl$ смещена к атому хлора. Таким образом, атом хлора несет частичный отрицательный заряд, а атом углерода, непосредственно соединенный с атомом хлора, - частичный положительный заряд. Этот же атом углерода притягивает электронные пары соседнего атома углерода, не связанного с атомом хлора. Таким образом, атом хлора вызывает последовательное смещение электронных пар $\sigma $-связей по всей молекуле. На рис. 3 это явление схематично изображено стрелками.

Рисунок 3. $H$-пропилхлорид
Такая способность электроотрицательного заместителя воздействовать на $\sigma $-электронные пары вдоль цепочки атомов углерода в органических молекулах и называется индуктивным эффектом. Следствием этого явления является возрастание дипольного момента органических молекул одного гомологического ряда по мере роста длины углеводородной цепи:

Представление об индуктивном эффекте объясняет, почему происходит изменение констант скоростей и равновесий при введении в молекулу какого-либо полярного заместителя.
Эффект поля
При рассмотрении эффекта поля учитывается пространственное строение органической молекулы и диэлектрическая проницаемости среды, в которой эта молекула находится. В данном случае взаимное влияние частичных электрических зарядов функциональных групп молекулы передается по кратчайшему расстоянию между ними. Рассмотрим это явление на примере молекулы 2-хлорэтиламина (рис. 5). Атом хлора создает частичный положительный заряд на связанном с ним атоме углерода. В результате неподеленная электронная пара атома азота в соответствии с законом Кулона смещается в сторону этого атома углерода, что, в свою очередь, снижает основность аминогруппы.

Рисунок 5. 2-хлорэтиламин
Читайте также:

