Химия за 8 9 класс кратко
Обновлено: 05.07.2024
01.Предмет химии
02.Практическое занятие 1. Правила безопасной работы в химической лаборатории. Работа с лабораторными принадлежностями и хи
03.Построение модели невидимого объекта. Возникновение в науке теоретических представлений о веществе и химической реакции
04.Чистые вещества и смеси
05.Методы разделения и очистки веществ
06.Практическое занятие 2. Разделение смесей веществ
07.Характеристика химических реакций
08.Практическое занятие 3. Химические реакции
09.Сущность химической реакции. Закон сохранения массы веществ
10.Развитие в науке представлений о простом и сложном веществе. Химические элементы. Символы химических элементов
11.Химические элементы. Символы химических элементов
12.Массовая доля химического элемента в веществе
13.Постоянство состава вещества
14.Относительная атомная масса химических элементов
15.Закон Авогадро. Состав молекул
16.Относительная молярная и молекулярная массы вещества. Молярный объем вещества
17.Химическая формула вещества
18.Расчёт массовой доли химических элементов по формуле вещества
19.Валентность химических элементов
20.Составление формул веществ по валентности элементов
21.Названия химических веществ
22.Уравнение химической реакции. Ч.1
23.Уравнение химической реакции. Ч.2
24.Повторение и обобщение темы Первоначальные химические представления
25.Решение расчётных задач по уравнению реакции
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Справочник для подготовки к ОГЭ по химии
Строение атома. Строение электронных оболочек атомов первых 20 элементов периодической системы Д.И. Менделеева
-Порядковый номер элемента численно равен заряду ядра его атома, числу протонов в ядре N и общему числу электронов в атоме.
-Число электронов на последнем (внешнем) слое определяется по номеру группы химического элемента.
-Число электронных слоев в атоме равно номеру периода.
-Массовое число атома A (равно относительной атомной массе, округленной до целого числа) - это суммарное количество протонов и нейтронов.
-Количество нейтронов N определяют по разности массового числа А и числа протонов Z .
-Изотопы – атомы одного химического элемента, имеющие в ядре одинаковое число протонов, но разное число нейтронов, т.е. одинаковый заряд ядра, но разную атомную массу.
Периодический закон и периодическая система химических элементов Д.И. Менделеева
(слева направо → )
(сверху вниз↓)
Число электронных слоев
Число валентных электронов
Основные свойства оксидов и гидроксидов
Кислотные свойства оксидов и гидроксидов
Строение молекул.
Химическая связь:
ковалентная (полярная и неполярная), ионная, металлическая
Ковалентная неполярная связь образуется между одинаковыми атомами неметаллов (то есть, с одинаковым значением электроотрицательности): O 2; H 2 ; Cl 2
Ковалентная полярная связь образуется между атомами разных неметаллов (с разным значением электроотрицательности): HCl ; H 2 S ; H 2 O
Ионная связь образуется между атомами типичных металлов и неметаллов и в солях аммония! ( CuCl 2 ; NH 4 Cl , NH 4 NO 3 и т.д.)
Металлическая связь - в металлах и сплавах: Ag ; Cu ; Fe ; Na
Длина связи определяется:
-радиусом атомов элементов: чем больше радиусы атомов, тем больше длина связи;
-кратностью связи (одинарная длиннее, чем двойная)
Валентность химических элементов. Степень окисления химических элементов
Степень окисления – показывает, сколько электронов атом отдал или принял.
-Элемент принимает электроны, приобретает отрицательный заряд- это окислитель
-Элемент отдает электроны, приобретает положительный заряд- это восстановитель
Валентностью называют число химических связей, которые образует атом в химическом соединении. Часто значение валентности совпадает численно со значением степени окисления.
Простые вещества 0
Ст. ок. азота в аммиаке (NH 3 ) и в ионе аммония ( NH 4 +1 ) всегда –3.
ЗАПОМНИТЬ: степени окисления постоянные:1) Al +3 ; F - ; H + ; O -2 ;
2)металлы 1 группы гл. подгруппы +1; 3) металлы 2 группы гл. подгруппы +2
При составлении формул использовать степени окисления из таблицы растворимости.
Простые и сложные вещества. Основные классы
неорганических веществ. Номенклатура неорганических соединений
Сложные вещества – вещества, в состав которых входят атомы различных химических элементов.
Кислоты — сложные вещества , в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток: HCl , H 3 Р O 4
Основания – сложные вещества, в состав которых входят ионы металла и гидроксид-ионы ОН - : NaOH , Ca ( OH ) 2
Соли средние – сложные вещества, состоящие из катионов металла и анионов кислотных остатков ( CaCO 3 ) . В составе кислых солей есть еще атомы водорода ( Ca ( HCO 3 ) 2 ) . В составе основных солей – гидроксид-ионы (( CuOH ) 2 CO 3 ) .
Оксиды – сложные вещества, в состав которых входят атомы двух элементов, один из которых обязательно кислород в степени окисления (-2). Оксиды классифицируются на основные, кислотные, амфотерные и несолеобразующие.
-металлы со степенями окисления +1 и +2
( Na 2 O; MgO; CrO; MnO )
металлы со степенями окисления +3 ( Al 2 O 3 ; Cr 2 O 3 )
+2, +4 ( ZnO; BeO; MnO 2 )
-неметаллы (SO 2 ; CO 2 ; P 2 O 5 )
ЗАПОМНИТЬ. оксиды CO , NO , N 2 O – являются несолеобразующими, т.е. им не соответствуют кислоты
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Химические реакции – явления, при которых из одних веществ образуются другие вещества.
Признаки протекания химической реакции – выделение света и тепла, образование осадка, газа, появление запаха, изменение цвета.
Сохранение массы веществ при химических реакциях.
Сумма коэффициентов в уравнении реакции: Fe +2 HCl → FeCl 2 (1+2+1=4)
Классификация химических реакций
По числу и составу исходных и полученных веществ различают реакции:
Соединения А+В = АВ
Разложения АВ = А+ В
Замещения А + ВС = АС + В
Обмена АВ + С D = AD + CB
Реакции обмена между кислотами и основаниями – реакции нейтрализации.
По изменению степеней окисления химических элементов:
Окислительно-восстановительные реакции (ОВР), в процессе которых происходит изменение степеней окисления химических элементов.
! Если в реакции участвует простое вещество – это всегда ОВР
! Реакции замещения – это всегда ОВР.
Не являются ОВР такие реакции, в процессе которых не происходит изменения степеней окисления химических элементов. !Реакции обмена всегда не ОВР.
По поглощению и выделению энергии:
-экзотермические реакции идут с выделением тепла (это все реакции горения, обмена, замещения, большинство реакций соединения);
-эндотермические реакции идут с поглощением тепла (реакции разложения)
По направлению процесса : обратимые и необратимые.
По наличию катализатора : каталитические и некаталитические.
Электролиты и неэлектролиты. Катионы и анионы.
Электролитическая диссоциация кислот, щелочей и солей (средних)
Электролиты – вещества, которые в водных растворах и расплавах распадаются на ионы, вследствие чего их водные растворы или расплавы проводят электрический ток.
Кислоты – электролиты, при диссоциации которых в водных растворах в качестве катионов образуется только катионы Н +
Основания – электролиты, при диссоциации которых в качестве анионов образуется только гидроксид-анионы ОН -
Соли средние - электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка.
Катионы имеют положительный заряд; анионы – отрицательный
Реакции ионного обмена и условия их осуществления
Реакции ионного обмена идут до конца, если образуется осадок, газ или вода ( или другое малодиссоциирующее вещество)
В ионных уравнениях в неизменном виде надо оставлять формулы неэлектролитов, нерастворимых веществ, слабых электролитов, газов.
Правила составления ионных уравнений:
-составить молекулярное уравнение реакции;
-проверить возможность протекания реакции; уравнять
-отметить вещества (подчеркнуть), которые не будут распадаться на ионы ( простые вещества, оксиды, газы, нерастворимые вещества, слабые электролиты);
-записать полное ионное уравнение реакции;
-вычеркнуть из левой и правой части одинаковые ионы;
-переписать сокращённое ионное уравнение.
Слабые электролиты: H 2 S , H 3 PO 4 , HNO 2 , HF . (ЗАПОМНИТЬ!)
ЗАПОМНИТЬ! Нестойкие вещества (разлагаются):
H 2 CO 3 =CO 2 ↑ + H 2 O; H 2 SO 3 =SO 2 ↑ + H 2 O NH 4 OH= NH 3 + H 2 O
Химические свойства простых веществ: металлов и неметаллов
Химические свойства простых веществ: металлов и неметаллов
С кислотами взаимодействуют только металлы, которые находятся в ряду активности левее водорода. Т.е. неактивные металлы Cu , Hg , Ag , Au , Pt с кислотами не реагируют.
Но: неактивные металлы ( Cu , Hg , Ag ) реагируют с HNO 3 конц, разбавл. , H 2 SO 4конц. без выделения Н 2
Ме ( Cu , Hg , Ag ) +
→ Ме NO 3 + NO 2 + H 2 O
HNO 3 разбавл.
→ Ме NO 3 + NO + H 2 O
H 2 SO 4конц.
→ Ме SO 4 + SO 2 + H 2 O
. HNO 3 конц, , H 2 SO 4конц. пассивируют Fe , Al , С r (при н.у.))
Окислительные свойства галогенов усиливаются по группе снизу вверх.
Неметаллы реагируют с металлами и между собой:
1) реагируют со щелочами: Cl 2 + 2 NaOH → NaCl + NaClO + H 2 O (в холодном растворе)
3 Cl 2 + 6 NaOH → NaCl + 5 NaClO 3 + H 2 O (в горячем растворе)
2)более активный галоген (вышестоящий в группе, кроме фтора, так как он реагирует с водой) вытесняет менее активные галогены из их галогенидов: Cl 2 + 2 KBr → Br 2 + 2 KCl , но Br 2 + KCl ≠
3) 2 F 2 + O 2 → 2 O +2 F 2 (фторид кислорода)
4) Запомнить: 2 Fe + 3 Cl 2 → 2 Fe +3 Cl 3 и Fe + 2 HCl → Fe +2 Cl 2 + H 2
Свойства металлов
Cu , Hg , Ag , Au , Pt
1.+ Н 2 О ( t 0 ) → MeO + H 2
2.+ неметаллы (кроме N 2 )
4. + соль (раств.), если Ме более акт., чем в соли
5. Ме 1 +Ме 2 О (если Ме 1 =М g , Al )
1. (только Cu , Hg )
2. (только Cu , Hg ) + Cl 2 (при t 0 )
3. + соль (раств.), если Ме более акт., чем в соли
4.+ HNO 3 (конц. или разб)
Запомнить: в пункте 4 и 5 Н 2 не выделяется.
Химические свойства оксидов: основных, амфотерных, кислотных
Химические свойства оксидов
Обозначим активные металлы ( Me *): Li , Na , K , Rb , Cs , Fr , Ca , Sr , Ba , Ra .
Металлы, образующие амфотерные соединения, обозначим Ме А ( Zn , Be , Al )
2. + кислоты (Н CI и др.)
1. + кислоты (Н CI и др.)
1.+ кислоты (Н CI и др.)
4. ЭО нелетуч + Соль → ЭО летуч. ↑+ соль
Некоторые особенности: 2 Mg + SiO 2 → Si + 2 MgO
Химические свойства кислот, оснований
Химические свойства КИСЛОТ:
-Взаимодействуют с основными и амфотерными оксидами с образованием соли и воды:
-Взаимодействуют с основаниями и амфотерными гидроксидами с образованием соли и воды (реакция нейтрализации): NaOH + HCl(разб.) = NaCl + H 2 O Zn ( OH ) 2 + H 2 SO 4 = ZnSO 4 +2 H 2 O
-Взаимодействуют с солями
а) если выпадает осадок или выделяется газ: BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2 HCl
б) сильные кислоты вытесняют более слабые из их солей (если в реакционной системе мало воды):
-С металлами:
А) металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты HNO 3 любой концентрации и концентрированной серной кислоты H 2 SO 4 )
Б) с азотной кислотой и концентрированной серной кислотами реакция идёт иначе (см. свойства металлов)
Химические свойства солей
Химические свойства СОЛЕЙ :
Соль раств. + Соль раств. → если образуется ↓
Соль раств. + основание раств. → если образуется ↓или ↑( NH 3 )
Соль . + кислота . → если образуется ↓или ↑
Соль раств. + Ме → если Ме более активен, чем в соли, но не щелочной металл (М*)
Карбонаты, сульфиты образуют кислые соли
6. Некоторые соли разлагаются при нагревании:
- Карбонаты, сульфиты и силикаты(кроме щелочных металлов): CuCO 3 =CuO+CO 2 ↑
- Нитраты (разных металлов разлагаются по-разному) :
активных : Na , K , Rb , Cs , Fr , Ca , Sr , Ba , Ra и Mg
исключение: LiNO 3
Li , металлов средней акт., и Cu
металлов неактивных, после Cu
ИСКЛЮЧЕНИЕ (ЗАПОМНИТЬ!):
Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ.
Чистые вещества и смеси
Чистое вещество имеет определенный постоянный состав или структуру (соль, сахар).
Смеси - это физические сочетания чистых веществ.
Смеси могут быть однородными ( нельзя обнаружить частицы веществ) и неоднородными.
Разделить смеси можно, используя их физические свойства:
-Железо, сталь притягиваются магнитом, остальные вещества – нет
-Песок и др. нерастворим в воде
-Измельченная сера, опилки всплывают на поверхность воды
-Несмешивающиеся жидкости (масло+ вода) можно разделить с помощью делительной воронки
Некоторые правила безопасной работы в лаборатории:
-Работать с едкими веществами надо в перчатках
-Получение таких газов, как SO 2 , Cl 2 , NO 2 , надо проводить только под тягой
-Нельзя нагревать легковоспламеняющиеся вещества на открытом огне
-При нагревании жидкости в пробирке, надо сначала прогреть всю пробирку и держать ее под углом 30-45 0
Определение характера среды раствора кислот и щелочей с
помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-ионы, ион аммония). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак)
Получение газов
Уравнение реакции получения
Как распознать
Как собирать
Н 2 О(+) пробирка вниз дном
Мутнеет известковая вода
Водород сгорает с хлопком
Н 2 О(+) пробирка вверх дном
Синеет влажная лакмусовая бумажка
Примечание: Н 2 О(+) можно данный газ собирать методом вытеснения воды ( т.к. эти газы не растворяются в воде)
Н 2 О(-) нельзя собирать методом вытеснения воды (т.к эти газы растворяются в воде и образуют с ней соединения)
Т.е. для определения кислой среды нельзя использовать фенолфталеин.
Качественные ркакции, т.е. как определить ионы
Образуется творожистый белый осадок
Образуется желтоватый творожистый осадок
Образуется желтый творожистый осадок
Образуется желтый осадок
Выпадает молочно-белый осадок
Бурное выделение газа СО 2
Появление запаха NH 3
Зеленоватый осадок↓, буреющий на воздухе
Белый ↓ гелеобразный, в избытке щелочи растворяется
Белый осадок CaCO 3
Вычисление массовой доли химического элемента в веществе
Массовая доля химического элемента в общей массе соединений равна отношению массы данного элемента к массе всего соединения (выражают в долях единицы или в процентах)
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.
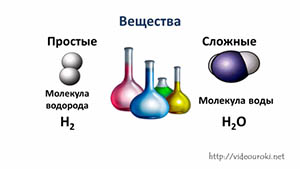
1. Предмет химии. вещества
Химия 8 класс

2. Роль химии в нашей жизни
Химия 8 класс

3. Знаки химических элементов
Химия 8 класс
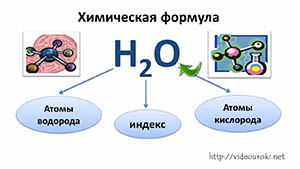
4. Химическая формула. Относителная атомная и молекулярная масса
Химия 8 класс

5. Основные сведения о строении атома. состав атомных ядер
Химия 8 класс

6. Порядковый номер элемента. Изотопы
Химия 8 класс
7. Структура периодической таблицы элементов
Химия 8 класс

8. Строение электронных оболочек атома
Химия 8 класс

9. Ионная связь
Химия 8 класс

10. Ковалентная неполярная связь
Химия 8 класс

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.

Химия
Атом — мельчайшая частица элемента, сохраняющая все его химические свойства.
Атомная единица массы (а.е.м.) — ровно 1/12 часть массы атома углерода 126C, в ядре которого 6 протонов и 6 нейтронов, а в электронной оболочке 6 электронов. Другое название — углеродная единица. Единица, в которой измеряют массу атомов, молекул и субатомных частиц.
Атомный вес (в численном выражении то же, что ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА) — масса атома какого-либо элемента, выраженная в атомных единицах массы (углеродных единицах). Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности.
Атомный радиус r — это величина, характеризующая размер атома. Чем больше атомный радиус, тем дальше от ядра простирается его электронное облако. Большинство атомов имеют радиусы в пределах 0.05 — 0.2 нанометра (нм); самым маленьким является атом гелия (r 0.23 нм).
Бинарные соединения — химические вещества, образованные двумя химическими элементами.

Валентные электроны — электроны, находящиеся на внешней (валентной) оболочке атома. Валентные электроны определяют поведение химического элемента в химических реакциях, то есть они участвуют в образовании химической связи и завершают электронный слой атомов, участвующих в ней. Чем меньше валентных электронов имеет элемент, тем легче он отдаёт эти электроны (проявляет свойства восстановителя) в реакциях с другими элементами. И наоборот, чем больше валентных электронов содержится в атоме химического элемента, тем легче он приобретает электроны (проявляет свойства окислителя) в химических реакциях при прочих равных условиях.
Гидрокси́ды (гидроо́киси, водокиси) — неорганические соединения, содержащие в составе гидроксильную группу . Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных и щёлочноземельных металлов, а также аммония являются растворимыми и называются щелочами.
Закон сохранения массы — масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Изотопы — химические элементы с одинаковым числом протонов и электронов, но разным числом нейтронов.
Металличность — это качественная характеристика элемента, отражающая стремление его атомов приобретать положительный заряд. Атомы металлов легко расстаются со своими внешними электронами, слабо связанными с ядром; атомы же неметаллов не склонны отдавать электроны, потому что у них связь с ядром крепче. С увеличением атомного радиуса эта связь ослабевает, поэтому в пределах группы металличность усиливается сверху вниз. Важно и то, сколько электронов находится на внешнем слое: чем их больше, тем больше положительный заряд под внешним слоем и тем труднее электронам с ним расстаться.
Молярная масса — масса одного моля вещества в граммах называется молярной массой вещества или грамм-молем (размерность г/моль). Численное выражение молярной массы (грамм-моля) в граммах совпадает с молекулярным весом (или атомным, если вещество состоит из атомов) в единицах а.е.м.
Периодический закон сформулирован Д. И. Менделеевым в 1869 году. К этому времени было известно 63 химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу . Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Правило Бертолле — реакции обмена протекают только тогда, когда образуется малорастворимое соединение (осадок), легколетучее вещество (газ), или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Относительная атомная масса — обозначается символом Ar — отношение массы атома к массе 1/12 атома углерода-12.
Протон — устойчивая элементарная (т.е. неразделимая) частица с элементарным (т.е. наименьшим из возможных) положительным электрическим зарядом и массой 1,67.10-27 кг (или 1,00728 а.е.м.). Порядковый номер химического элемента в таблице Менделеева равняется числу протонов в ядре атома этого элемента.
Соли — вещества, в которых атомы металла связаны с кислотными остатками.
Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4 + . Примеры типичных солей приведены ниже.
NaCl – хлорид натрия,
СаSO4 – сульфат кальция,
СаCl2 – хлорид кальция,
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na + Cl – – хлорид натрия
Ca 2+ SO4 2– – сульфат кальция и т.д.
Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
| Соль какой кислоты | Кислотный остаток | Валентность остатка | Название солей | Примеры |
| Азотная HNO3 | NO3 — | I | нитраты | Ca(NO3)2 нитрат кальция |
| Кремниевая H2SiO3 | SiO3 2- | II | силикаты | Na2SiO3 силикат натрия |
| Серная H2SO4 | SO4 2- | II | сульфаты | PbSO4 сульфат свинца |
| Угольная H2CO3 | CO3 2- | II | карбонаты | Na2CO3 карбонат натрия |
| Фосфорная H3PO4 | PO4 3- | III | фосфаты | AlPO4 фосфат алюминия |
| Бромоводородная HBr | Br — | I | бромиды | NaBr бромид натрия |
| Иодоводородная HI | I — | I | иодиды | KI иодид калия |
| Сероводородная H2S | S 2- | II | сульфиды | FeS сульфид железа (II) |
| Соляная HCl | Cl — | I | хлориды | NH4Cl хлорид аммония |
| Фтороводородная HF | F — | I | фториды | CaF2 фторид кальция |
Степень окисления — условный заряд атома в соединении, если считать, что связь в нём ионная. Степень окисления равна числу электронов, смещённых от атома или к атому. Если электроны смещаются от атома, то его степень окисления положительная . Положительную степень окисления в соединениях имеет атом менее электроотрицательного элемента. Если смещение электронов происходит к атому, то его степень окисления отрицательная .
Химическая связь — это взаимодействие, которое объединяет атомы в более сложные системы — молекулы или кристаллы. Причины образования химической связи:
- неустойчивость атомов с незавершённым внешним уровнем и стремление к его заполнению;
- стремление к минимуму энергии.
По современным данным химическая связь определяется взаимодействием положительно заряженных ядер и отрицательно заряженных электронов. Значит, природа химической связи электростатическая.
В свободном атоме электроны притягиваются только к ядру собственного атома. Когда два атома приближаются друг к другу, между их ядрами и электронами начинают действовать силы отталкивания. Но появляются также силы притяжения между ядром одного атома и электронами другого.
Силы отталкивания уравновешиваются силами притяжения, и атомы удерживаются вместе. Так возникает химическая связь .

Химический элемент — совокупность атомов с одинаковым зарядом атомных ядер.
Электролиты — вещества, растворы которых проводят электрический ток, что обусловлено распадом их на ионы.
Электролитическая диссоциация — распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов (анионов и катионов).
Электрон — стабильная элементарная частица атома, обладающая отрицательным электрическим зарядом; обозначается символом е-
Электронная оболочка атома — область пространства наиболее вероятного нахождения электронов, имеющих одинаковое значение главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не может превышать определенного максимального значения.
Электронная орбиталь — область околоядерного пространства, в которой вероятность нахождения электрона более 90 %.
Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон.
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.

Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s
Читайте также:

