Химия 8 класс кратко
Обновлено: 01.06.2024
Химия 8 класс познакомит школьников еще с одной естественной наукой, которая занимается изучением одной из сторон природы и различных природных явлений. И понятно, что этой наукой является химия.
Химия 8 класс начинает изучение этого предмета с темы, в которой знакомит с химией, как наукой и поясняет о том, что этот предмет изучает. На уроках химии школьники восьмого класса пристальное внимание будут уделять изучению веществ. Они узнают, что такое вещества, какие бывают вещества, а также получат представление об их превращениях.
На уроках химии в 8 классе ученики вначале познакомятся с существующими веществами, потом узнают об их свойствах, будут изучать строение этих веществ, и выяснять, что с этими веществами происходит.
Ведение
Глава 1. Атомы химических элементов
Глава 2. Простые вещества
Глава 3. Соединения химических элементов
Глава 4. Изменения, происходящие с веществами
Глава 5. Простейшие операции с веществом (химический практикум)
Глава 6. Скорость химических реакций. Химическое равновесие
Глава 7. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
Глава 8. Свойства электролитов (химический практикум)
Глава 9. Шеренга великих химиков
Учебный план изучения химии в 8 классе
Программа изучения химии в 8 классе начинается с ознакомления с этой наукой от простых тем к более сложным. В этом учебном году школьники должны получить хорошие базовые знания и быть готовыми к освоению более сложных тем в следующих классах.
Как мы уже говорили, начинать изучение этого предмета мы начнем со знакомства с веществом, узнаем о его составе и строении, а также о его свойствах и биологическом действии.
На уроках химии школьники познакомятся с химическими реакциями и узнают об условиях, в которых находят проявления химические свойства. Ученики расширят свои знания о сферах применения веществ, которые часто можно встретить в повседневной жизни, которые используют в промышленности, сельском хозяйстве и в хозяйственных нуждах человека.
Естественно, что для закрепления полученных знаний и повышения их уровня в восьмом классе на уроках химии в программу входят уроки, на которых будут проводиться различные лабораторные опыты и практические занятия. Благодаря проведению разных химических экспериментов, школьники научатся работать с веществами, познакомятся с правилами поведения в химическом кабинете, научатся безопасному обращению с веществами не только во время проведения опытов, но и в повседневной жизни, в быту и на производстве.
На протяжении всего учебного года в восьмом классе для контроля уровня знаний учеников будут даваться самостоятельные проверочные работы, письменные опросы, тестовые задания и итоговые контрольные.
Учащиеся научатся работать с текстом учебника, будут выполнять различные упражнения, решать задачи и делать другие домашние задания. Ведь очень важно для дальнейшего понимания этого предмета, его усвоить на начальном этапе изучения и тогда уроки химии превратятся в интересный и захватывающийся процесс.
Изучение химии с Гипермаркетом Знаний
Заинтересовать школьников предметом химии помогут различные интерактивные уроки, которые вам предоставляет сайт Гипермаркета Знаний. Здесь вы найдете не только программный материал по химии, но и много других тем, касающихся этого предмета. В нашей онлайн-школе предоставлены разнообразные и интересные материалы, которые помогут вам в доступной форме изучить пропущенный материал или тему, которую вам было сложно понять с первого раза.
На сайте Гипермаркета Знаний вы найдете различные тестовые задания по химии, практические уроки, конспекты, презентации, а также много разных видео материалов. С Гипермаркетом Знаний учится легко и интересно.
Конспекты по химии 8 класс собраны по порядку на этой странице. Они помогут вам наглядно показать учебный материал на своих уроках, а ученик с их помощью сможет самостоятельно изучить любую тему урока по видео или конспекту. Это готовые материалы для учителя химии, которые можно удобно использовать на каждом своем уроке.
1. Предмет химии. вещества
Химия 8 класс

2. Роль химии в нашей жизни
Химия 8 класс

3. Знаки химических элементов
Химия 8 класс
4. Химическая формула. Относителная атомная и молекулярная масса
Химия 8 класс

5. Основные сведения о строении атома. состав атомных ядер
Химия 8 класс

6. Порядковый номер элемента. Изотопы
Химия 8 класс
7. Структура периодической таблицы элементов
Химия 8 класс

8. Строение электронных оболочек атома
Химия 8 класс

9. Ионная связь
Химия 8 класс

10. Ковалентная неполярная связь
Химия 8 класс

Получайте новое первыми










Лицензия на право ведения образовательной деятельности №5251 от 25.08.2017 г.
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
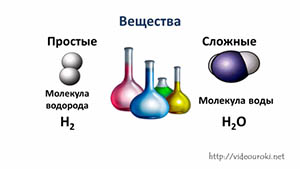
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.
- Количественный состав вещества показывает число атомов каждого элемента в его составе.
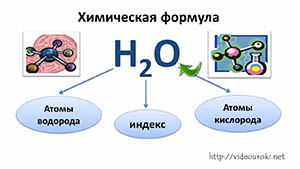
- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12 С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12 С.
- Постоянная Авогадро (Na = 6*10 23 моль -1 ) — число частиц, содержащихся в одном моле.
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12 С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12 С. Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
- Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.

Ярко и красиво! Мы начинаем изучать Химию- одну из самых увлекательных наук!


Урок 2
Основы химии
Сегодня вы узнаете основные понятия, без которых невозможно представить себе химию как науку!


Урок 3
Атомы. Молекулы
На этом уроке мы поговорим о атомно- молекулярном учении


Урок 4
Периодический закон
Сейчас мы рассмотрим основной закон в химии- Периодический


Урок 5
Валентность. Степень окисления. Количество вещества
На этой странице мы поговорим о базовых химических понятиях, без которых дальнейшее изучение химии бесполезно


Урок 6
Вещества в окружающей нас природе и в технике
Что такое чистота вещества? Здравый смысл подсказывает, что это количество примесей в смеси.


Урок 7
Химическая реакция
Одно из самых увлекательных занятий в химии это Химическая реакция!


Урок 8
Химическая реакция- уравнение и типы
Продолжим изучение химической реакции как одной из основ химической науки!


Урок 9
Химия как экспериментальная наука
В повседневной жизни нам приходится решать множество задач, так или иначе связанных с химией – выбрать подходящий клей, правильно разбавить уксус, подобрать пятновыводитель


Урок 10
Понятие о газах
Сейчас мы поговорим о газах и о их роли в природе


Урок 11
Кислород
Кислород – самый распространенный на Земле химический элемент!


Урок 12
Основные классы неорганических соединений
Ты уже неоднократно встречался с различными типами соединений.
На этом уроке мы приведём эти знания в единую систему


Урок 13
Строение атома
Из них состоит все!


Урок 14
Химическая связь
После подробного изучения строения атома и состояния электронных оболочек можно приступать к вопросу о том, каким же образом происходит соединение атомов в молекулы.


Урок 15
Кристаллическое состояние веществ
В этом разделе мы поговорим об одних из самых красивых предметах- кристаллах!


Урок 16
Окислительно-восстановительные реакции
Разберём подробнее, что значит это выражение с точки зрения химии


Урок 17
Водород
На этом уроке мы поговорим о водороде – химическом элементе и простом веществе. Ты узнаешь о его роли в космосе и в нашей жизни, почему люди отказались использовать водород в дирижаблях, можно ли бензобак заменить на водородобак и другие интересные факты


Урок 18
Галогены
В этом уроке мы познакомимся с немногочисленной, но очень важной группой химических элементов


Урок 19
Скорость химической реакции
Согласись, полезно знать как быстро будут проходить твои опыты!


Урок 20
Сера
В этом уроке вы узнаете про серу, чем она вредна и чем полезна, как между собой связано Чёрное море и тухлые яйца, как правильно разбавлять электролит для аккумулятора и ещё много полезного и интересного


Урок 21
Азот. Аммиак


Урок 22
Оксиды азота. Азотная кислота
Азот образует оксиды, в которых проявляет степени окисления от +1 до +5.


Урок 23
Фосфор
Фосфор- один из самых распространенных и жизненно важных химических элементов


Урок 24
Углерод
Углерод – химический элемент IV группы периодической системы химических элементов


Урок 25
Кремний и его соединения
Кремний – химический элемент IV группы периодической системы.
Это самый распространённый после кислорода элемент в земной коре (26 % по массе).


Урок 26
Металлы. Общая характеристика
Из всех химических элементов металлы представляют абсолютное большинство – ученые выделяют 94 металла


Урок 27
Алюминий
Алюминий – химический элемент III группы периодической системы элементов.


Урок 28
Железо. Часть первая
Без этого металла прогресс человечества был бы невозможен!


Урок 29
Железо. Часть вторая
Поговорим о сплавах железа и каким химическим воздействиям оно подвергается в природе. Роль железа в живых организмах и у человека


Урок 30
Щелочные металлы


Урок 31
Щелочноземельные металлы

Лэйдл предлагает пройти уроки химии за 8 класс в режиме онлайн и быстро освоить школьную программу. Курс включает в себя не только теоретические, но и практические занятия, которые научат ребенка пользоваться формулами и решать даже сложные задачи. Сама же программа хорошо структурирована – темы раскрываются последовательно, что упрощает изучение материала.
Онлайн-уроки включают в себя основополагающие сведения о химии как науке, предмете и методах ее изучения. Кроме того, школьнику предстоит изучить свойства атомов и молекул, валентность вещества, основные химические реакции, элементы из таблицы Менделеева.
3 причины изучать уроки с Лэйдл
- Четкая структура занятий.
В нашей команде работают исключительно профессиональные педагоги, которые структурировали школьную программу и постарались сделать уроки максимально полезными и интересными. Ребенок больше не будет путаться в терминологии или искать дополнительную информацию в Интернете. - Наглядные материалы.
Чтобы материал усваивался легко, мы снабдили каждый урок мультимедийными файлами (фото или видео), задачами и упражнениями. Так что школьнику предстоит не только читать о свойствах химических веществ, но и учиться применять полученные знания на практике. - Доступность.
Здесь речь идет не только о демократичной стоимости онлайн-уроков, но и простоте их получения. Вам достаточно пройти регистрацию – и весь курс химии за 8 класс окажется под рукой.
Начните изучение химии прямо сейчас – пройдите пробный урок и оформите подписку на Лэйдл!
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Основные понятия химии.
Определение.
Наука о веществах, их свойствах и превращениях
Это то, из чего состоят физические тела
Определенный вид атомов с одинаковым зарядом ядра
(состоящая из положительно заряженного ядра и одного или несколько отрицательно заряженных электронов;
Наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ)
Состоит из одного или нескольких видов атомов
Свойство атомом замещать или присоединять в соединениях определенное число атомов другого элемента
Это условный заряд атомов химического элемента в соединении (Са +2 О -2 , Са +2 Сl 2 -1 )
Образованы атомами одного химического элемента
Образованы атомами разных химических элементов
Это признаки, по которым одни вещества отличаются от других
Хим - кие явления или химические реакции
Явления, в результате которых их одного вещества образуется другое
Явления, в результате которых изменяются размеры, форма тел или агрегатное состояние
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разную массу
Способность атомов одного химического элемента образовывать несколько простых веществ
Относительная атомная масса
Масса атома (выраженная в углеродных единицах)
Относительная молекулярная масса
Масса молекулы вещества
(выраженная в углеродных единицах)
Количество вещества ( ν = m/М) ( ν = N/N а )
Масса 1 моля вещества (М = m/ν) ( ν = V/V а )
Массовая доля вещества в смеси
Отношение массы вещества к массе смеси
Молярная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
Объемная доля вещества в смеси
Отношение количества одного в-ва к сумме всех в-в
Отношение массы данного объема газа к массе такого же объема другого газа. D = m 1 /m 2
Это сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления – 2 )
Это сложные вещества, состоящие из ионов металлов и связанных с ними гидроксид-ионоа (КОН)
Это сложные вещества, состоящие из атомов водорода и кислотного остатка (Н 3 РО 4 )
Это сложные вещества, состоящие из ионов металлов и кислотных остатков (К 3 РО 4 )
Условная запись химической реакции с помощью химических формул и математических законов.
Это такие реакции, в результате которых из одного или нескольких простых веществ образуется одно сложное
Это такие реакции, в результате которых из одного сложного вещества образуется два и более новых в – в
Это такие реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе
Это реакции, в результате которых два сложных вещества обмениваются своими составными частями
Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном ( 2 SО 2 + О 2 = 2 SО 3 )
Ионные уравнения реакций
Реакции между ионами
2К + + 2ОН - + Са +2 + SО 4 -2 = Са +2 + 2ОН - + 2К + + SО 4 -2
Это вещества, изменяющие скорость химических реакций, но по окончании их остающиеся качественно и количественно неизменными
Биологические катализаторы белковой природы
Вещества, растворы которых проводят электрический ток.
Вещества, растворы которых не проводят электрический ток
Основные классы неорганических соединений
Простые вещества
Сложные вещества
Оксиды
Оксиды металлов Оксиды неметаллов
(основные оксиды) (кислотные оксиды)
Основания Кислоты
Способы получения:
Оксидов –
- взаимодействие простых веществ с кислородом
- термическое разложение оснований, кислот, солей
- взаимодействие простых веществ и солей с кислотами
- взаимодействие металлов или их оксидов с водой
- действие щелочей на водные растворы солей
- электролиз раствора солей
- взаимодействие простых веществ с водородом
- взаимодействие воды с кислотными оксидами(ангидридами)
- окисление простых веществ
- взаимодействие солей с кислотами
- взаимодействия кислот и оснований
КОН + НСl = КСl + Н 2 О
- взаимодействия кислот и основными оксидами
- взаимодействия щелочей с кислотными оксидами
- взаимодействия кислотных и основных оксидов
- взаимодействия щелочей с солями
3КОН + Fe Сl 3 = 3КСl + Fe (ОН) 3 ↓
- взаимодействия кислот с солями
- взаимодействия двух солей
- взаимодействия простых веществ
Контрольная работа
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) оксид серы(IV ) + вода = сернистая кислота
б) серная кислота + цинк = сульфат цинка + водород
в) гидроксид железа(II ) = оксид железа(II) + вода
2. Вычислите массовую долю алюминия и серы в сульфиде алюминия.
3. Вычислите массу натрия, необходимого для получения 10,7г хлорида
натрия в избытке хлора.
4.Сколько граммов сульфата меди и сколько граммов воды надо взять,
чтобы приготовить 250 грамм 25%-ного раствора его?
Приведены схемы реакций.
Составьте уравнения химических реакций и укажите их тип.
а) азотная кислота + гидроксид хрома(III) = нитрат хрома(III) + вода
б) гидроксид алюминия = оксид алюминия + вода
в) оксид углерода(IV) + вода = угольная кислота
2. Вычислите массовую долю железа и кислорода в оксиде железа (III)
3. Рассчитайте объем водорода полученного при взаимодействии 48 г магния с избытком соляной кислоты.
4. Сколько граммов нитрата цинка и сколько граммов воды надо взять, чтобы приготовить 50
Контрольная работа
1. Составьте уравнения химических реакций, соответствующих схеме:
С → СО → СО 2 → Н 2 СО 3 → Nа 2 СО 3 → СО 2
2. Опишите способы распознавания газов: водорода и аммиака, помещенных в цилиндр без этикеток.
3. Какой объем водорода (н.у.) потребуется для взаимодействия с оксидом железа (III) массой 640 кг, содержащего 25% примесей? Какое количество вещества воды при этом образуется?
4. Рассчитайте массу цинка, который нужно растворить в соляной кислоте, чтобы получить водород, необходимый для восстановления оксида меди(II) массой 20г до металла.
5. При сливании 400г 9,8%-ного раствора серной кислоты с раствором, содержащим избыток хлорида бария, получили осадок, масса которого:
а) 93,2г б)39,2г в)186,6г г)23,3г
1. Составьте уравнения химических реакций, соответствующих схеме:
S → SО 2 → SО 3 → Н 2 SО 4 → СаSО 4 → Са(ОН) 2
2. Опишите способы распознавания газов: кислорода и углекислого газа, помещенных в цилиндр без этикеток.
3. Какой объем воздуха (н.у.) потребуется для взаимодействия с 270г алюминия, содержащего 20% примесей? Какое количество вещества оксида алюминия при этом получится?
4. При восстановлении улем, при высокой температуре, смеси карбоната цинка и оксида цинка (масса смеси 53 кг) получен цинк массой 39 кг. Рассчитайте массовую долю оксида цинка в исходной смеси.
5. При сливании 25г 16%-ного раствора гидроксида натрия с раствором, содержащим избыток хлорида железа (III), получили осадок, масса которого:
а) 3,57г б) 7,14г в) 2,38г г) 4,76г
- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 611 408 материалов в базе
Материал подходит для УМК
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Свидетельство и скидка на обучение каждому участнику
Другие материалы
Вам будут интересны эти курсы:
Оставьте свой комментарий
- 11.08.2019 4114
- DOCX 32.6 кбайт
- 65 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Аносова Любовь Васильевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
40%
- Подготовка к ЕГЭ/ОГЭ и ВПР
- Для учеников 1-11 классов
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Россияне ценят в учителях образованность, любовь и доброжелательность к детям
Время чтения: 2 минуты
Новые курсы: функциональная грамотность, ФГОС НОО, инклюзивное обучение и другие
Время чтения: 15 минут
Отчисленные за рубежом студенты смогут бесплатно учиться в России
Время чтения: 1 минута
В Россию приехали 10 тысяч детей из Луганской и Донецкой Народных республик
Время чтения: 2 минуты
Школы граничащих с Украиной районов Крыма досрочно уйдут на каникулы
Время чтения: 0 минут
Рособрнадзор предложил дать возможность детям из ДНР и ЛНР поступать в вузы без сдачи ЕГЭ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Читайте также:

