H3po4 физические свойства кратко
Обновлено: 04.07.2024
В степени окисления +5 фосфор способен образовывать определенные кислоты:
- орто-фосфорную H 3 P O 4 ;
- мета-фосфорную H P O 3 ;
- пиро-фосфорную H 4 P 2 O 7 .
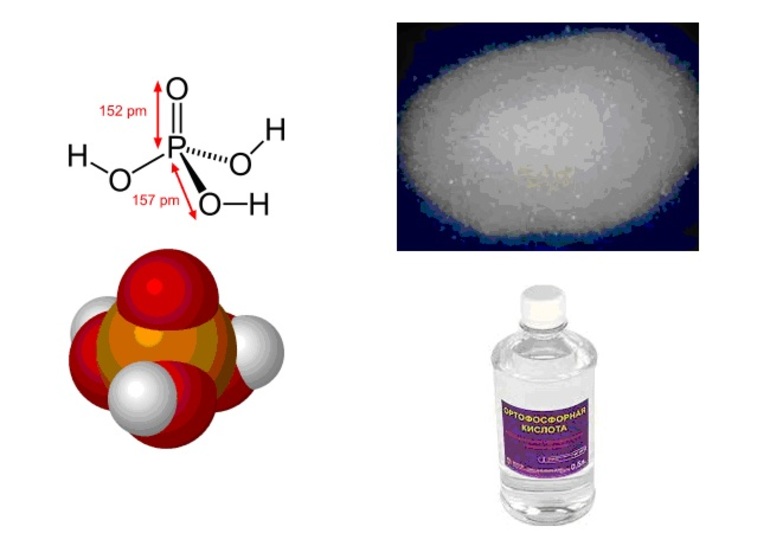
Ортофосфорная кислота (фосфорная кислота) является неорганической трехосновной кислотой средней силы. Чистое вещество представляет собой прозрачные гигроскопические кристаллы.
Химическая формула фосфорной кислоты:
Во многих случаях в химии фосфорной кислотой называют ее водный раствор с концентрацией 85%. Такая жидкость напоминает сироп и не обладает запахом. Соединение характеризуется высокой степенью растворимости в этаноле и других растворителях. Строение фосфорной кислоты выражает структурная формула:
При стандартных условиях, то есть температуре 25 °C и давлении 1 атм, фосфорная кислота характеризуется классом опасности Н 290 , Н 314 .
Фосфорная кислота не обладает специфическим токсическим эффектом. Показатели системной токсичности вещества достаточно невысокие. Раствор фосфорной кислоты оказывает раздражающее воздействие на органы зрения и дыхания, слизистые оболочки. Если концентрация соединения превышает 10%, смесь характеризуется раздражающим эффектом, а при 25% содержания вещества раствор вызывает коррозию.
Диссоциация фосфорной кислоты в водных растворах протекает ступенчато:
H 3 P O 4 ⇄ H + + H 2 P O 4 - ,
H 2 P O 4 - ⇄ H + + H P O 4 2 - ,
H P O 4 2 - ⇄ H + + P O 4 3 - .
С каждой новой ступенью диссоциация ослабевает. Полного распада на ионы у фосфорной кислоты не наблюдается. Вещество характеризуется меньшей активностью в процессе химического взаимодействия, по сравнению с серной, азотной, соляной кислотами.
Химические и физические свойства
Физические свойства фосфорной кислоты:
- твердое агрегатное состояние;
- молярная масса 98 г/моль;
- в чистом виде кристаллическое вещество не имеет окраски;
- температура плавления 42,35 °С;
- температура кипения +158 °C;
- кристаллизуется в моноклинной сингонии.
В твердом состоянии вещество гигроскопично и способно расплываться в воздушной среде. Фосфорная кислота смешивается с водой в любых соотношениях. Наиболее распространены следующие концентрации раствора:
- 75 % H 3 P O 4 (с температурой плавления −20 °С).
- 80 % H 3 P O 4 (с температурой плавления 0 °С).
- 85 % H 3 P O 4 (с температурой плавления 20 °С).
Используя 85% раствор фосфорной кислоты, получают безводную кислоту путем испарения жидкости в вакуумной среде при температурном режиме 80 °С. В концентрированных растворах выпадает осадок в виде гемигидрата H 3 P O 4 · 0 , 5 H 2 O .
Молекулы фосфорной кислоты, находящейся в твердом состоянии или в виде концентрированного раствора, соединены водородными связями.
Фосфорная кислота является трехосновной кислотой средней силы. В водных растворах соединение диссоциирует по трем ступеням c константами диссоциации:
Сопровождается выделением теплоты только диссоциация по первой ступени (экзотермическая). По второй и третьей ступени теплота поглощается, то есть процесс является эндотермическим:
H 3 P O 4 ( a q ) + H 2 O ( l ) ⇌ H 3 O ( a q ) + + H 2 P O 4 ( a q ) -
H 2 P O 4 ( a q ) - + H 2 O ( l ) ⇌ H 3 O ( a q ) + + H P O 4 ( a q ) 2 -
H P O 4 ( a q ) 2 - + H 2 O ( l ) ⇌ H 3 O ( a q ) + + P O 4 ( a q ) 3 -
В результате фосфорная кислота может образовывать как средние соли (фосфаты), так и кислые (гидрофосфаты и дигидрофосфаты).
Соединение проявляет свойства кислоты, не являющейся окислителем, при вступлении в реакции с такими веществами, как:
- соли;
- гидроксиды металлов;
- оксиды;
- металлы.
Нагрев фосфорной кислоты сопровождается отщеплением воды. В результате образуются пирофосфорная кислота и метафосфорная кислота:
2 H 3 P O 4 → H 2 O + H 4 P 2 O 7 ;
H 4 P 2 O 7 → H 2 O + 2 H P O 3 .
Ортофосфорная кислота отличается от других фосфорных кислот взаимодействием с нитратом серебра. В результате этой реакции можно наблюдать выпадение осадка с желтой окраской. Если в реакции участвуют другие фосфорные кислоты, то цвет осадка будет белым:
H 3 P O 4 + 3 A g N O 3 → A g 3 P O 4 + 3 H N O 3 .
Качественная реакция на ион H 2 Р О 4 представляет собой процесс формирования молибденофосфата аммония в виде осадка с ярко-желтой окраской:
H 3 P O 4 + 12 [ N H 4 ] 2 M o O 4 + 21 H N O 3 → [ N H 4 ] 3 P M o 12 O 40 · 6 H 2 O ↓ + 21 N H 4 N O 3 + 6 H 2 O
Основные способы получения
Первым фосфорную кислоту синтезировал Роберт Бойль в 1694 году, используя в реакции оксид фосфора(V).
В лабораторных условиях соединение получают в процессе окисления фосфора с помощью азотной кислоты:
3 P + 5 H N O 3 + 2 H 2 O → 3 H 3 P O 4 + 5 N O .
Основные промышленные методы синтеза фосфорной кислоты:
Технология производства фосфорной кислоты, основанная на термическом методе, предполагает сжигание фосфора до оксида фосфора(V), который затем взаимодействует с водой:
4 P + 5 O 2 → 2 P 2 O 5 ;
P 2 O 5 + 3 H 2 O → 2 H 3 P O 4 .
На практике используют разные способы для реализации данного химического взаимодействия.
IG-процесс (по названию компании IG) предполагает проведение этих реакций в одной реакционной колонне. В нее с помощью сжатого воздуха или пара под давлением 1,5 МПа сквозь сопло перекачивают фосфор, температура сгорания которого составляет больше 2000 °C.
Полученный в результате процесса оксид фосфора(V) поглощается фосфорной кислотой, стекающей с верхней части по стенкам колонны. Таким образом, стенки колонны полностью покрываются кислотой. Вещество выполняет сразу несколько функций:
- растворение оксида фосфора(V);
- отвод тепла от химического процесса сгорания;
- защита конструкции колонны от воздействия огня.
Образованная фосфорная кислота концентрируется в отсеке в нижней части колонны. Соединение транспортируется по теплообменнику, поступает в верхнюю часть колонны и вновь стекает по стенкам.
Оборудование, используемое в химической промышленности для синтеза фосфорной кислоты, изготовлено из нержавеющей низкоуглеродной стали. Этот материал стабилен и не вступает в реакции с концентрированной фосфорной кислотой при температуре, не превышающей 100 °C.
Особенностью синтезированной с помощью данной методики фосфорной кислоты является минимальная концентрация примесей соединений в низших степенях окисления. К примеру, в соединении присутствует фосфористая кислота H 3 P O 3 , доля которой составляет 0,1 %.
Полученную кислоту очищают от примесного мышьяка, для которого характерно присутствие в небольших концентрациях даже в очень чистом фосфоре. Такая очистка производится с помощью воздействия сероводорода (его получают путем добавления сульфида натрия в фосфорную кислоту) и фильтрования после выпадения в осадок сульфида мышьяка.
Данные химические реакции лежат и в основе TVA-процесса (от Tennessee Valley Authority). Отличие от предыдущей технологии заключается в том, что сжигание фосфора и поглощение оксида фосфора(V) реализуются по отдельности.
Фосфор и воздух подают в стальную камеру сгорания, которая дополнена внешним охлаждением. Затем продукты сгорания транспортируют через верхнюю часть камеры в отсек поглощения для дальнейшего образования фосфорной кислоты.
В Хехст-процессе (по названию компании Hoechst) реакции сгорания и поглощения разделены. Отличие данной технологии синтеза фосфорной кислоты от других методов заключается в использовании теплоты, которая выделяется в процессе сгорания фосфора, для генерирования пара.
При реализации экстракционного метода синтеза фосфорной кислоты природные фосфаты обрабатывают с помощью неорганических кислот. В распространенных случаях с этой целью используют хибинский апатитовый концентрат и фосфориты Каратау.
Обработка фосфатов активно применялась в промышленности еще в середине 1880-х годов. Данное направление начало развиваться после Второй мировой войны, что объяснялось высоким спросом на минеральные удобрения в сельском хозяйстве.
Процесс экстракционного получения фосфорной кислоты. Уравнение схемы разложения сырья, где параметр x может быть равен от 0,1 до 2,2:
C a 5 ( P O 4 ) 3 F + 5 H 2 S O 4 + 5 x H 2 O → 5 C a S O 4 · x H 2 O + 3 H 3 P O 4 + H F .
В результате образуется побочный продукт в виде сульфата кальция. Данное вещество при определенной температуре и концентрации фосфорной кислоты способно выпадать в осадок в виде дигидрата ( C a S O 4 · 2 H 2 O ) или гемигидрата ( C a S O 4 · 0 , 5 H 2 O ) . Исходя из этого признака, различают следующие типы экстракционных процессов синтеза фосфорной кислоты:
- дигидратный;
- гемигидратный;
- комбинированный (дигидратно-гемигидратный и гемигидратно-дигидратный).
Существует также ангидритный метод, который предполагает выпадение в осадок безводного сульфата кальция. Технология не применяется в промышленном производстве фосфорной кислоты, что объясняется возникновением серьезных коррозийных проблем.
Классическая технология синтеза фосфорной кислоты — дигидратный процесс. Достоинство данного метода заключается в относительно низкой температуре, что исключает образование коррозии. При реализации технологии допустимо использовать разное фосфатное сырье и осуществлять его переработку в больших объемах.
На первой стадии происходит измельчение сырья до размера частиц меньше 150 мкм. Фосфат и серная кислота поступают в реактор отдельными потоками. Таким образом, сформированный слой сульфата кальция на частицах не препятствует дальнейшему разложению. Температурный режим процесса поддерживается в пределах от 70°С до 80°С. При этом концентрация фосфорной кислоты в системе составляет 28—31 % в пересчете на P 2 O 5 .
Данные условия позволяют получить сульфат кальция в виде дигидрата. Недостатком технологии является необходимость в измельчении начального сырья и дополнительном концентрировании синтезированной фосфорной кислоты до 40–55 % и даже до 70 % P 2 O 5 .
Гемигидратный процесс был разработан с целью исключить необходимость концентрировать образованную фосфорную кислоту. Отличием этого метода синтеза является более высокая температура, которая достигает 80–100 °С. При этом создаются условия для более стабильной формы продукта, образующегося в виде гемигидрата сульфата кальция. Концентрация полученной фосфорной кислоты составляет в результате 40–48 %.
Гемигидратно-дигидратный процесс является разработкой японских ученых. С помощью данной технологи удается получить почти чистый гипс, залежи которого в Японии отсутствуют. Сырье обрабатывают при высокотемпературном воздействии. В результате формируется гемигидрат сульфата кальция, который в дальнейшем перекристаллизовывают в дигидрат.
Процесс концентрирования фосфорной кислоты, которую получают по дигидратной технологии, заключается в вакуумном испарении. На устаревших производствах применяют погружное горение. В некоторых случаях в определенной последовательности применяют несколько испарителей. В результате пары с одного испарителя используются, чтобы нагревать раствор в следующем испарителе.
В процессе испарения воды из фосфорной кислоты также удаляется фтор в виде смеси S i F 4 и H F . Таким образом, когда концентрация фосфорной кислоты увеличивается с 30 до 50 % P 2 O 5 , из нее удаляется 50–60 % фтора. Так как выбросы фтора загрязняют окружающую среду, выделяемые вещества сразу используют в производстве кремнефтористоводородной кислоты H 2 S i F 6 .
Способы удаления разных неорганических примесей:
В осадке остаются примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты) и некоторые другие металлы.
Процесс экстракции основан на переходе фосфорной кислоты в органическую фазу. Далее вещество промывают водой. В результате происходит удаление катионных и анионных примесей. Отделение фосфорной кислоты от растворителя достигается перегонкой.
Спрос в мире на фосфорную кислоту на 1989 г. составил 40,6 млн тонн в год в пересчете на P 2 O 5 . Экстракционный метод синтеза наиболее распространен в промышленности (95 % от общего количества). Это объясняется экономичным потреблением энергетических ресурсов. Остальные 5 % объема фосфорной кислоты получают термическим способом.
Основным поставщиком (и потребителем) экстракционной фосфорной кислоты являются США. В данном случае доля от общего объема производства соединения равна 90 %. В 1980-е годы отмечено снижение запасов производимой фосфорной кислоты в результате отказа от фосфорсодержащих детергентов и минеральных удобрений. Данное решение объясняется загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоемов.
Экстракционная технология синтеза фосфорной кислоты предполагает формирование отвалов сульфата кальция: на 1000 килограмм P 2 O 5 получают 4,5—5,5 тонны загрязненного сульфата кальция, который нуждается в утилизации. По состоянию на 2008 год существовало несколько способов:
- затопление в водоемах (10 %);
- сваливание на суше (около 88 %);
- применение в качестве сырья.
В процессе погружения в водоемы растворение сульфата кальция протекает активно. Показатели растворимости вещества в морской воде составляют 3,5 г/л, а природное содержание равно 1,6 г/л. Примеси оксида кремния и оксида алюминия не растворяются.
Где используется, области применения
Фосфорную кислоту используют в качестве флюса в процессе пайки (по окисленной меди, по черному металлу, по нержавеющей стали).
Соединение применяют для проведения научных экспериментов в лабораторной практике.
С помощью вещества удаляют ржавчину с металлических поверхностей. В результате такой обработки образуется защитная пленка, которая служит барьером для коррозионных процессов.
Фосфорную кислоту используют в составе фреонов, в промышленных морозильных установках в качестве сильного связующего компонента.
В авиации ортофосфорная кислота входит в состав гидрожидкости НГЖ-5У и ее иностранных аналогов.
В пищевой промышленности вещество используют, как пищевую добавку E 338 . Ортофосфорная кислота регулирует уровень кислотности в газированных напитках таких, как Кока-Кола. На вкус слабый водный раствор ортофосфорной кислоты с небольшим содержанием сахара похож на крыжовник.
В области звероводства, в частности, на фермах, где разводят норок, путем подкормки раствором ортофосфорной кислоты предотвращают повышение кислотности в желудке и развитие мочекаменной болезни.
Вещество при использовании в гидропонных системах позволяет контролировать уровень pH питательного раствора.
Ортофосфорная кислота нашла широкое применение в стоматологии. С помощью этого вещества протравливают эмаль и дентин, то есть снимают смазанный слой, перед наложением пломбы на зубы.
Ортофо́сфорная кислота́ (фо́сфорная кислота́) [1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Содержание
Получение
Фосфорную кислоту получают из фосфата:


Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:

С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:

Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:

Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
" width="" height="" />
(дигидрофосфат натрия) " width="" height="" />
(гидрофосфат натрия) " width="" height="" />
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
" width="" height="" />
" width="" height="" />
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
Примечания
- ↑Химия. Лекции и электронные учебники на Бобыч.Ру (рус.) . Архивировано из первоисточника 7 февраля 2012.Проверено 13 сентября 2009.
Литература
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
- Неорганические кислородсодержащие кислоты
- Соединения фосфора
- Пищевые добавки
- Неорганические кислоты
- Нуклеотиды
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Ортофосфорная кислота" в других словарях:
ОРТОФОСФОРНАЯ КИСЛОТА — ОРТОФОСФОРНАЯ КИСЛОТА, то же, что фосфорная кислота … Современная энциклопедия
ортофосфорная кислота — Регулятор кислотности пищевого продукта, получаемый химическим синтезом из природных фосфатов, содержащий основного вещества не менее 67,0 % и не более 85,7 %, сульфатов не более 1500 мг/кг в пересчете на CaSO4 , фтористых соединений не более 10… … Справочник технического переводчика
ортофосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
ортофосфорная кислота — Е338 – ортофосфорная кислота. В зависимости от концентрации применяют для производства фосфорных удобрений, в пищевой, текстильной, стекольной промышленности. Пропитка древесины ортофосфорной кислотой и ее солями делают дерево негорючим. На этой… … Универсальный дополнительный практический толковый словарь И. Мостицкого
ортофосфорная кислота — то же, что фосфорная кислота … Энциклопедический словарь
ОРТОФОСФОРНАЯ КИСЛОТА — то же, что фосфорная кислота … Естествознание. Энциклопедический словарь
ортофосфорная кислота — фосфорная кислота … Cловарь химических синонимов I
Ортофосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I

Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Термический способ
- 3.2 Экстракционный способ
- 3.3 Концентрирование и очистка
- 3.4 Экономические и экологические аспекты
- 4.1 Авиационная промышленность
- 4.2 Пищевая промышленность
- 4.3 Сельское хозяйство
- 4.4 Стоматология
Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
![Ортофосфорная кислота]()
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10 –3 (pKa1 2,12); K2 = 6,2⋅10 –8 (pKa2 7,20); K3 = 5,0⋅10 –13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
H3PO4(aq) + H2O(l) ⇌ H3O(aq) + + H2PO4(aq) − H2PO4(aq) − + H2O(l) ⇌ H3O(aq)+ + HPO4(aq) 2− HPO4(aq) 2− + H2O(l) ⇌ H3O(aq) + + PO4(aq) 3− Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
Качественной реакцией на ион H2PO4 − является образование ярко-жёлтого осадка молибденофосфата аммония:
![Ортофосфорная кислота]()
H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O
Получение
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority ), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья.
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.
![Ортофосфорная кислота]()
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.
![Ортофосфорная кислота]()
Безопасность
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
![Фосфорная кислота: свойства, получение и применение]()
Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
![Физические свойства фосфорной кислоты]()
Наименование Количество атомов Массовая доля, % Водород (H) 3 3,10 Фосфор (P) 1 65,30 Кислород (O) 4 31,60 При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
Концентрация, % Температура плавления, °C Плотность, грамм/мл 75 -20 1,579 80 0 1,633 85 +20 1,689 Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO4 3- и молекулами воды H2O.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4 - = H+ + HPO42-.
- HPO4 2- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.
![Фосфорная кислота]()
При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения
![Роберт Бойль]()
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
![Получение фосфорной кислоты]()
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
![Получение экстракционной фосфорной кислоты]()
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
![Производство минеральных удобрений]()
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
![Металлообработка фосфорной кислотой]()
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
![ГОСТ]()
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Читайте также: