Гомогенный катализ это кратко
Обновлено: 02.07.2024
ГОМОГЕННЫЙ КАТАЛИЗ
ГОМОГЕННЫЙ КАТАЛИЗ, ускорение хим. р-ции в присутствии катализатора, к-рый находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или р-ре. При гомогенном катализе, как и при гетерогенном катализе, катализатор в р-ции не расходуется, однако является ее необходимым участником; без катализатора р-ция протекает гораздо медленнее или не идет вовсе.
Механизм гомогенно-каталитических реакций. Можно выделить сравнительно небольшую группу процессов, в к-рых участие катализатора не связано с образованием определенного хим. соед. с субстратом. К таким процессам относится, напр., катализ парамагн. частицами синглет-триплетного превращения карбенов (изменяется электронный спин молекулы) или орто-, пара-превращение Н2 (изменяется ядерный спин). Формально к гомогенному катализу можно отнести газофазные р-ции рекомбинации атомов и простейших радикалов в присут. химически инертных частиц, к-рые, участвуя в тройном соударении, обеспечивают отвод энергии, выделяющейся при образовании хим. связи. Однако в огромном большинстве случаев механизм Т.к., как и гетерог. катализа, включает более или менее сложное хим. превращ. катализатора в р-циях.
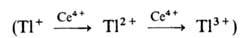
Рассмотрим в кач-ве примера гомогенного катализа окислит.-восстановит. некомплементарной р-ции, т.е. такой р-ции, в к-рой число электронов, отдаваемых одной частицей восстановителя и принимаемых одной частицей окислителя, не совпадает. В р-ции 2Се 4+ + Tl + -> 2Се 3 + + Tl 3+ последовательное одноэлектронное окисление Т1 +
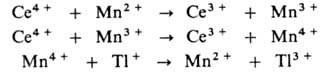
затруднено из-за высокого окислит.-восстановит. потенциала пары Т1 2+ /Т1 + (для пары Т1 3+ /Т1 2+ этот потенциал значительно ниже). В присут. ионов Мп р-ция протекает по многостадийному механизму:
Ионы Мп переводят одноэлектронный перенос в р-циях Мп 2+ и Мn 3 с Се 4 + в двухэлектронный - в р-ции Мn 4+ с Т1 + (все р-ции с участием ионов Мп комплементарны). Протекание всех стадий облегчается из-за того, что для пар Мn 4+ /Мn 3+ и Мn 3+ /Мn 2+ окислит.-восстановит. потенциалы близки и расположены между значениями этих потенциалов для пар Се 4+ /Се 3+ и Т1 3+ /Т1 + .
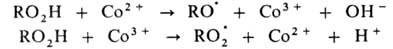
В радикально-цепных процессах в присут. нек-рых в-в может ускоряться образование радикалов в р-циях зарождения или разветвления цепи. Так, при окислении орг. в-ва RH в присут. ионов Со в небольшой концентрации ускоряется разветвление цепи, а при высокой концентрации этих же ионов-также и развитие цепи. Каталитич. механизм распада гидропероксида включает следующие стадии:
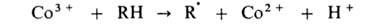
Развитие цепи каталитически ускоряется по схеме:
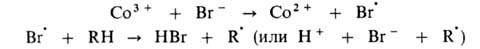
Эта же р-ция может дополнительно ускоряться в присут. ионов Вr - , к-рые играют роль сокатализатора:
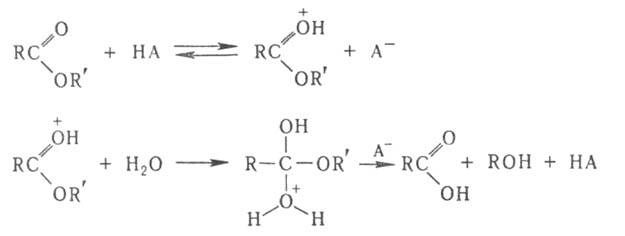
В кислотно-основном гомогенном катализе под действием катализатора обычно усиливаются электроф. или нуклеоф. св-ва молекул реагентов. К-ты и основания, ускоряющие такие р-ции, могут служить катализаторами в недиссоциированной форме (общий кислотно-основной катализ) либо воздействовать на субстрат ионами Н3О + и ОН - (специфич. кислотно-основной катализ). Напр., при кислотном гидролизе сложных эфиров каталитич. действие к-ты НА связано с протонированием карбонильной группы, что облегчает последующее присоединение воды:
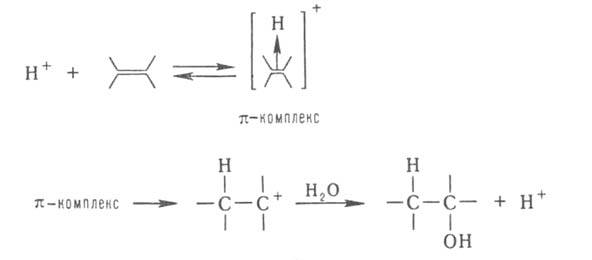
При гетеролитич. присоединении по кратным связям молекулы AD (А-акцепторная, D-донорная часть молекулы) катализатором м. б. более сильный, чем AD, акцептор (электрофил) А или донор (нуклеофил) D. Напр., при гидратировании олефинов к-та Н + служит катализатором, т. к. облегчает последующее взаимод. с водой:
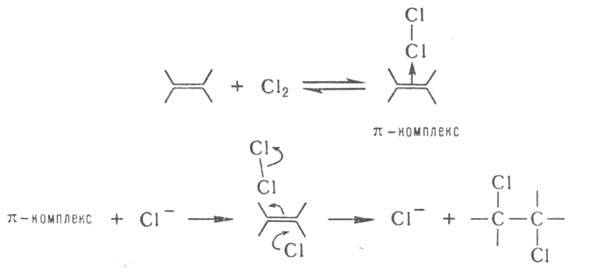
При присоединении Сl2 или НСl катализатором м. б. ион Сl - :
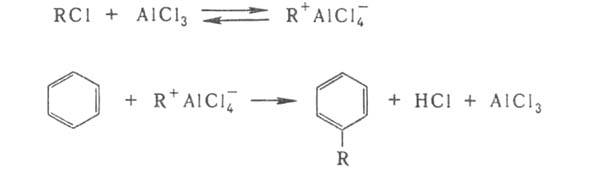
Апротонные к-ты могут катализировать гетеролитич. р-ции непосредственно или образуя сильную протонную к-ту, если в системе присутствует вода или др. слабая протонная к-та. В р-ции Фриделя - Крафтса (алкилирование ароматич. соед.) катализатором служит АlСl3, усиливающий электроф. св-ва алкильной группы в алкилгалогениде RCl:
Особенно высокой каталитич. активностью в гетеролитич. р-циях обладают т. наз. бифункциональные катализаторы-соед., молекулы к-рых включают как акцепторную, так и донорную группы. Р-ция в этом случае идет через циклич. переходное состояние. Так, 2-гидроксипиридин - хороший катализатор мутаротации глюкозы вследствие одноврем. участия в р-ции донорного атома N и акцепторной группы ОН гидроксипиридина. Активность 2-гидроксипиридина существенно выше, чем эквивалентной смеси пиридина и фенола, взятых в тех же концентрациях. Усиление каталитич. эффекта по сравнению с монофункциональными катализаторами определяется прежде всего энтропийным фактором-уменьшением числа частиц, образующих активиров. комплекс.
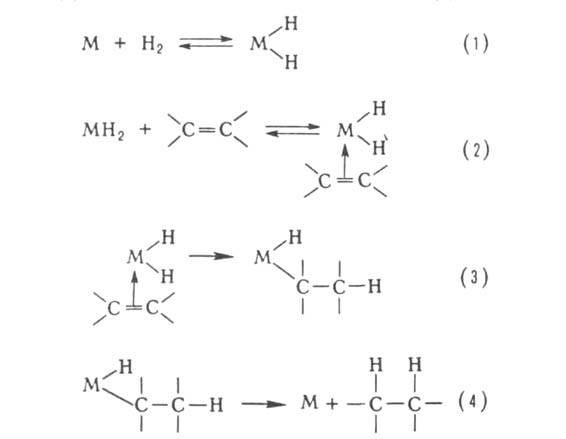
В металлокомплексном гомогенном катализе р-ции ускоряются в присут. комплексных соед. Ti, Fe, Cu, Pt и др. переходных металлов, к-рые способны к образованию комплексов с молекулами субстратов. Каталитич. активность м. б. обусловлена след. факторами: 1) пространств.близостью молекул субстратов, входящих как лиганды в координац. сферу металла, 2) ослаблением хим. связей в молекулах субстратов и снижением энергии активации при их разрыве; 3) усилением вследствие электронных эффектов донорных или акцепторных св-в молекул субстратов, входящих в металлокомплекс; 4) снятием запретов по симметрии молекулярных орбиталей благодаря участию d-орбиталей металлов; 5) возможностью многоэлектронных р-ций с использованием d-электронов переходных металлов в некомплементарных окислит.-восстановит. р-циях с субстратами, для к-рых последовательное одноэлектронное окисление или восстановление термодинамически затруднено. Комплексы переходных металлов, кроме того, иногда облегчают образование своб. радикалов, что обеспечивает возможность катализа радикальных и радикально-цепных р-ций. Металлокомплексные соед. катализируют гидрирование, окисление, полимеризацию, карбонилирование олефинов и ацетиленов, фиксацию азота, диспропорционирование олефинов, активацию и разл. р-ции алканов и др. Типичный механизм металлокомплексного гомогенного катализа рассмотрен на примере каталитич. гидрирования олефинов. Он включает стадии окислит. присоединения Н2 (1), образование комплекса с олефином (2), внедрение молекулы олефина по связи М—Н (3), восстановит. отщепление алкана (4):
Т. обр., во всех типах гомогенныого катализа катализатор, как правило, обеспечивает новый хим. механизм процесса. Каталитич. р-ции происходят в неск. стадий, в одной из к-рых частица катализатора входит в каталитич. цикл, а в другой выделяется в своб. состоянии, чтобы вновь участвовать в р-ции. В этом смысле гомогенно-каталитич. р-ции подобны цепным; их принципиальное отличие заключается в том, что в цепных р-циях скорость образования продукта больше скорости образования активного центра (скорости инициирования цепи) в v раз (v- длина цепи), тогда как в каталитич. процессах скорость образования активного центра катализатора больше скорости образования продукта или этот активный центр присутствует в системе заранее.
Кинетика гомогенно-каталитич. р-ций определяется их механизмом (см. Каталитических реакций кинетика).
Практическое применение. Гомогенный катализ используют для пром. получения: спиртов-гидратацией олефинов в присут. к-т (H2SO4, H3PO4); нитробензола и др. нитросоединений-нитрованием ароматич. соед. в присут. H2SO4; уксусной к-ты-карбонилированием метанола в присут. комплексов Rh (сокатализатор-HI); терефталевой к-ты-окислением п-ксилола в присут. солей Со; альдегидов - гидроформилиро-ванием олефинов в присут. карбонилов Со; лекарств, напр. L-ДОФА,-энантиоселективным гидрированием аминокислоты в присут. комплекса Rh с хиральными лигандами и др. Многие р-ции с участием металлокомплексных соед. по высокой регио- и стереоселективности приближаются к реакциям ферментативного катализа. Использование принципов действия ферментов позволяет разрабатывать принципиально новые гомогенно-каталитические процессы.
Катализ гомогенный - это ускорение химической реакции в присутствии катализатора, который находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или растворе.
При гомогенном катализе, как и при гетерогенном катализе, катализатор в реакции не расходуется, однако является ее необходимым участником; без катализатора реакция протекает гораздо медленнее или не идет вовсе.
Гомогенные каталитические процессы в газовой фазе встречаются относительно редко, т. к. лишь немногие вещества, обладающие каталитическими свойствами, могут быть переведены в газообразное состояние при условиях, когда не разрушались бы молекулы реагирующих веществ.
Жидкофазные гомогенные каталитические процессы осуществляют обычно в реакторах с различного рода перемешивающими устройствами.
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов – веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = H2+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов

Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование:
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Гомогенный катализ, ускорение химической реакции в присутствии катализатора, который находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или растворе. При гомогенном катализе, как и при гетерогенном, катализатор в реакции не расходуется, однако является ее необходимым участником; без катализатора реакция протекает гораздо медленнее или не идет вовсе.
Механизм гомогенно-каталитических реакций. Можно выделить сравнительно небольшую группу процессов, в которых участие катализатора не связано с образованием определенного химического соединения с субстратом. К таким процессам относится, например, катализ парамагнитными частицами синглет-триплетного превращения карбенов (изменяется электронный спин молекулы) или орто-, пара-превращение Н2 (изменяется ядерный спин). Формально к гомогенному катализу можно отнести газофазные реакции рекомбинации атомов и простейших радикалов в присутствии химически инертных частиц, которые, участвуя в тройном соударении, обеспечивают отвод энергии, выделяющейся при образовании химической связи. Однако в огромном большинстве случаев механизм гомогенного, как и гетерогенного катализа, включает более или менее сложное химическое превращение катализатора в реакциях.
Рассмотрим в качестве примера гомогенный катализ окислительно-восстановительной некомплементарной реакции, такой реакции, в которой число электронов. отдаваемых одной частицей восстановителя и принимаемых одной частицей окислителя, не совпадает. В реакции 2Се 4+ + Tl + -> 2Се 3 + + Tl 3+ последовательное одноэлектронное окисление Т1 +

затруднено из-за высокого окислительно-восстановительного потенциала пары Тl 2+ /Тl + (для пары Тl 3+ /Тl 2+ этот потенциал значительно ниже). В присутствии ионов марганца реакция протекает по многостадийному механизму:

Ионы марганца переводят одноэлектронный перенос в реакциях Мn 2+ и Мn 3 с Се 4 + в двухэлектронный - в реакции Мn 4+ с Тl + (все реакции с участием ионов Мn комплементарны). Протекание всех стадий облегчается из-за того, что для пар Мn 4+ Mn 3+ и Mn 3+ /Mn 2+ окислительно-восстановительные потенциалы близки и расположены между значениями этих потенциалов для пар Се 4+ /Се 3+ и Тl 3+ /Тl + .
В радикально-цепных процессах в присутствии некоторых веществ может ускоряться образование радикалов в реакциях зарождения или разветвления цепи. Так, при окислении органического вещества RH в присутствии ионов Со в небольшой концентрации ускоряется разветвление цепи, а при высокой концентрации этих же ионов - также и развитие цепи. Каталитический механизм распада гидропероксида включает следующие стадии:

Развитие цепи каталитически ускоряется по схеме:

Эта же реакция может дополнительно ускоряться в присутствии ионов Вr - , которые играют роль сокатализатора:

В кислотно-основном гомогенный катализ под действием катализатора обычно усиливаются электрофильные или нуклеофльные свойства молекул реагентов. Кислоты и основания, ускоряющие такие реакции, могут служить катализаторами в недиссоциированной форме (общий кислотно-основной катализ) либо воздействовать на субстрат ионами Н3О + и ОН - (специфич. кислотно-основной катализ). Например, при кислотном гидролизе сложных эфиров каталитическое действие кислоты НА связано с протонированием карбонильной группы, что облегчает последующее присоединение воды.

При гетеролитическом присоединении по кратным связям молекулы AD (А-акцепторная, D-донорная часть молекулы) катализатором может быть более сильный, чем AD, акцептор (электрофил) А или донор (нуклеофил) D. Например, при гидратировании олефинов кислота Н + служит катализатором, так как облегчает последующее взаимодействие с водой:

При присоединении Сl2 или НСl катализатором м. б. ион Сl - :

Апротонные кислоты могут катализировать гетеролитические реакции непосредственно или образуя сильную протонную кислоту, если в системе присутствует вода или другая слабая протонная кислота. В реакции Фриделя - Крафтса (алкилирование ароматических соединений) катализатором служит АlС13, усиливающий электрофильные свойства алкильной группы в алкилгалогениде RC1:

Особенно высокой каталитической активностью в гетеролитических реакциях обладают так называемые бифункциональные катализаторы - соединения, молекулы которых включают как акцепторную, так и донорную группы. Реакция в этом случае идет через циклическое переходное состояние. Так, 2-гидроксипиридин - хороший катализатор мутаротации глюкозы вследствие одновременного участия в реакции донорного атома N и акцепторной группы ОН гидроксипиридина. Активность 2-гидроксипиридина существенно выше, чем эквивалентной смеси пиридина и фенола, взятых в тех же концентрациях. Усиление каталитического эффекта по сравнению с монофункциональными катализаторами определяется прежде всего энтропийным фактором-уменьшением числа частиц, образующих активированный комплекс.
В металлокомплексном гомогенный катализ реакции ускоряются в присутствии комплексных соединений Ti, Fe, Cu, Pt и других переходных металлов, которые способны к образованию комплексов с молекулами субстратов. Каталитическая активность может быть обусловлена следующими факторами: 1) пространственной близостью молекул субстратов, входящих как лиганды в координационную сферу металла, 2) ослаблением химических связей в молекулах субстратов и снижением энергии активации при их разрыве; 3) усилением вследствие электронных эффектов донорных или акцепторных свойств молекул субстратов, входящих в металлокомплекс; 4) снятием запретов по симметрии молекулярных орбиталей благодаря участию d-орбиталей металлов; 5) возможностью многоэлектронных реакций с использованием d-электронов переходных металлов в некомплементарных окислительных-восстановительных реакциях с субстратами, для которых последовательное одноэлектронное окисление или восстановление термодинамически затруднено. Комплексы переходных металлов, кроме того, иногда облегчают образование свободных радикалов, что обеспечивает возможность катализа радикальных и радикально-цепных реакций. Металлокомплексные соединения катализируют гидрирование, окисление, полимеризацию, карбонилирование олефинов и ацетиленов, фиксацию азота, диспропорционирование олефинов, активацию и различные реакции алканов и др. Типичный механизм металлокомплексного гомогенный катализ рассмотрен на примере каталитического гидрирования олефинов. Он включает стадии окислительного присоединения Н2 (1), образование комплекса с олефином (2), внедрение молекулы олефина по связи М—Н (3), восстановительное отщепление алкана (4):

Таким образом, во всех типах гомогенного катализа катализатор, как правило, обеспечивает новый химический механизм процесса. Каталитические реакции происходят в несколько стадий, в одной из которых частица катализатора входит в каталитический цикл, а в другой выделяется в свободном состоянии, чтобы вновь участвовать в реакции. В этом смысле гомогенно-каталитические реакции подобны цепным; их принципиальное отличие заключается в том, что в цепных реакциях скорость образования продукта больше скорости образования активного центра (скорости инициирования цепи) в v раз (v - длина цепи), тогда как в каталитических процессах скорость образования активного центра катализатора больше скорости образования продукта или этот активный центр присутствует в системе заранее.
Кинетика гомогенно-каталитических реакций определяется их механизмом.
Практическое применение. Гомогенный катализ используют для промышленного получения: спиртов - гидратацией олефинов в присутствии кислот (H2SO4, H3PO4); нитробензола и других нитросоединений - нитрованием ароматических соединений в присутствии H2SO4; уксусной кислоты - карбонилированием метанола в присутствии комплексов Rh (сокатализатор-HI); терефталевой кислоты - окислением п-ксилола в присутствии солей Со; альдегидов – гидроформилированием олефинов в присутствии карбонилов Со; лекарств, например L-ДОФА, - энантиоселективным гидрированием аминокислоты в присутствии комплекса Rh с хиральными лигандами и др. Многие реакции с участием металлокомплексных соединений по высокой регио- и стереоселективности приближаются к реакциям ферментативного катализа. Использование принципов действия ферментов позволяет разрабатывать принципиально новые гомогенно-каталитические процессы.
Читайте также:

