Гликолиз путь эмбдена мейергофа парнаса кратко
Обновлено: 05.07.2024
Глико;лиз (фосфотриозный путь, или шунт Эмбдена — Мейерхофа, или путь Эмбдена-Мейергофа-Парнаса ) — ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных
Портал Проза.ру предоставляет авторам возможность свободной публикации своих литературных произведений в сети Интернет на основании пользовательского договора. Все авторские права на произведения принадлежат авторам и охраняются законом. Перепечатка произведений возможна только с согласия его автора, к которому вы можете обратиться на его авторской странице. Ответственность за тексты произведений авторы несут самостоятельно на основании правил публикации и законодательства Российской Федерации. Данные пользователей обрабатываются на основании Политики обработки персональных данных. Вы также можете посмотреть более подробную информацию о портале и связаться с администрацией.
© Все права принадлежат авторам, 2000-2022. Портал работает под эгидой Российского союза писателей. 18+
Катаболизм углеводов у бактерий. Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
В качестве источника питания и энергии при выращивании в искусственных условиях бакте рии наиболее часто используют углеводы. Способность утилизировать различные углеводы -важный диагностический признак. Базовый субстрат — глюкоза, которую бактерии разла гают в процессе дыхания либо брожения. Многие реакции катаболизма глюкозы протекают одинаково у аэробных и анаэробных бактерий, в частности три пути превращения гексоз в триозы (гликолиз, пентозофосфатный путь и путь Энтнера-Дудорова).
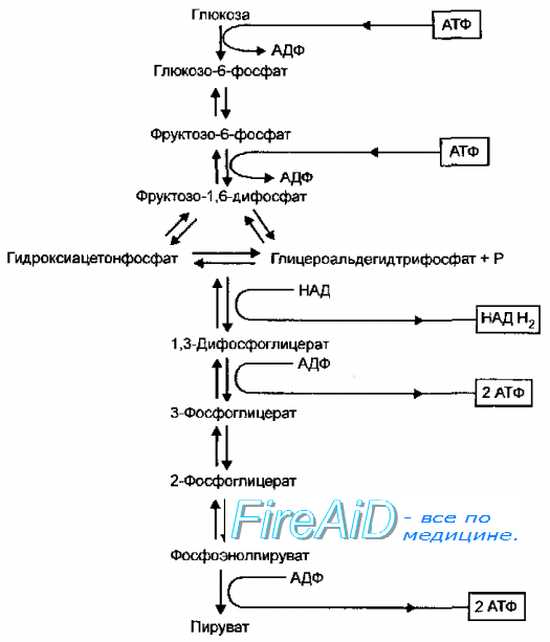
Рис. 4-8. Гликолиз (путь Эмбдена-Мейерхофа-Парнаса)
Гликолиз. Гликолитический путь окисления. Путь Эмбдена-Мейерхофа-Парнаса.
Гликолитический путь (гликолиз, путь Эмбдена-Мейерхофа-Парнаса, фруктозо-1,6-дифосфатный путь) доминирует у большинства аэробных и анаэробных микроорганизмов — кишечной палочки, бацилл, пенициллов, дрожжей, стрептомицетов и многих других. Характерная реакция гликолиза — расщепление фруктозо-1,6-дифосфата альдолазой, в результате чего образуется смесь триозофосфатов, состоящая из дигидрооксиацетонфосфата и глицероальдегидтрифосфата, которые затем превращаются в пируват (рис. 4-8). Фермент обратной связи, лимитирующий скорость процесса, — фруктозо-6-фосфат дегидрогеназа (фосфофруктокиназа). В этом процессе образуется 2 моля АТФ и 2 моля восстановленного НАД (НАДН+ на 1 моль глюкозы.
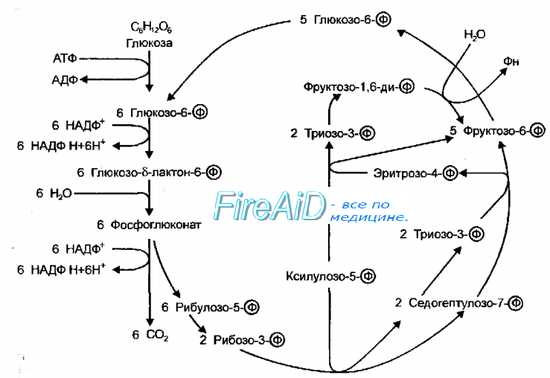
Рис. 4-9. Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Пентозофосфатный путь окисления. Схема Варбурга-Диккенса-Хореккера-Рэкера.
Пентозофосфатный путь (схема Варбурга-Диккенса-Хореккера-Рэкера, фосфоглюконатный путь) включает не только образование пентозофосфатов, но и реакции превращения пентозофосфатов в триозо-3-фосфаты (рис. 4-9). В результате изомеризации фруктозо-6-фосфата в глюкозо-6-фосфат и конденсации двух молекул триозо-3-фосфата в гексозофосфат все перечисленные реакции замыкаются в цикл, при одном обороте которого из 3 молекул глюкозо-6-фосфата образуются 2 молекулы фруктозо-6-фосфата, одна молекула триозо-3-фосфата, 3 молекулы С02 и трижды по 2 восстановленных НАДФ (НАДФН+). Последовательность подобных превращений глюкозы у бактерий идентична таковой у высших организмов. Этот путь катаболизма глюкозы следует рассматривать как второстепенный, но имеющий специальное назначение — источник пентоз для синтеза нуклеиновых кислот, а также источник восстановительных эквивалентов НАДФН+.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Глико́лиз (фосфотриозный путь, или шунт Эмбдена — Мейерхофа, или путь Эмбдена-Мейергофа-Парнаса ) — ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных.
Содержание
Общий обзор
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Гликолиз — один из древнейших метаболических процессов, известный почти у всех живых организмов. Предположительно гликолиз появился более 3,5 млрд лет назад у первичных прокариотов.
Локализация
В клетках эукариотических организмов десять ферментов, катализирующих распад глюкозы до ПВК, находятся в цитозоле, все остальные ферменты, имеющие отношение к энергетическому обмену, — в митохондриях и хлоропластах. Поступление глюкозы в клетку осуществляется двумя путями: натрий-зависимый симпорт (преимущественно для энтероцитов и эпителия почечных канальцев) и облегчённая диффузия глюкозы с помощью белков-переносчиков. Работа этих белков-транспортёров контролируется гормонами и, в первую очередь, инсулином. Сильнее всего инсулин стимулирует транспорт глюкозы в мышцах и жировой ткани.
Результат
Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H.
Полное уравнение гликолиза имеет вид:
При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким:
Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ.
У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания — окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, — дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы.
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы — глюкозо-6-фосфат (Г-6-Ф):

Для протекания реакции необходимо наличие в среде ионов Mg 2+ , с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы — глюкокиназа — имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат (Ф-6-Ф):

Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.

Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:

В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:

Каждая молекула глицеральдегидфосфата окисляется НАД + в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата (6):

Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция 7) — образуется молекула АТФ:

Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно: фосфоглицеролмутаза образует 2-фосфоглицерат (8):

Енолаза образует фосфоенолпируват (9):

И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):

Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции 7 и 10, в которых и происходит к субстратное фосфорилирование АДФ.
Дальнейшее развитие
Окончательная судьба пирувата и НАД∙H, образованных в процессе гликолиза зависит от организма и условий внутри клетки, в особенности от наличия или отсутствия кислорода или других акцепторов электронов.
У анаэробных организмов пируват и НАД∙H далее подвергаются брожению. При молочнокислом брожении, например, у бактерий пируват под действием фермента лактатдегидрогеназы восстанавливается в молочную кислоту. У дрожжей сходным процессом является спиртовое брожение, где конечными продуктами будут этанол и углекислый газ. Известно также маслянокислое и лимоннокислое брожение.
Брожение имеет важное значение в пищевой промышленности.
У аэробов пируват как правило попадает в цикл трикарбоновых кислот (цикл Кребса), а НАД∙H в итоге окисляется кислородом на дыхательной цепи в митохондриях в процессе окислительного фосфорилирования.
Несмотря на то, что метаболизм человека преимущественно аэробный, в интенсивно работающих скелетных мышцах наблюдается анаэробное окисление. В условиях ограниченного доступа кислорода пируват превращается в молочную кислоту, как происходит при молочнокислом брожении у многих микроорганизмов:
ПВК + НАД∙Н + H + → лактат + НАД + .
Боли в мышцах, возникающие через некоторое время после непривычной интенсивной физической нагрузки, связаны с накоплением в них молочной кислоты.
Образование молочной кислоты является тупиковой ветвью метаболизма, но не является конечным продуктом обмена веществ. Под действием лактатдегидрогеназы молочная кислота окисляется снова, образуя пируват, который и участвует в дальнейших превращениях.
Регуляция гликолиза
Различают местную и общую регуляцию.
Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки.
Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм.
Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза.
Инсулин стимулирует гликолиз через:
- активацию гексокиназной реакции;
- стимуляцию фосфофруктокиназы;
- стимуляцию пируваткиназы.
Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами.
Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1), фосфофруктокиназой (3) и пируваткиназой (10) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза.
Регуляция гексокиназы
Гексокиназа ингибируется продуктом реакции — глюкозо-6-фосфатом, который аллостерически связывается с ферментом, изменяя его активность.
По причине того, что основная масса Г-6-Ф в клетке производится путём расщепления гликогена, гексокиназная реакция, по сути, для протекания гликолиза не является необходимой, и фосфорилирования глюкозы в регуляции гликолиза исключительной важности не имеет. Гексокиназная реакция является важным этапом регуляции концентрации глюкозы в крови и в клетке.
При фосфорилировании глюкоза теряет способность транспортироваться через мембрану молекулами-переносчиками, что создаёт условия для накопления её в клетке. Ингибирование гексокиназы Г-6-Ф ограничивает поступление глюкозы в клетку, предотвращая её чрезмерное накопление.
Глюкокиназа (IV изотип гексокиназы) печени не ингибируется глюкозо-6-фосфатом, и клетки печени продолжают накапливать глюкозу даже при высоком содержании Г-6-Ф, из которого в дальнейшем синтезируется гликоген. По сравнению с другими изотипами глюкокиназа отличается высоким значением константы Михаэлиса, то есть на полную мощность фермент работает только в условиях высокой концентрации глюкозы, которая бывает почти всегда после приёма пищи.
Глюкозо-6-фосфат может превращаться обратно в глюкозу при действии глюкозо-6-фосфатазы. Ферменты глюкокиназа и глюкозо-6-фосфатаза участвуют в поддержании нормальной концентрации глюкозы в крови.
Регуляция фосфофруктокиназы
Интенсивность протекания фосфофруктокиназной реакции решающим образом сказывается на всей пропускной способности гликолиза, а стимуляция фосфофруктокиназы считается наиболее важным этапом регуляции.
Фосфофруктокиназа (ФФК) — это тетрамерный фермент, существующий поочерёдно в двух конформационных состояниях (R и T), которые находятся в равновесии и попеременно переходят из одного в другое. АТФ является одновременно и субстратом, и аллостерическим ингибитором ФФК.
В каждой из субъединиц ФФК имеется по два центра связывания АТФ: субстратный сайт и сайт ингибирования. Субстратный сайт одинаково способен присоединять АТФ при любой конформации тетрамера. В то время как сайт ингибирования связывает АТФ исключительно, когда фермент находится в конформационном состоянии T. Другим субстратом ФФК является фруктозо-6-фосфат, который присоединяется к ферменту предпочтительно в R-состоянии. При высокой концентрации АТФ сайт ингибирования занимается, переходы между конформациями фермента становятся невозможными, и большинство молекул фермента оказываются стабилизированными в T-состоянии, неспособном присоединить Ф-6-Ф. Однако ингибирование фосфофруктокиназы АТФ подавляется АМФ, который присоединяется к R-конформациям фермента, стабилизируя таким образом состояние фермента для связывания Ф-6-Ф.
Наиболее важным же аллостерическим регулятором гликолиза и глюконеогенеза является фруктозо-2,6-бифосфат, который не является промежуточным звеном этих циклов. Фруктозо-2,6-бифосфат аллостерически активирует фосфофруктокиназу.
Синтез фруктозо-2,6-бифосфата катализируется особым бифункциональным ферментом — фосфофруктокиназой-2/фруктозо-2,6-бифосфатазой (ФФК-2/Ф-2,6-БФаза). В нефосфорилированной форме белок известен как фосфофруктокиназа-2 и имеет каталитическую активность по отношению к фруктозо-6-фосфату, синтезируя фруктозо-2-6-бифосфат. В результате чего значительно стимулируется активность ФФК и сильно ингибируется активность фруктозо-1,6-бифосфатазы. То есть при условии активности ФФК-2 равновесие этой реакции между гликолизом и глюконеогенезом смещается в сторону первого — синтезируется фруктозо-1,6-бифосфат.
В фосфорилированном виде бифункциональный фермент не обладает киназной активностью, а наоборот в его молекуле активируется сайт, который гидролизует Ф2,6БФ на Ф6Ф и неорганический фосфат. Метаболический эффект фосфорилирования бифункционального фермента состоит в том, что аллостерическая стимуляция ФФК прекращается, аллостерическое ингибирование Ф-1,6-БФазы ликвидируется и равновесие смещается в сторону глюконеогенеза. Продуцируется Ф6Ф и затем — глюкоза.
Взаимопревращения бифункционального фермента осуществляются цАМФ-зависимой протеинкиназой (ПК), которая в свою очередь регулируется циркулирующими в крови пептидными гормонами.
Когда в крови снижается концентрация глюкозы, тормозится также и образование инсулина, а выделение глюкагона напротив стимулируется, и его концентрация в крови резко повышается. Глюкагон (и другие контринсулярные гормоны) связываются с рецепторами плазматической мембраны клеток печени, вызывая активацию мембранной аденилатциклазы. Аденилатциклаза катализирует превращение АТФ в циклический АМФ. цАМФ связывается с регуляторной субъединицей протеинкиназы, вызывая высвобождение и активизацию её каталитических субъединиц, которые фосфорилирует ряд ферментов, включая и бифункциональную ФФК-2/Ф-2,6-БФазу. При этом в печени прекращается потребление глюкозы и активизируются глюконеогенез и гликогенолиз, восстанавливая нормогликемию.
Пируваткиназа
Следующим шагом, где осуществляется регуляция гликолиза, является последняя реакция — этап действия пируваткиназы. Для пируваткиназы также описан ряд изоферментов, имеющих особенности регуляции.
Печёночная пируваткиназа (L-тип) регулируется при фосфорилировании, аллстерическими эффекторами и путём регуляции экспрессии генов. Фермент ингибируется АТФ и ацетил-КоА и активируется фруктозо-1,6-бифосфатом. Ингибирование пируваткиназы АТФ происходит подобно действию АТФ на ФФК. Связывание АТФ с сайтом ингибирования фермента уменьшает его сродство к фосфоенолпирувату. Печёночная пируваткиназа фосфорилируется и ингибируется протеинкиназой, и таким образом также находится под гормональным контролем. Кроме того, активность печёночной пируваткиназы регулируется и количественно, то есть изменением уровня его синтеза. Это медленная, долговременная регуляция. Увеличение в рационе углеводов стимулирует экспрессию генов, кодирующих пируваткиназу, в результате уровень фермента в клетке повышается.
М-тип пируваткиназы, найденный в головном мозге, мышцах и других глюкозо-потребных тканях не регулируется протеинкиназой. Это принципиально в том, что метаболизм этих тканей определяется только внутренними потребностями и не зависит от уровня глюкозы в крови.
Мышечная пируваткиназа не подвержена внешним влияниям, таким как понижение уровня глюкозы в крови или выброс гормонов. Внеклеточные условия, которые приводят к фосфорилированию и ингибированию печёночного изофермента, не изменяют активность пируваткиназы М-типа. То есть интенсивность гликолиза в поперечнополосатой мускулатуре определяется только условиями внутри клетки и не зависит от общей регуляции.
Значение
Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
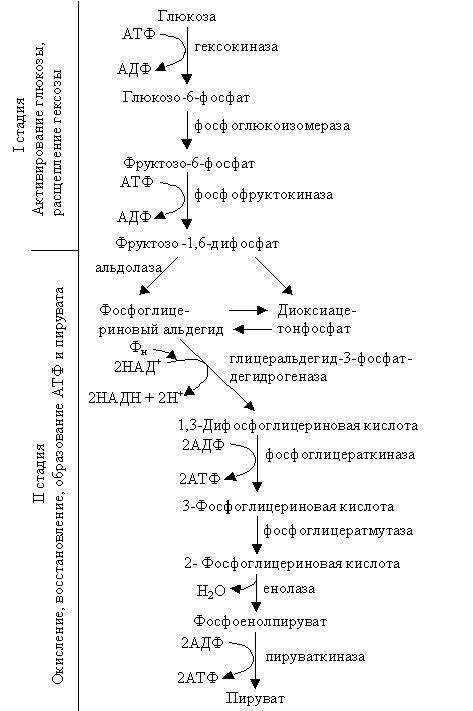
Путь Эмбдена – Мейергофа – Парнаса – это сумма последовательно происходящих биохимических реакций, в ходе которых глюкоза превращается в пировиноградную кислоту, а клетка обогащается энергией. Сначала гликолиз был установлен и изучен у животных. В настоящее время известно, что этот универсальный процесс присущ также растениям, грибам и бактериям. Этот процесс подразделяют на две стадии: 1) активирование и расщепление глюкозы; 2) окисление, восстановление и образование АТФ и пирувата (рис.3.1).

Рис. 3.1. Схема реакций гликолиза
Начинается гликолиз с активирования молекулы гексозы. Инертность последней доказывается ее присутствием во многих клетках. Активирование происходит за счет присоединения к молекуле глюкозы остатка фосфорной кислоты от АТФ. В результате реакции, происходящей при участии гексокиназы, глюкоза превращается в глюкозо-6-фосфат.
Таким образом, даже такой физиологический процесс, который обогащает в конечном итоге клетку энергией и способен выполнять работу, сам вначале требует энергии, т. е. связан с расходованием АТФ. Глюкозо-6-фосфат (Гл-6-Ф) и служит начальным материалом для дальнейших превращений, составляющих в зеленых растениях анаэробную фазу дыхания.
Однако, это не единственный путь использования Гл-6-Ф в растениях. При участии фосфоглюкомутазы Гл-6-Ф может превращаться в Гл-1-Ф. Из этого фосфорного эфира может в дальнейшем синтезироваться крахмал.
Таким образом, уже в самом начале дыхательных преобразований, на уровне образования Г-6-Ф, могут идти процессы, прямо противоположные конечным результатам: не запасание свободной энергии, а ее трата, не распад вещества, а его синтез.
Дальнейшее активирование глюкозы происходит путем преобразования Гл-6-Ф в фруктозу-6-фосфат (Фр-6-Ф). Реакция изомеризации идет при участии глюкозофосфатизомеразы.
Этот процесс можно рассматривать как физиологическую активацию.
Заканчивается активация молекулы глюкозы присоединением одного остатка фосфорной кислоты от АТФ и образованием очень неустойчивой молекулы фруктозо-1,6-дифосфата (Фр-1,6-ДФ).
В этой реакции принимает участие фосфофруктокиназа. На этом активация глюкозы заканчивается. В этих подготовительных реакциях гликолиза на каждую молекулу глюкозы затрачивается две молекулы АТФ. Нужно подчеркнуть высокую надежность этой стадии гликолиза, поскольку некоторое ее количество всегда присутствует в водной фазе клетки. Фонд свободной глюкозы может беспрерывно пополняться за счет гидролитического разрушения запасенных поли- и олигосахаров.
При участии альдолазы неустойчивая молекула Фр-1,6-ДФ распадается на две триозы (дихотомический путь): 3-фосфоглицириновый альдегид и диоксиацетонфосфат. Отметим, что соответствующие им нефосфорилированные триозы в свободной виде в клетке не обнаружены.
Альдолаза – очень распространенный фермент, который участвует в фотосинтезе, где он работает в обратном направлении: катализирует конденсацию фосфоглицеринового альдегида и фосфодиоксиацетона до фруктозо-6-фосфата.
Таким образом, фосфоглицериновый альдегид и диоксиацетонфосфат – промежуточные продукты и дыхания и фотосинтеза.
Молекула диоксиацетонфосфата затем превращается в молекулу фосфоглицеринового альдегида. Следовательно в процессе гликолиза образуются две молекулы фосфоглицеринового альдегида и поэтому дальнейшие гликолитические превращения идут с коэффициентом 2.
Образовавшийся 3-фосфоглицириновый альдегид окисляется до 1,3-дифосфоглицириновой кислоты под воздействием дегидрогеназы фосфоглицеринового альдегида, коферментом которой является НАД + . Суть данной реакции состоит в том, что альдегид окисляется до кислоты. Однако кислород в этой реакции не участвует. Окисление происходит в результате дегидрирования – потери водорода, который присоединяется к НАД + , в результате чего последний восстанавливается.
1,3-Дифосфоглицириновая кислота при участии фосфоглицераткиназы передает один фосфорный остаток АДФ и образуется АТФ и 3-фосфоглицириновая кислота (3-ФГК).
В данном случае наблюдается явление, которое называется в биоэнергетике сопряжением. Синтез АТФ из АДФ сопряжен с окислением альдозы до кислоты. Рассмотренный путь синтеза АТФ называется субстратным фосфорилированием.
Далее, 3-ФГК при воздействии фосфоглицератмутазы превращается в 2-фосфоглицириновую кислоту (2-ФГК).
Образовавшаяся 2-ФГК при участии енолазы (фосфопируватгидротаза) преобразуется в фосфоенолпируват, при этом молекула 2-ФГК отдает воду, а в остатке фосфорной кислоты возникает высокоэнергетическая связь.
Заканчивается гликолиз переносом фосфатной группы на АДФ и образованием пирувата. Реакцию катализирует пируваткиназа.
Все реакции, происходящие при гликолизе, можно представить в следующем виде:
2СН3СОСООН + 2НАДН + 2Н + + 2АТФ
Во время гликолиза – первой фазы дыхания при распаде молекулы глюкозы на две молекулы пирувата (ПВК) образуется 4 молекулы АТФ. Однако 2 молекулы АТФ используются вначале процесса для активации глюкозы, таким образом, в клетке запасаются только 2 молекулы АТФ. Одновременно на этой фазе дыхания при активации ФГА до ФГК образуются две молекулы НАДН.
Гликолиз происходит в гиалоплазме и ядре. Для него не нужен О2. Это анаэробная стадия дыхания.
В чем физиологический смысл гликолиза?
У аэробных организмов гликолиз является первым, подготовительным этапом дыхания. В процессе гликолиза происходит медленное выделение энергии, часть которой запасается в макроэргических связях синтезируемых молекул АТФ и может использоваться для работы клетки.
Гликолиз обеспечивает клетку промежуточными метаболитами, из которых могут синтезироваться нуклеиновые кислоты, белки, жиры и углеводы. Например, пировиноградная кислота может аминироваться с образованием аланина – аминокислоты необходимой для синтеза белков.
В какой-то степени гликолиз способен регулировать ход других физиологических процессов в клетке. Можно привести такой пример. Образование из каждой молекулы гексозы двух молекул триоз может увеличить осмотический потенциал вакуолярного сока, что повлияет, в свою очередь, на поступление воды в клетку.
Гликолиз – физиологически наиболее древний способ получения свободной энергии. Для своего осуществления ему не нужны специальные органеллы, и предполагают, что его реакции как-то связаны с мембранами ЭР.
Еще одной особенностью гликолиза является то, что его реакции образуют линейную последовательность, а не цикл, поэтому они менее саморегулируемы (нет обратной связи). Однако можно отметить три этапа регуляции гликолиза. Во-первых, на уровне гексокиназной реакции, активность которой Гл-6-Ф аллостерически подавляет активность фермента гексокиназы. Во-вторых, регулирование связано с фосфофроктокиназой, активность которой возрастает при повышении содержания АДФ и Фн, но подавляется повышенными концентрациями АТФ. В-третьих, этап регуляции осуществляется на уровне фермента пируваткиназы, активность которой угнетается ее продуктом АТФ в высоких концентрациях, а также ацетил-СоА.
Путь Эмбдена – Мейергофа – Парнаса – это сумма последовательно происходящих биохимических реакций, в ходе которых глюкоза превращается в пировиноградную кислоту, а клетка обогащается энергией. Сначала гликолиз был установлен и изучен у животных. В настоящее время известно, что этот универсальный процесс присущ также растениям, грибам и бактериям. Этот процесс подразделяют на две стадии: 1) активирование и расщепление глюкозы; 2) окисление, восстановление и образование АТФ и пирувата (рис.3.1).
 |
| Рис. 3.1. Схема реакций гликолиза |
Начинается гликолиз с активирования молекулы гексозы. Инертность последней доказывается ее присутствием во многих клетках. Активирование происходит за счет присоединения к молекуле глюкозы остатка фосфорной кислоты от АТФ. В результате реакции, происходящей при участии гексокиназы, глюкоза превращается в глюкозо-6-фосфат.
Таким образом, даже такой физиологический процесс, который обогащает в конечном итоге клетку энергией и способен выполнять работу, сам вначале требует энергии, т. е. связан с расходованием АТФ. Глюкозо-6-фосфат (Гл-6-Ф) и служит начальным материалом для дальнейших превращений, составляющих в зеленых растениях анаэробную фазу дыхания.
Однако, это не единственный путь использования Гл-6-Ф в растениях. При участии фосфоглюкомутазы Гл-6-Ф может превращаться в Гл-1-Ф. Из этого фосфорного эфира может в дальнейшем синтезироваться крахмал.
Таким образом, уже в самом начале дыхательных преобразований, на уровне образования Г-6-Ф, могут идти процессы, прямо противоположные конечным результатам: не запасание свободной энергии, а ее трата, не распад вещества, а его синтез.
Дальнейшее активирование глюкозы происходит путем преобразования Гл-6-Ф в фруктозу-6-фосфат (Фр-6-Ф). Реакция изомеризации идет при участии глюкозофосфатизомеразы.
Этот процесс можно рассматривать как физиологическую активацию.
Заканчивается активация молекулы глюкозы присоединением одного остатка фосфорной кислоты от АТФ и образованием очень неустойчивой молекулы фруктозо-1,6-дифосфата (Фр-1,6-ДФ).
В этой реакции принимает участие фосфофруктокиназа. На этом активация глюкозы заканчивается. В этих подготовительных реакциях гликолиза на каждую молекулу глюкозы затрачивается две молекулы АТФ. Нужно подчеркнуть высокую надежность этой стадии гликолиза, поскольку некоторое ее количество всегда присутствует в водной фазе клетки. Фонд свободной глюкозы может беспрерывно пополняться за счет гидролитического разрушения запасенных поли- и олигосахаров.
При участии альдолазы неустойчивая молекула Фр-1,6-ДФ распадается на две триозы (дихотомический путь): 3-фосфоглицириновый альдегид и диоксиацетонфосфат. Отметим, что соответствующие им нефосфорилированные триозы в свободной виде в клетке не обнаружены.
Альдолаза – очень распространенный фермент, который участвует в фотосинтезе, где он работает в обратном направлении: катализирует конденсацию фосфоглицеринового альдегида и фосфодиоксиацетона до фруктозо-6-фосфата.
Таким образом, фосфоглицериновый альдегид и диоксиацетонфосфат – промежуточные продукты и дыхания и фотосинтеза.
Молекула диоксиацетонфосфата затем превращается в молекулу фосфоглицеринового альдегида. Следовательно в процессе гликолиза образуются две молекулы фосфоглицеринового альдегида и поэтому дальнейшие гликолитические превращения идут с коэффициентом 2.
Образовавшийся 3-фосфоглицириновый альдегид окисляется до 1,3-дифосфоглицириновой кислоты под воздействием дегидрогеназы фосфоглицеринового альдегида, коферментом которой является НАД + . Суть данной реакции состоит в том, что альдегид окисляется до кислоты. Однако кислород в этой реакции не участвует. Окисление происходит в результате дегидрирования – потери водорода, который присоединяется к НАД + , в результате чего последний восстанавливается.
1,3-Дифосфоглицириновая кислота при участии фосфоглицераткиназы передает один фосфорный остаток АДФ и образуется АТФ и 3-фосфоглицириновая кислота (3-ФГК).
В данном случае наблюдается явление, которое называется в биоэнергетике сопряжением. Синтез АТФ из АДФ сопряжен с окислением альдозы до кислоты. Рассмотренный путь синтеза АТФ называется субстратным фосфорилированием.
Далее, 3-ФГК при воздействии фосфоглицератмутазы превращается в 2-фосфоглицириновую кислоту (2-ФГК).
Образовавшаяся 2-ФГК при участии енолазы (фосфопируватгидротаза) преобразуется в фосфоенолпируват, при этом молекула 2-ФГК отдает воду, а в остатке фосфорной кислоты возникает высокоэнергетическая связь.
Заканчивается гликолиз переносом фосфатной группы на АДФ и образованием пирувата. Реакцию катализирует пируваткиназа.
Все реакции, происходящие при гликолизе, можно представить в следующем виде:
2СН3СОСООН + 2НАДН + 2Н + + 2АТФ
Во время гликолиза – первой фазы дыхания при распаде молекулы глюкозы на две молекулы пирувата (ПВК) образуется 4 молекулы АТФ. Однако 2 молекулы АТФ используются вначале процесса для активации глюкозы, таким образом, в клетке запасаются только 2 молекулы АТФ. Одновременно на этой фазе дыхания при активации ФГА до ФГК образуются две молекулы НАДН.
Гликолиз происходит в гиалоплазме и ядре. Для него не нужен О2. Это анаэробная стадия дыхания.
В чем физиологический смысл гликолиза?
У аэробных организмов гликолиз является первым, подготовительным этапом дыхания. В процессе гликолиза происходит медленное выделение энергии, часть которой запасается в макроэргических связях синтезируемых молекул АТФ и может использоваться для работы клетки.
Гликолиз обеспечивает клетку промежуточными метаболитами, из которых могут синтезироваться нуклеиновые кислоты, белки, жиры и углеводы. Например, пировиноградная кислота может аминироваться с образованием аланина – аминокислоты необходимой для синтеза белков.
В какой-то степени гликолиз способен регулировать ход других физиологических процессов в клетке. Можно привести такой пример. Образование из каждой молекулы гексозы двух молекул триоз может увеличить осмотический потенциал вакуолярного сока, что повлияет, в свою очередь, на поступление воды в клетку.
Гликолиз – физиологически наиболее древний способ получения свободной энергии. Для своего осуществления ему не нужны специальные органеллы, и предполагают, что его реакции как-то связаны с мембранами ЭР.
Еще одной особенностью гликолиза является то, что его реакции образуют линейную последовательность, а не цикл, поэтому они менее саморегулируемы (нет обратной связи). Однако можно отметить три этапа регуляции гликолиза. Во-первых, на уровне гексокиназной реакции, активность которой Гл-6-Ф аллостерически подавляет активность фермента гексокиназы. Во-вторых, регулирование связано с фосфофроктокиназой, активность которой возрастает при повышении содержания АДФ и Фн, но подавляется повышенными концентрациями АТФ. В-третьих, этап регуляции осуществляется на уровне фермента пируваткиназы, активность которой угнетается ее продуктом АТФ в высоких концентрациях, а также ацетил-СоА.
Читайте также:

