Гидрофобность это в биологии кратко
Обновлено: 30.06.2024
Вода ( H 2 O ) — важнейшее неорганическое вещество клетки. Её содержание превышает содержание всех остальных химических соединений. Вода является главной частью цитоплазмы, она придаёт клетке объём, обеспечивает упругость, участвует во всех биохимических процессах. Все химические реакции происходят в водных растворах. Чем интенсивнее протекает в клетке обмен веществ, тем выше в ней содержание воды.
Вода заполняет пространства между клетками, она составляет основу клеточного сока в вакуолях. Транспорт веществ в живых организмах осуществляется в виде водных растворов.
Связи между атомами водорода и кислорода в молекуле воды полярные. Из-за большей электроотрицательности атома кислорода электроны общих электронных пар сдвинуты к нему. Поэтому на атоме кислорода имеется частичный отрицательный заряд, а на атомах водорода — частичные положительные заряды. Так как молекула воды имеет угловое строение, разные заряды в ней находятся у разных полюсов. Молекула полярная, она является диполем.
Полярные молекулы воды взаимодействуют между собой с образованием водородных связей, обуславливающих многие особенности физических и химических свойств вещества.

Вода — полярный растворитель , в ней растворяются другие полярные вещества. Такие вещества называют гидрофильными. К этой группе относятся многие соли, моно- и дисахариды, аминокислоты, минеральные кислоты. В растворённом состоянии молекулы или ионы веществ могут свободно двигаться, и они легче вступают в химические реакции.
Вещества, нерастворимые в воде, называются гидрофобными. К ним относятся жиры, многие белки и нуклеиновые кислоты. Гидрофобность некоторых веществ имеет важное значение для живых организмов (например, из таких веществ формируются клеточные мембраны)
У воды высокая теплоёмкость , т. е. способностью поглощать много тепла при незначительном возрастании собственной температуры. Высокая теплоёмкость сглаживает температурные колебания и защищает организмы от быстрого и сильного охлаждения или нагревания.
Вода имеет высокую теплоту парообразования , для её испарения необходима довольно большая энергия. Использование значительного количества энергии на разрыв водородных связей при испарении воды способствует её охлаждению. Это свойство воды предохраняет организмы от перегрева. Примеры: испарение воды листьями растений и выделение пота у животных.
У воды также высокая теплопроводность , которая обеспечивает быстрое распределение тепла по всему организму.
Вода не сжимается . Она создаёт тургорное давление и поддерживается упругость тканей и органов. У некоторых беспозвоночных (например, у круглых червей) полостная жидкость выполняет функцию гидростатического скелета.
У воды высокое поверхностное натяжение . Поэтому кровь движется по капиллярам у животных и поднимается по сосудам в растениях.
1. Вода является универсальным растворителем. Благодаря разной растворимости веществ в воде формируются плазматические мембраны.
2. Вода выполняет в живых организмах транспортную функцию. Вещества поступают в клетки и организмы, а также переносятся внутри них в виде водных растворов.
3. Вода участвует в биохимических реакциях, протекающих в клетке (гидролиз веществ), является источником кислорода и водорода при фотолизе в световую фазу фотосинтеза.
5. Вода является составной частью слизей, образующихся в органах дыхания и пищеварения, а также секретов некоторых желез и органов: пищеварительных соков, желчи, слюны, пота, слёз и т. д.

Обзор
Степень гидрофобности материала можно определять по углу смачивания, от которого зависит, будет ли вода растекаться по поверхности или собираться в капельки
Авторы
Редакторы
Водобоязнь
Так вот, гидрофобность, о которой пойдет речь, — это про свойства молекул, а не симптомы у людей.
. Так неужели гусь гидрофобнее фторопласта? Фактически так и есть, но достигается это за счет небольшой уловки: поверхность пера гуся (равно как и листа лотоса) не ровная, а покрытая микроскопическими пирамидками или волосками, что уменьшает площадь контакта с каплей и эффективную адгезию (рис. 1в) [1]. На этом же принципе основаны супергидрофобные поверхности, отталкивающие воду практически идеально (видео 1).

Видео 1. Супергидрофобная поверхность. Микромасштабная шероховатость поверхности (см. рис. 1б) снижает эффективную площадь контакта с каплей воды, которая в этом масштабе за счет поверхностного натяжения ведет себя подобно упругому телу.
Чтобы понять, почему одни вещества с удовольствием смачиваются водой, а с гуся она, как гласит пословица, скатывается, нужно опуститься на уровень отдельных молекул и рассмотреть, как молекулы взаимодействуют между собой.
Гидрофобные молекулы
С точки зрения химического строения гидрофобными (или, что то же самое, неполярными) являются молекулы, не содержащие химических групп, способных образовывать с водой водородные связи. Например, это бензол и другие жидкие углеводороды (составляющие бензина). Однако наиболее интересными свойствами обладают амфифильные молекулы, содержащие как полярную, так и неполярную части: это приводит к тому, что они образуют в смесях с водой довольно сложные структуры: мицеллы, везикулы, слои и более сложные формы. Образование всех этих сложных форм управляется гидрофобным эффектом.
Немного термодинамики
Самопроизвольные процессы в изолированной системе сопровождаются возрастанием энтропии.
Гидрофобный эффект с точки зрения статистической физики

[7] (б и в)
И впрямь, если рассматривать только масло, то покажется, что термодинамика не работает: растворение масляной пленки в толще жидкости явно увеличило бы энтропию по сравнению с монослоем. Но все знают, что на самом-то деле происходит все наоборот: даже если воду с маслом встряхнуть, эмульсия через какое-то время распадется, и масло опять образует пленку, покинув водную фазу.
Такое взаимодействие полярной и неполярной фаз носит название гидрофобного эффекта. Это явление заставляет молекулы детергентов образовывать в растворе мицеллы, липиды — формировать моно- и бислои. Последние могут замыкаться на себя с образованием пузырьков (липосом) или биологических мембран, окружающих клетку (рис. 3). Найдены и более сложные формы липидного полиморфизма, например кубическая липидная фаза, широко используемая в структурных исследованиях мембранных белков.

Рисунок 3. Липидный полиморфизм. В зависимости от формы и других свойств молекулы, характеризующих несимметричное строение головки и хвоста, липиды образуют различные надмолекулярные структуры. Сверху вниз: 1 — при обратной конической форме молекулы образуются структуры с положительной кривизной (мицеллы и гексагональная фаза HI); 2 — цилиндрическая форма дает плоские (ламеллярные) структуры, такие как бислои; 3 — при конической форме образуются кубическая фаза и обращенные гексагональная (HII) и мицеллярная фазы.
В случае биологических молекул гидрофобный эффект играет особую роль, поскольку он формирует биомембраны, без которых невозможна жизнь [3], а также вносит определяющий (до 90% всей работы) вклад в сворачивание белковых молекул, боковые цепи аминокислотных остатков которых могут иметь различную природу: гидрофобную или гидрофильную. Наличие столь разных сущностей в пределах одной линейной молекулы дает все разнообразие форм и выполняемых функций, которое наблюдается у белков.


Роль гидрофобного эффекта в фолдинге белка
Фолдингом (сворачиванием) белка называют процесс обретения полипептидной цепью присущей ей трехмерной конформации (нативной формы). Общепринятые представления о физике белка говорят, что нативная конформация обладает наименьшей свободной энергией среди потенциально возможных, благодаря чему этот процесс является самопроизвольным. Несмотря на то, что фолдинг направляется совокупностью, вроде бы, хорошо изученных физических законов, промоделировать его на компьютере пока что в общем случае невозможно . Не в последнюю очередь — благодаря гидрофобному эффекту, который играет в процессе сворачивания цепочки решающую роль, но при этом не сводится к суммированию парных взаимодействий, на чем основаны современные методы эмпирических силовых полей [10], [15].
Сворачивание гомо- и гетерополимеров можно разделить на несколько стадий (рис. 6):

Рисунок 6. Роль гидрофобного коллапса в сворачивании трех полимерных цепей с различной гидрофобностью составляющих мономеров: гидрофобного полимера, гидрофобно-гидрофильного сополимера и глобулярного белка (сверху вниз) — отложена свободная энергия в зависимости от радиуса гирации, показывающего компактность упаковки цепи. 1) Любая линейная цепочка из полностью растянутого состояние быстро скручивается в статистический клубок. 2) Пространственная близость неполярных боковых цепей приводит к гидрофобному коллапсу клубка и образованию расплавленной глобулы. 3) В случае белков эволюционно подобранные специфические контакты между боковыми цепями сближенных аминокислотных остатков (такие как водородные связи или электростатические взаимодействия) дополнительно снижают свободную энергию и упаковывают белок до плотной глобулы. Гидрофобные полимеры не имеют таких взаимодействий, и поэтому их сворачивание останавливается на стадии статистического клубка.
Раньше считалось, что третья стадия является непременным признаком функционального белка, однако в последнее время все больше внимания уделяется так называемым недоупорядоченным белкам (intrinsically disordered proteins), у которых отсутствует четко заданная пространственная форма, и фактически нету стадии образования специфических контактов. (Кстати, доля гидрофобных остатков в них существенно меньше по сравнению с глобулярными белками.) Возможно, это позволяет им взаимодействовать в живой клетке не с одним белком или лигандом, а с десятками или даже сотнями структурно различных молекул-партнеров, принимая участие в весьма тонкой регуляции клеточных процессов [16], [17].
Определяющую роль гидрофобный эффект играет и в фолдинге мембранных белков (МБ), исполняющих множество жизненно-важных функций от транспорта молекул и ионов через мембрану до рецепции и распознавания клетками друг друга. В связи с тем, что бóльшая их часть погружена в гидрофобный бислой мембраны, строение трансмембранного (ТМ) домена существенно отличается от упаковки растворимых глобулярных белков: ТМ-сегменты у них существенно гидрофобнее, причем гидрофобные боковые цепи находятся не только внутри белка (как в случае глобулярных белков), но и на поверхности, где белок контактирует с углеводородными цепями липидных молекул.
Как рассчитать гидрофобность теоретически?
Однако хотя бы примерная оценка гидрофобных и гидрофильных свойств молекул все же востребована в молекулярном моделировании и его приложениях (например, биотехнологических или индустриальных). Обычно здесь ориентируются на характеристику, описывающую гидрофобность молекулы целиком — коэффициент распределения (P, от partitioning) этого вещества между водой (полярной фазой) и неполярной фазой (например, бензолом или н-октанолом). Дело в том, что этот параметр, в отличие от всех остальных термодинамических характеристик, довольно просто померить экспериментально, определив концентрацию изучаемого вещества в воде и неполярной среде (которые, как мы помним, почти не смешиваются) и разделив одно на другое. За коэффициент гидрофобности принимают логарифм этого коэффициента — logP.


Учет гидрофобных свойств биомолекул находит применение и в других областях молекулярного моделирования — в частности, при предсказании положения в аминокислотной последовательности трансмембранных участков или уточнении пространственной структуры комплексов рецептор—лиганд на основе принципа гидрофобного соответствия.
Несмотря на сложную физическую природу феномена гидрофобности, даже весьма поверхностный его учет в молекулярном моделировании может принести пользу. Из приведенного примера видно, что пространственное картирование свойств молекул, рассчитанное с помощью методики МГП, позволяет провести связь между структурой молекулы пептида и его активностью, а это является давней мечтой химиков, биологов и фармакологов. Умение находить такую связь обозначает возможность рационально конструировать требуемые свойства в молекулах, что, безусловно, востребовано и в фундаментальных исследованиях, и в биотехнологиях, и в медицине [24].
И снова слово о воде
гидрофобные (от гидро… и греч. pholos — боязнь, страх) - отталкивающиеся от воды, образуют с водой поверхности раздела
гидрофильные (от гидро… и греч. philia—любовь) - притягивающиеся к воде.
Гидрофильность, гидрофобность — характеристики интенсивности молекулярного взаимодействия поверхности тел с водой. Понятие гидрофильность, гидрофобность относится не только к телам, у которых оно является свойством поверхности, но и к отдельным молекулам, их группам, атомам, ионам. Гидрофильностью (хорошей смачиваемостью водой) обладают вещества с ионными кристаллическими решётками (оксиды, гидроксиды, силикаты, сульфаты, фосфаты, глины и т. д.) , вещества с полярными группами —ОН, —СООН, —NO2 и др. Гидрофобностью (плохой смачиваемостью) обладают большинство органических веществ с углеводородными радикалами, металлы, полупроводники и т. д. Гидрофильность, гидрофобность являются частным случаем отношения веществ к растворителю — лиофильности, лиофобности.
гидрофобные-те которые ни при каках условиях с водой не реагируют, а гидрофильные- наоборот все время наровят присоединить к себе воду
первые - растения, неадекватно реагирующие на влажную среду; вторые - равносильно замечательно живут и при засухе и во влажных уславиях. Употребляются эти прилагательные только для описания жизнедеятельности растений. У животных - другие названия
ГИДРОФИЛЬНОСТЬ И ГИДРОФОБНОСТЬ, понятия, характеризующие сродство веществ или образованных ими тел к воде; это сродство обусловлено силами межмолекулярного взаимодействия. Слова ;гидрофильный; и ;гидрофобный; могут относиться в равной степени к веществу, к поверхности тела и к тонкому (в пределе - толщиной в одну молекулу) слою на границе раздела фаз (тел) . Г. и г. - частный случай лиофилъности и лио-фобности - характеристик молекулярного взаимодействия веществ с различными жидкостями.
Общей мерой гидрофильное служит энергия связи молекул воды с поверхностью тела; её можно определить по теплоте смачивания, если вещество данного тела нерастворимо. Гидрофобность следует рассматривать как малую степень гидрофильности, т. к. между молекулами воды и любого тела всегда будут действовать в большей или меньшей степени межмолекулярные силы притяжения. Г. и г. можно оценить по растеканию капли воды на гладкой поверхности тела. На гидрофильной поверхности капля растекается полностью, а на гидрофобной - частично, причём величина угла между поверхностями капли и смачиваемого тела зависит от того, насколько данное тело гидро-фобно. Гидрофильны все тела, в которых интенсивность молекулярных (атомных, ионных) взаимодействий достаточно велика. Особенно резко выражена гидрофильность минералов с ионными кристаллич. решётками (напр. , карбонатов, силикатов, сульфатов, глин и др.) , а также силикатных стёкол. Гид-рофобны металлы, лишённые окисных плёнок, органич. соединения с преобладанием углеводородных групп в молекуле (напр. , парафины, жиры, вески, нек-рые пластмассы) , графит, сера и др. вещества со слабым межмолекулярным взаимодействием .
Понятия Г. и г. применимы не только к телам или их поверхностям, но и к единичным молекулам или отд. частям молекул. Так, в молекулах поверхностно-активных веществ различают гидрофильные (полярные) и гидрофобные (углеводородные) группы. Гидрофильность поверхности тела может резко измениться в результате адсорбции таких веществ.
Повышение гидрофильности наз. гидрофилизацией, а понижение - гидрофобизацией. Оба эти явления играют важную роль при обогащении руд методом флотации. В текст, технологии гидрофилизация тканей (волокон) необходима для успешного крашения, беления, стирки и т. д. , а гидрофо-бизация - для придания тканям водостойкости и непромокаемости.
Извиняюсь что простыми словами обьяснить не получилось, но если перечитать пару раз то всё понятно.. .
Задумайтесь! Мы с вами состоит из миллиардов атомов. Все атомы находятся в круговороте, и все атомы, которыми мы обладаем, в ком-то и где-то находились те 4,5 млрд. лет, которые существует Земля. Они были частями животных, растений, грибов и бактерий - а сейчас принадлежат нам на короткое время.

С химической точки зрения ответ на вопрос "Жив ли изучаемый объект?" - не представляется возможным. Понятию "жизнь" дано колоссальное количество определений. Жизнь - это самовоспроизведение с изменением, способ существования белковых тел, постоянный обмен веществ с внешней средой.
Мы приступаем к изучению неорганических и органических веществ клетки. Начнем с неотъемлемого компонента клетки, благодаря которому жизнь на Земле в принципе стала возможна - вода.
Составляет 60-80% массы клетки. Молекула воды обладает уникальным свойством - полярностью, которое возникает из-за разницы в электроотрицательности (ЭО) между атомами кислорода и водорода (у кислорода ЭО больше).

Поскольку молекула воды полярна, ее называют диполь. Между молекулами воды возникают непрочные водородные связи: водородная связь начинается от отрицательно заряженного атома кислорода (2δ - ) одной молекулы воды и тянется до положительно заряженного атома водорода другой молекулы воды (δ + )
- Гидрофильные (греч. hydro - вода и philéo - люблю) - вещества, которые хорошо растворяются в воде. Гидрофильными веществами являются сахара, соли, альдегиды, спирты, аминокислоты.
- Гидрофобные (греч. hydro - вода и phobos — страх) - вещества, которые не растворяются в воде. Гидрофобными веществами являются жиры.
-
Вода - универсальный растворитель
Большинство реакций, которые протекают в клетке, идут в растворе (водной среде). Полярность молекулы воды позволяет ей быть отличным растворителем для других гидрофильных (полярных) веществ.
Вода может поглощать теплоту при минимальном изменении температуры. Это настоящее "спасение" для клеток: чуть только температура меняется, вода начинает поглощать избыток тепла, защищая клетку от перегревания. Выделяясь на поверхность кожи с потом, вода испаряется, поверхность кожи при этом охлаждается.
Она не только создает среду для реакций в клетке, но и сама активно участвует во многих из них. Расщепление питательных веществ, попавших в клетку, происходит за счет реакции гидролиза (греч. hydro - вода и lysis - расщепление).
Питательные вещества, газы перемещаются по организму с током крови. Вода составляет 90-92% плазмы крови, является ее основным компонентом. С помощью воды происходит не только доставка веществ к клеткам, но и удаление из организма побочных продуктов обмена веществ.

Вода придает тканям тургор (лат. turgor — наполнение) - внутреннее осмотическое давление в живой клетке, создающее напряжение оболочек клеток. Вода составляет от 60 до 95% цитоплазмы, придает клеткам форму. Изменение тургора клеток растений приводит к перемещениям их частей, раскрытию устьиц, цветков.
Осмотическое давление - избыточное гидростатическое давление на раствор, отделенный от чистого растворителя с помощью полупроницаемой мембраны.
Главное - понимать суть: если мы поместим живую клетку в гипертонический раствор, то вода (растворитель) устремится из клетки в раствор (в сторону большей концентрации соли) - это приведет к сморщиванию клеток.
Если же клетка окажется в гипотоническом растворе, то вода извне устремится внутрь клетки (опять-таки в сторону большей концентрации солей), приводя при этом к разбуханию (и возможному разрыву) клетки.

Элементы
Процентное содержание элемента не коррелирует с его важностью и биологической значимостью. Так, к примеру, микроэлемент I играет важную роль в синтезе гормонов щитовидной железы: тироксина, трийодтиронина. За нормальные рост и развитие организмов отвечают Zn, Mn, Cu.
Благоприятно влияют на сперматозоиды Zn, Ca, Mg, защищая их от оксидативного стресса (окисления). Невозможным становится нормальное образование эритроцитов без должного уровня Fe и Cu.

В водной среде клетки соли диссоциируют (распадаются) на положительно заряженные ионы - катионы (Na + , K + , Ca 2+ , Mg 2+ ) и отрицательно заряженные - анионы (Cl - , SO4 2- , HPO4 2- , H2PO4 - ).
Для процессов возбуждения клетки (нейрона, миоцита - мышечной клетки) внутри клетки должна поддерживаться низкая концентрация ионов Na + и высокая концентрация ионов K + . В окружающей клетку среде все наоборот: много Na и мало K. В мембране существует специальный натрий-калиевый насос, который поддерживает необходимое равновесие. Если это соотношение нарушится, то нейрон не сможет сгенерировать нервный импульс, а клетка мышцы - сократиться.
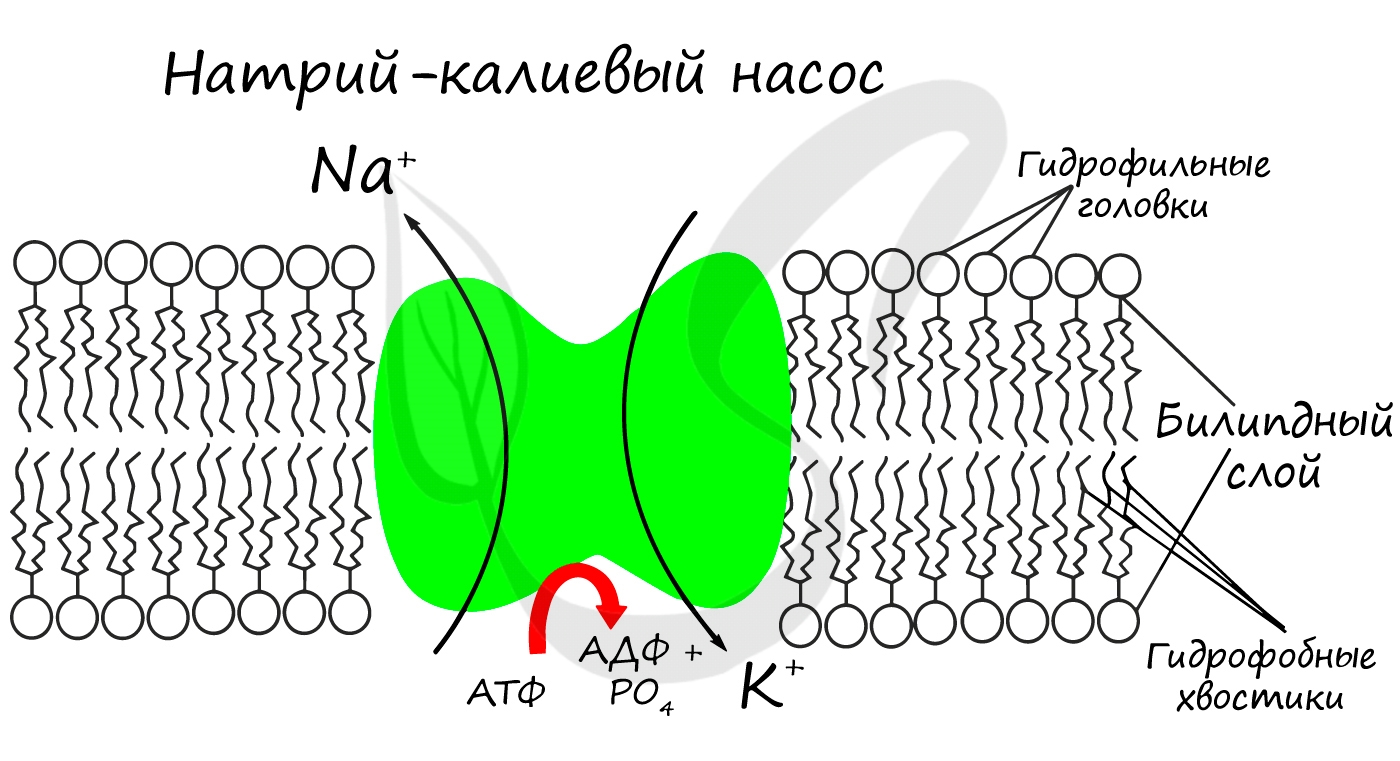
- Участвуют в активации ферментов
- Создают буферные системы (бикарбонтаную, фосфатную, белковую)
- Поддерживают кислотно-щелочное состояние (КЩС)
- Создают осмотическое давление клетки
- Создают мембранный потенциал клеток (натрий-калиевый насос)
- Являются основным минеральным составляющим скелета внутреннего и наружного (у моллюсков)

Мы переходим к органическим компонентам клетки, к которым относятся: жиры, углеводы, белки и нуклеиновые кислоты.
Белки, или пептиды (греч. πεπτος - питательный)
Белки - полимеры, мономерами которых являются аминокислоты. Белки представляют линейную структуру, образованную из длинной цепи аминокислот, между которыми возникают пептидные связи. Пептидная связь образуется между карбоксильной группой (COOH) одной аминокислоты и аминогруппой другой аминокислоты (NH2).
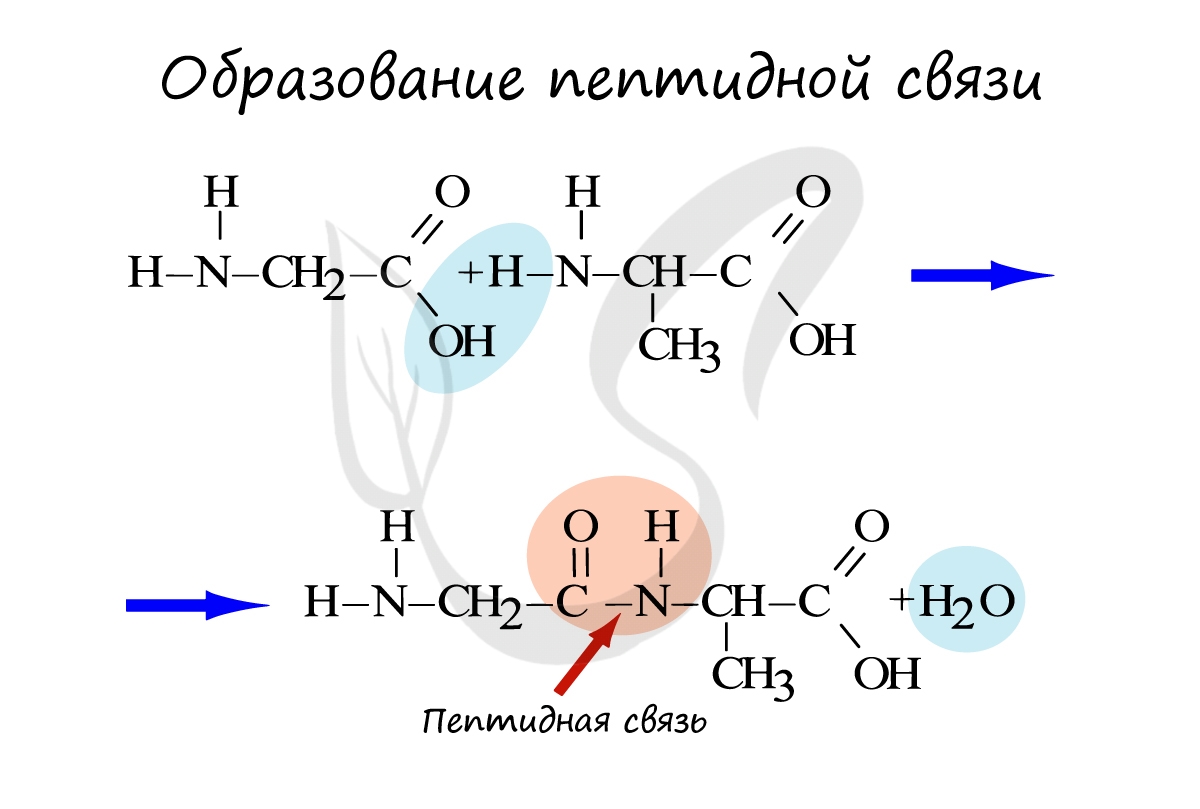
Между понятиями пептиды и белки существует определенная разница. Белки состоят из сотен тысяч аминокислот. Пептидами называют небольшие белки, содержащие до 10 аминокислот. Ими являются некоторые гормоны: окситоцин, вазопрессин, тиреолиберин - эти пептиды выполняют регуляторную функцию.
- Первичная - полипептидная цепь, в которой аминокислоты расположены линейно
- Вторичная - полипептидная цепь закручивается в спираль, формируется α или β структура
- Третичная - спирали скручиваются в глобулу (лат. globulus - шарик)
- Четвертичная - образуется у сложных белков путем соединения нескольких глобул

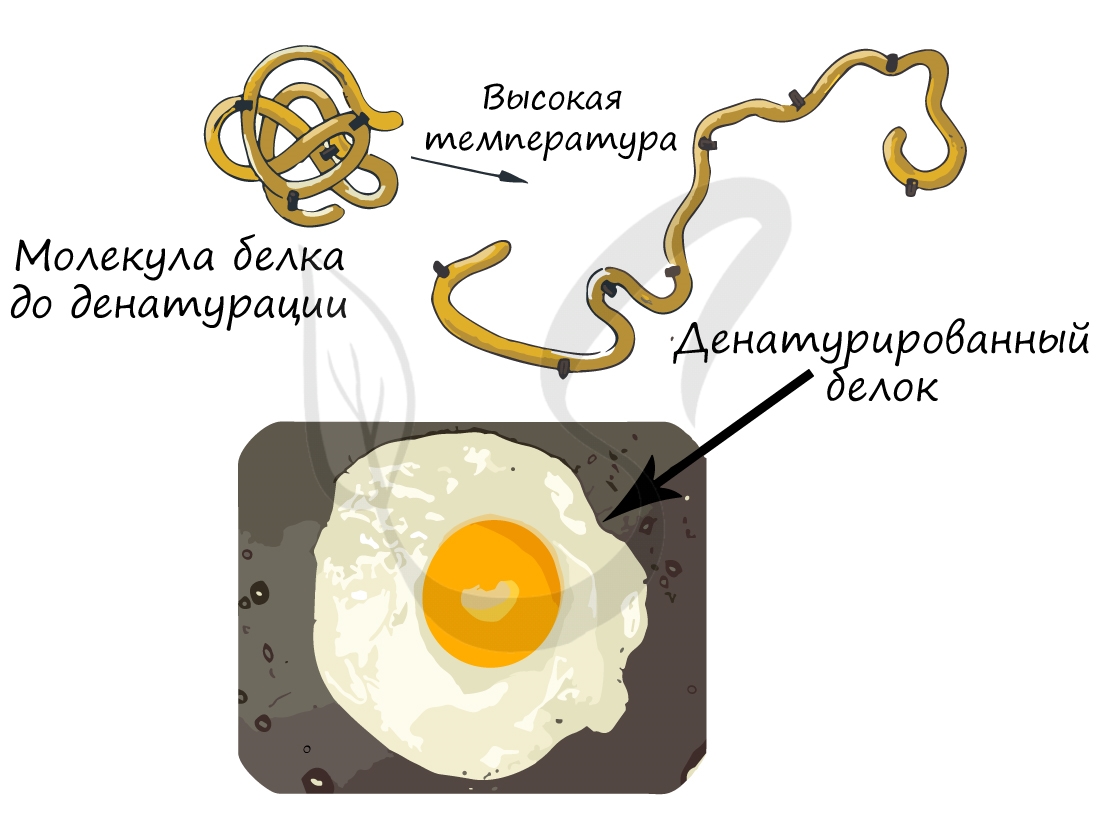
При резком изменении оптимальных для белка условий он подвергается денатурации: при этом происходит переход от высших структур организации к низшим, или "раскручивание белка". Важно заметить, что аминокислотная последовательность (первичная структура белка) при этом не меняется, однако свойства белка меняются кардинально (теряется его гидрофильность).
Осмелюсь сделать заявление: вы часто начинаете свой день с денатурации белка. Простейший способ провести такой эксперимент - пожарить яичницу. Заметьте, что изначально яичный белок прозрачный и текучий, но по итогу жарки эти свойства утрачиваются: он становится непрозрачным и вязким.
-
Каталитическая (греч. katalysis - разрушение)
Белки - природные катализаторы, ускоряющие реакции в организме в десятки и сотни тысяч раз. Эту роль главным образом выполняют белки-ферменты (энзимы).
Иногда в состав белков входят так называемые ко-факторы - небелковые соединения, которые необходимы ферменту для его биологической активности (в роли ко-факторов могут выступать Zn 2+ , Mg 2+ ).
Белки входят в состав клеточных мембран. Сложные белки: коллаген, эластин - входят в состав соединительных тканей организма, придавая им некоторую прочность и эластичность.
Некоторые гормоны, регулирующие обменные процессы в организме, имеют белковое происхождение: инсулин, глюкагон, адренокортикотропный гормон (АКТГ).
Говоря об этой функции, прежде всего, стоит вспомнить об антителах - иммуноглобулинах, которые синтезируют B-лимфоциты. Антитела нейтрализуют чужеродные организму антигены (разрушают бактерии).

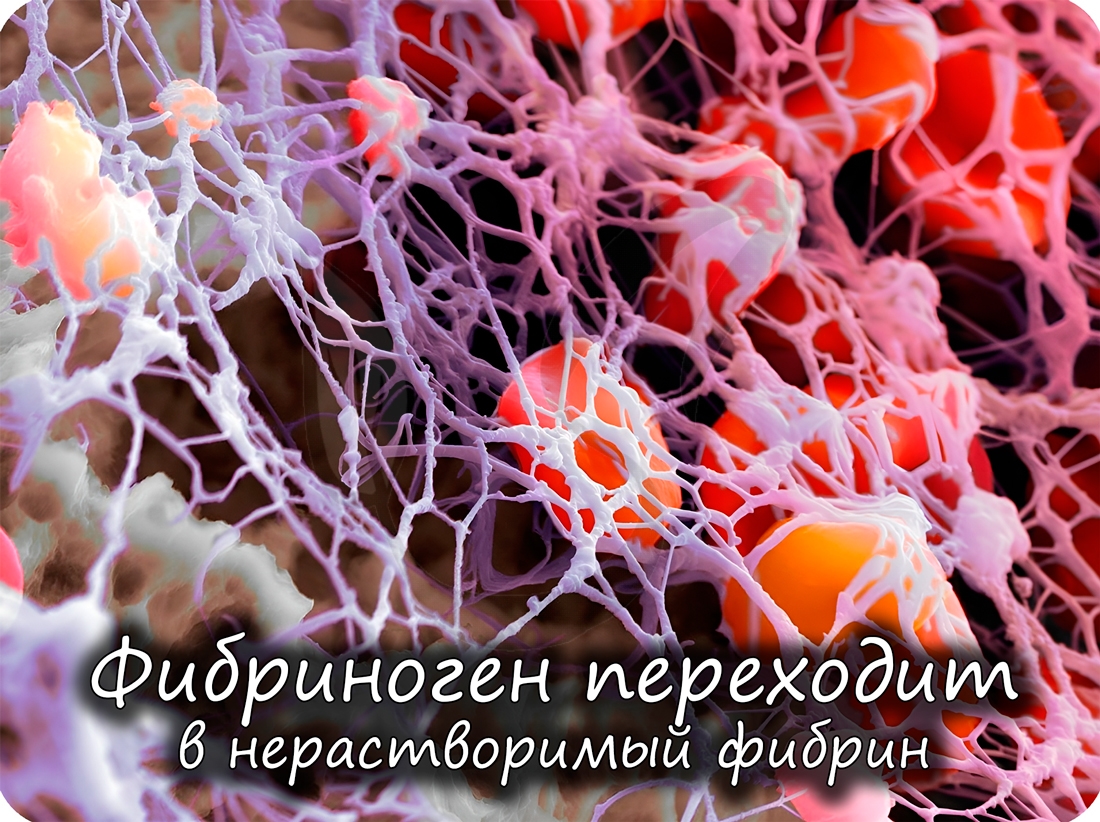
Помимо антител, защитную функцию выполняют также белки свертывающей системы крови (тромбин и фибриноген): они предохраняют организм от кровопотери.
При недостаточном питании в организме начинают окисляться молекулы белков. При расщеплении 1 г белков выделяется 17,6 кДж энергии.
Некоторые белки крови способны присоединять к себе и переносить различные молекулы. Альбумины участвуют в транспорте жирных кислот, глобулины - гормонов и некоторых ионов (Fe, Cu). Основной белок эритроцитов - гемоглобин - способен переносить кислород, углекислый и угарный газы (угарный конечно нежелательно ему переносить, будет отравление)
Двигательные белки, актин и миозин, на уровне саркомера обеспечивают сокращение мышц. При возбуждении мышечной ткани тонкие нити актина начинают тереться о толстые нити миозина, приводя к сокращению.
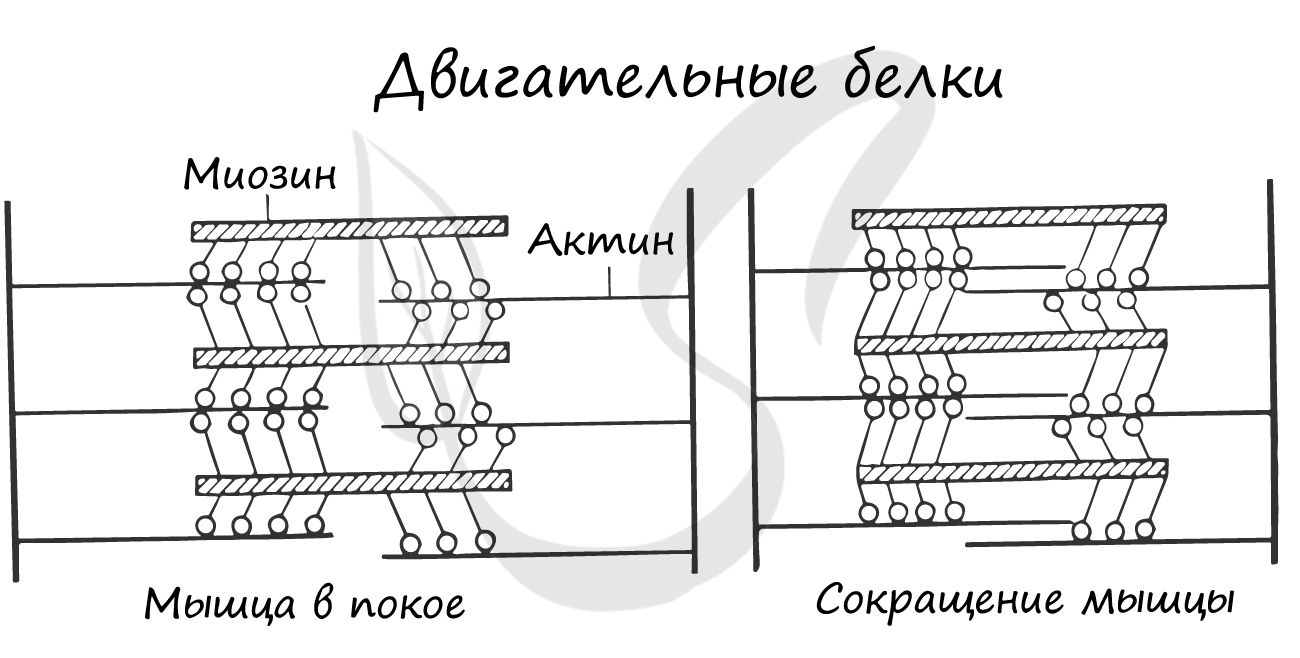
На поверхности мембраны белки образуют многочисленные рецепторы, которые, соединяясь с гормонами, приводят к изменению обмена веществ в клетке. Таким образом, гормоны реализуют воздействие на клетки органов-мишеней.
Жиры, или липиды (греч. lipos - жир)
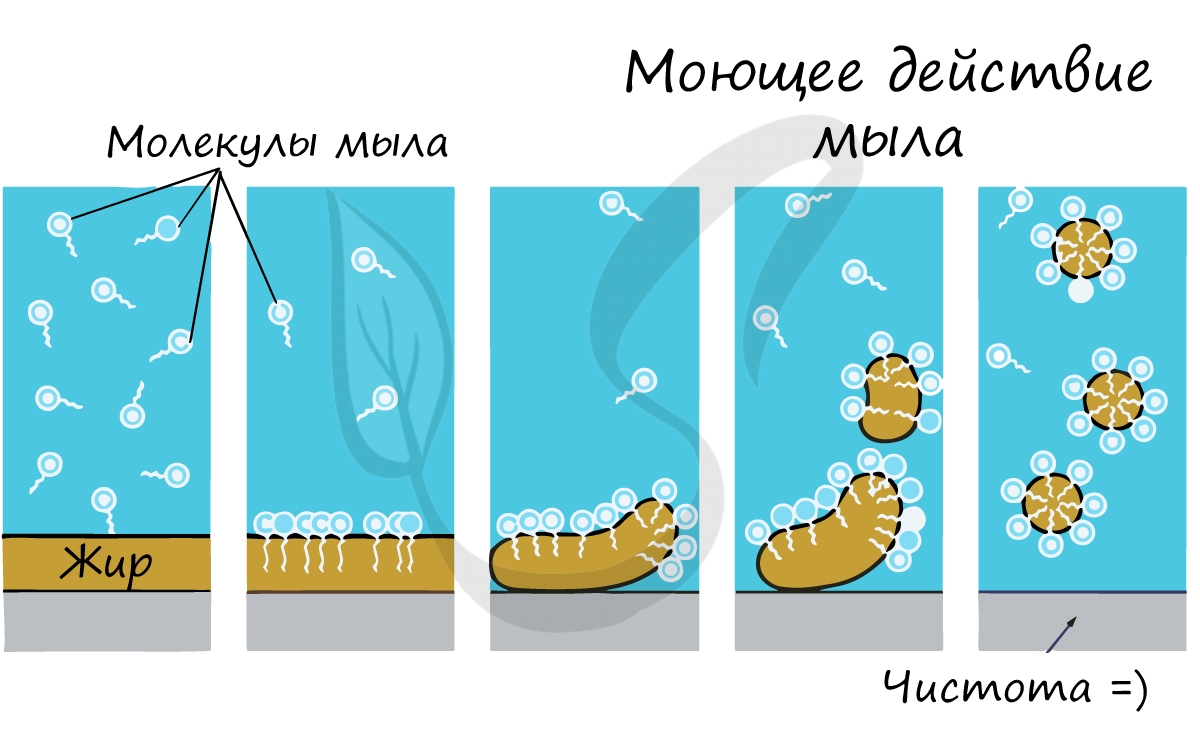
С химической точки зрения жиры являются сложными эфирами, образованными трехатомным спиртом глицерином и высшими карбоновыми кислотами (жирными кислотами). Среди их свойств надо выделить то, что они практически нерастворимы в воде. Вспомните, как тяжело смыть жир с рук водой.
Почему именно мыло смывает жир с рук? Дело в том, что молекула мыла повторяет свойства жира: одна часть ее гидрофобна, а другая гидрофильна. Мыло соединяется с молекулой жира гидрофобной частью, и вместе они легко смываются водой.
При окислении жиров выделяется много энергии: 1 г - 38,9 кДж. Это вдвое больше выделяющейся энергии при расщеплении 1г углеводов.
Жиры имеют способность накапливаться в клетках, расположенных в подкожно-жировой клетчатке, внутренних органах. Эти запасы являются резервом организма на случай голодания или при недостаточном питании.
В жирах также запасается вода: в 100 г жира содержится 107 мл воды. Многим пустынным животным (верблюдам) жировые запасы помогают длительное время обходиться без воды.
Жиры входят в состав биологических мембран клеток человека вместе с белками. Из фосфолипидов построены мембраны всех клеток органов и тканей!
Так, к примеру, холестерин - обязательный компонент мембраны, придает ей определенную жесткость и совершенно необходим для нормальной жизнедеятельности (заболевания возникают только при нарушении липидного обмена).

Жиры обладают плохой теплопроводностью. Располагаясь в подкожно-жировой клетчатке, они образуют термоизолирующий слой. Особенно хорошо он развит у ластоногих (моржи и тюлени), китов, защищает их от переохлаждения.
Некоторые гормоны по строению относятся к жирам: половые (андрогены - мужские и эстрогены - женские), гормон беременности (прогестерон), кортикостероиды.
Производное жира - витамин D - принимает важное участие в обмене кальция и фосфора в организме. Он образуется в коже под действием ультрафиолетового излучения (солнечного света). При недостатке витамина D возникает заболевание - рахит.

Углеводы
-
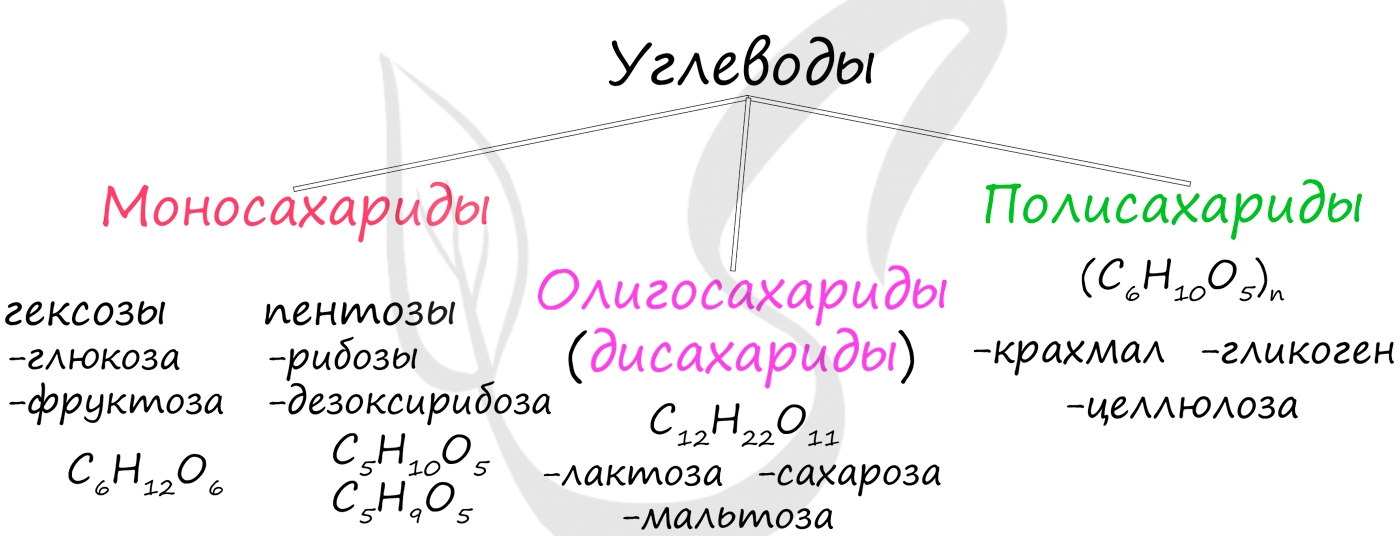
Моносахариды (греч. monos — единственный)
Простые сахара, легко растворяющиеся в воде и имеющие сладкий вкус. Моносахариды подразделяются на гексозы (имеют 6 атомов углерода) - глюкоза, фруктоза, и пентозы (имеют 5 атомов углерода) - рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот.
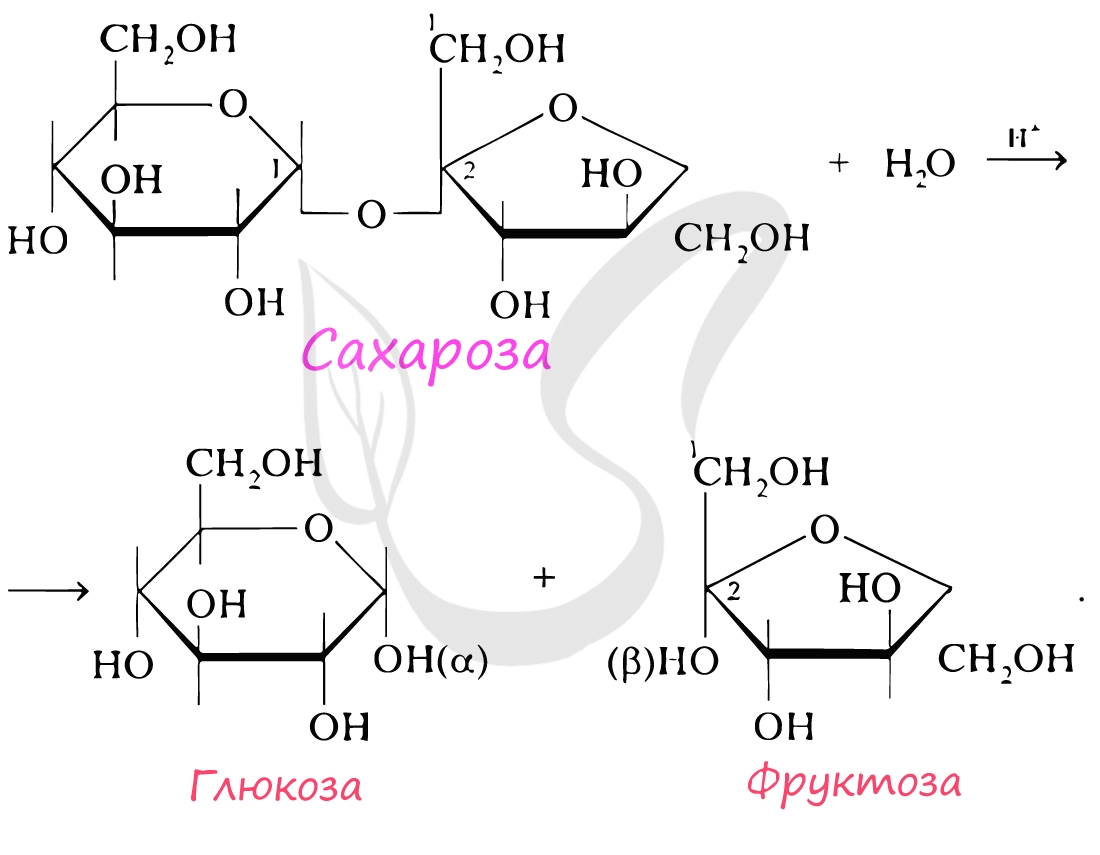
При гидролизе олигосахариды распадаются на моносахариды. В состав олигосахаридов может входить от 2 до 10 моносахаридных остатков. Если в состав олигосахарида входят 2 остатка моносахарида, то его называют дисахарид. К дисахаридам относятся сахароза, лактоза, мальтоза. При гидролизе сахароза распадается на глюкозу и фруктозу.
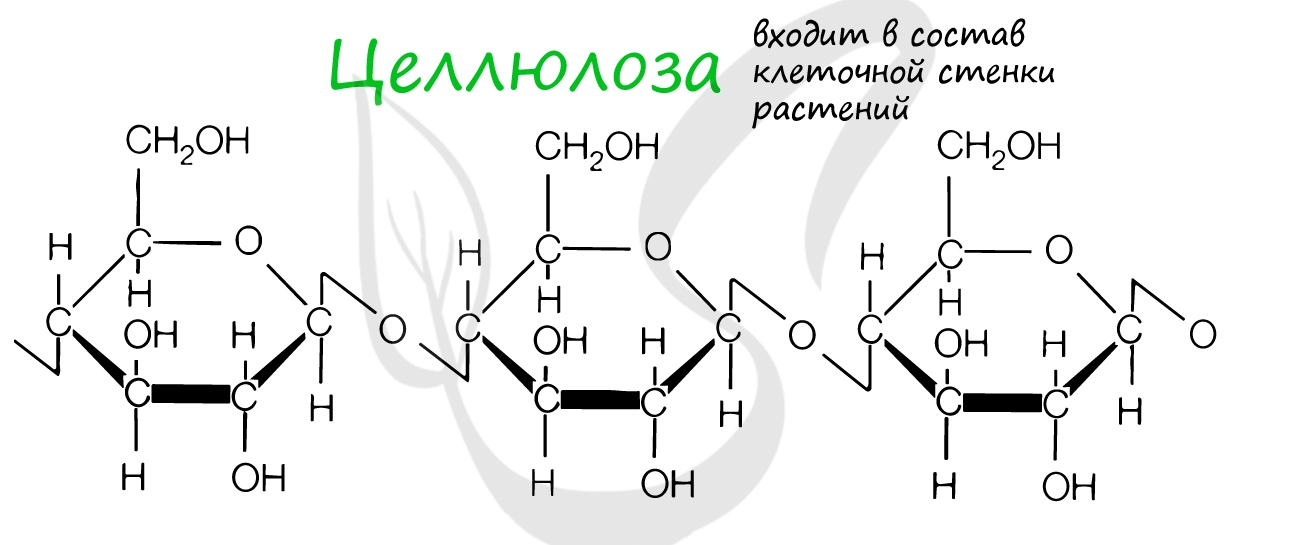
Это биополимеры, в состав которых входят сотни тысяч моносахаридов. Они обладают высокой молекулярной массой, нерастворимы в воде, на вкус несладкие.
Крахмал, целлюлоза, гликоген, хитин и муреин - все это биополимеры. Давайте вспомним, где они находятся.
Клеточная стенка образована: у растений - целлюлозой, у грибов - хитином, у бактерий - муреином. Запасным питательным веществом растений является крахмал, животных - гликоген.
В результате расщепления 1 г углеводов высвобождается 17,6 кДж энергии.
Запасным питательным веществом растений и животных соответственно являются крахмал и гликоген. Расщепление гликогена позволяет нам оставаться в сознании и быть активными между приемами пищи.
Гликоген представляет собой разветвленную молекулу, состоящую из остатков глюкозы. За счет больших размеров такая молекула хорошо удерживается в клетке, а ее разветвленность позволяет ферментам быстро отщеплять множество молекул глюкозы одновременно.
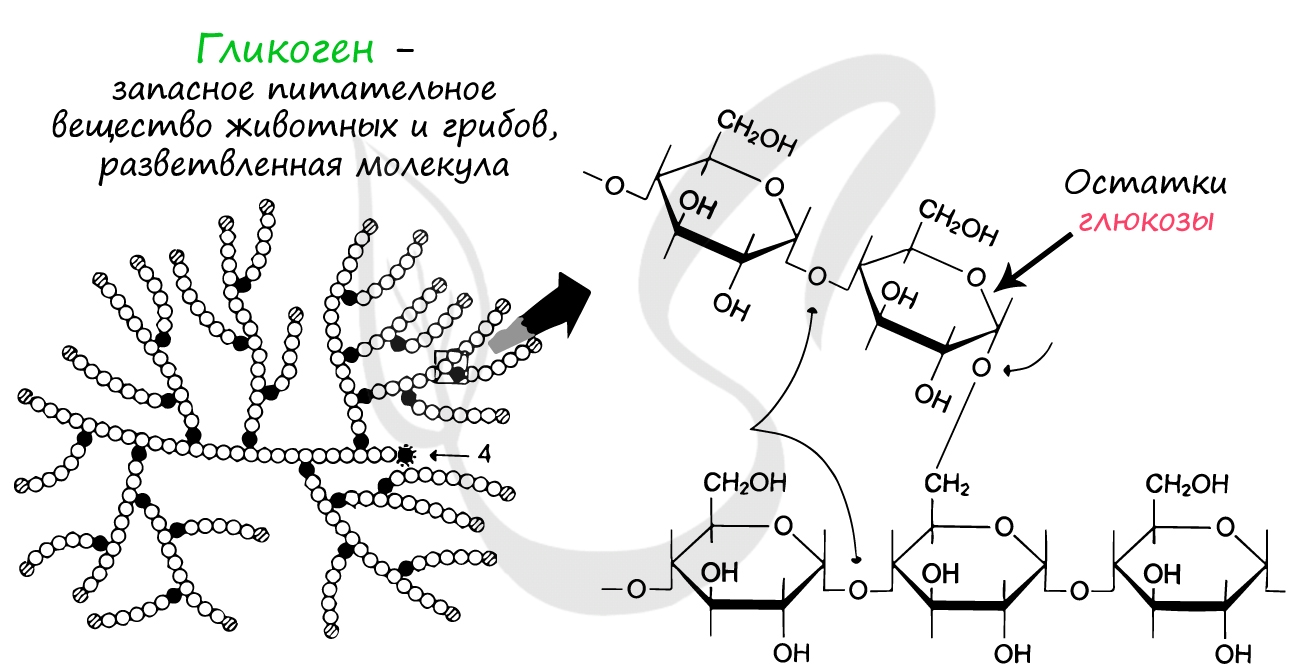
Существуют заболевания, при которых распад гликогена нарушается: в результате нейроны не получают глюкозы (источника энергии, соответственно не синтезируются и молекулы АТФ). Из-за этого становятся возможны частые потери сознания.
Целлюлоза входит в состав клеточных стенок растений, придавая им необходимую твердость. Хитин образует клеточную стенку грибов и наружный скелет членистоногих.
Нуклеиновые кислоты (от лат. nucleus — ядро)
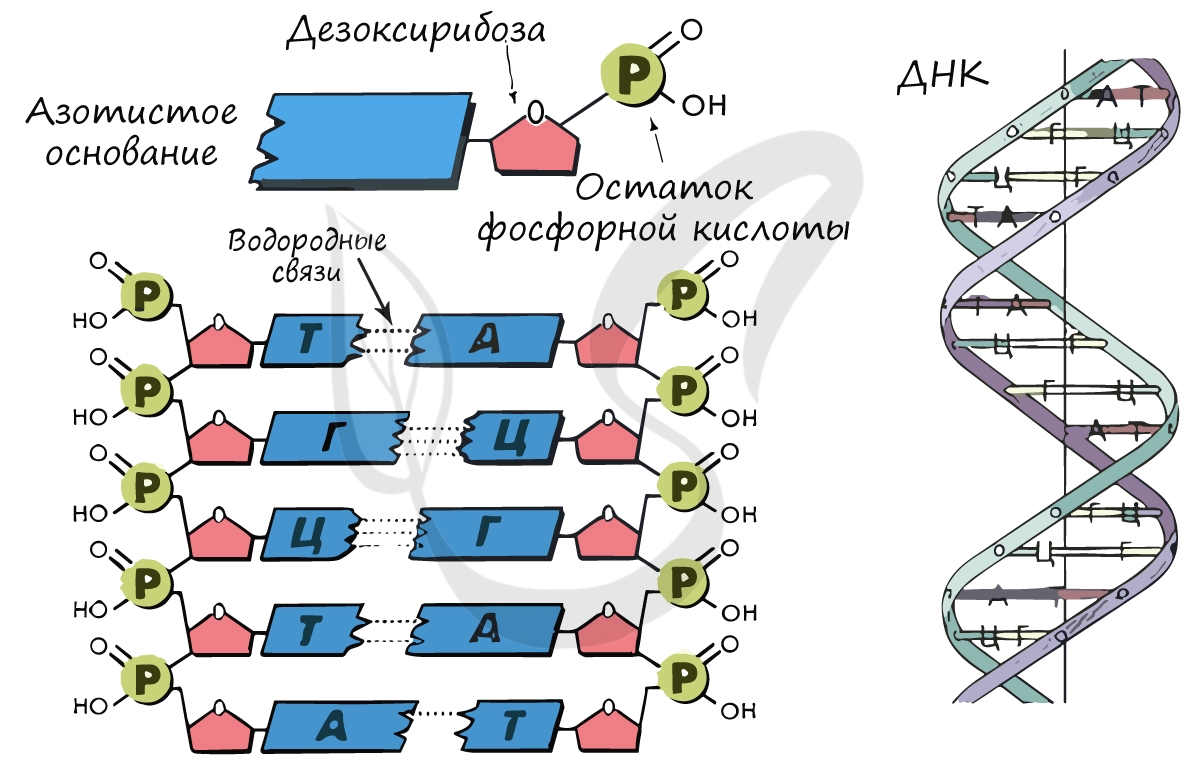
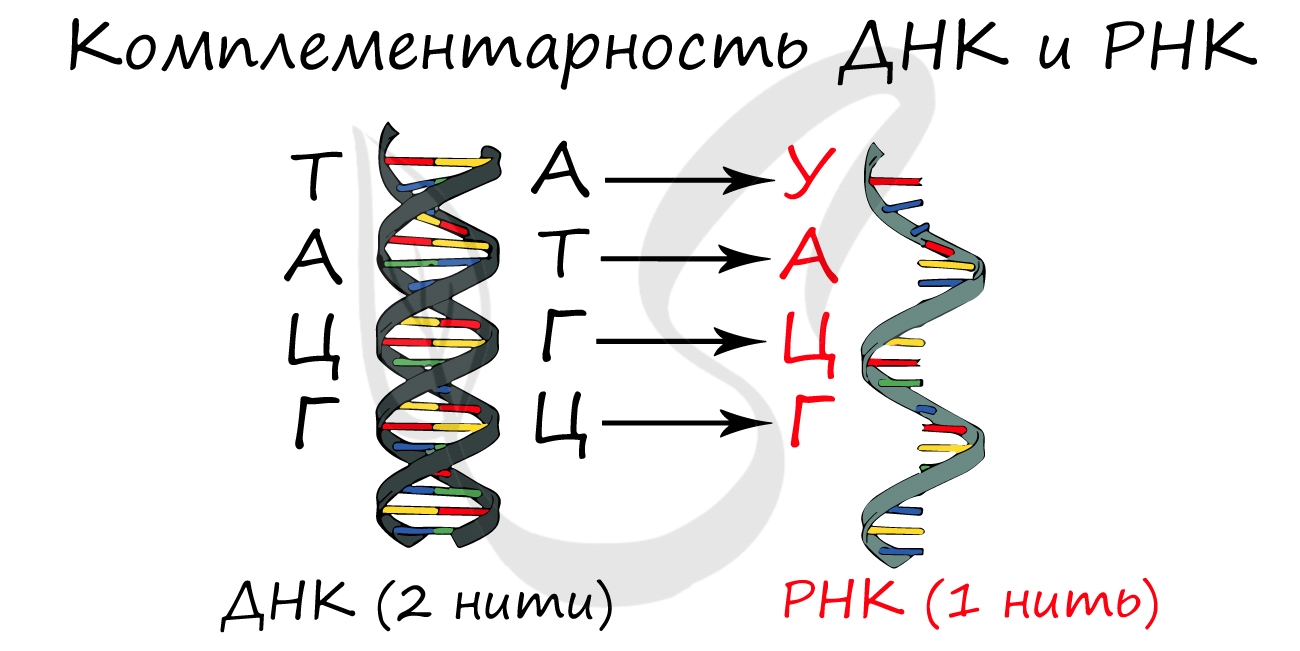
Для ДНК характерны следующие азотистые основания: аденин - тимин, гуанин - цитозин; для РНК: аденин - урацил, гуанин - цитозин. Исходя из принципа комплементарности, данные основания соответствуют друг другу, в результате чего между ними образуются связи.
Между аденином и тимином образуется 2 водородные связи, а между гуанином и цитозином - 3.
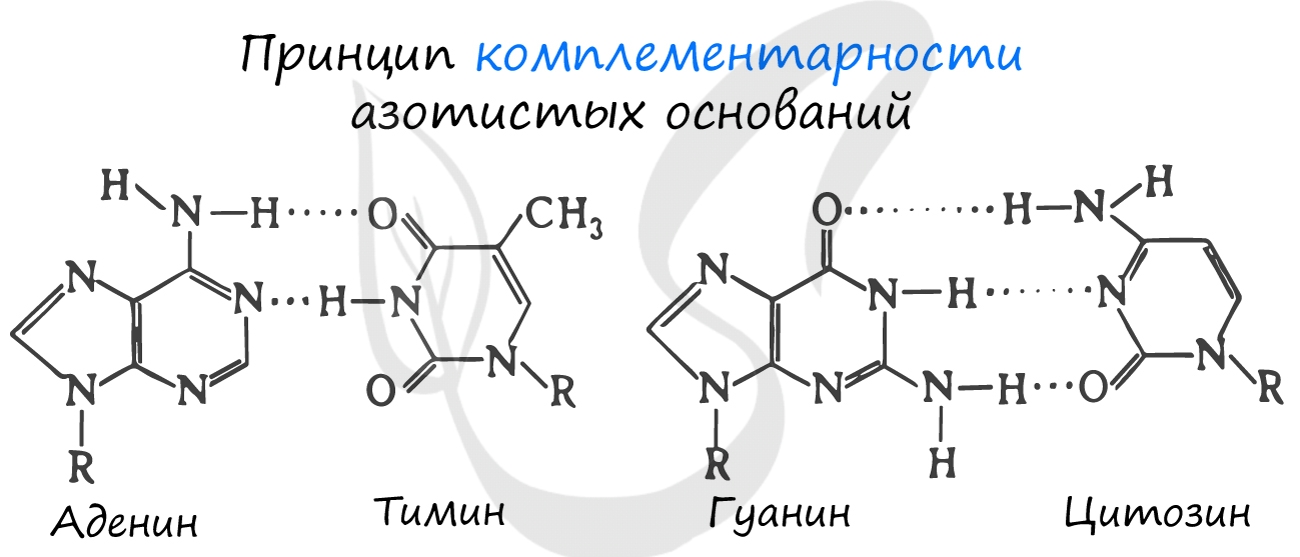
Именно по этой причине количество аденина в молекуле ДНК всегда совпадает с количеством тимина. К примеру, если в ДНК 20% аденина, то с уверенностью можно сказать, что в ней 20% тимина. Выходит на оставшиеся основания - цитозин и гуанин - остается 60%, значит, цитозин и гуанин составляют в ДНК 30% каждый. Таким нехитрым образом, зная процент содержания одного основания, можно подсчитать все остальные.
В ДНК остаток сахара - дезоксирибоза, в РНК - рибоза.
-
Рибосомальная РНК (рРНК)
Синтезируется в ядрышке. рРНК входит в состав малых и больших субъединиц рибосом. В процентном отношении рРНК составляет 80-90% всей РНК клетки.
Синтезируется в ядре в ходе процесса транскрипции (лат. transcriptio — переписывание). Фермент РНК-полимераза строит цепь иРНК по принципу комплементарности с ДНК. Исходя из данного принципа, гуанин (Г) в молекуле ДНК соединяется с цитозином (Ц) в РНК. Далее соответственно: цитозин (Ц) - гуанин (Г), аденин (А) - урацил (У), тимин (Т) - аденин (А).
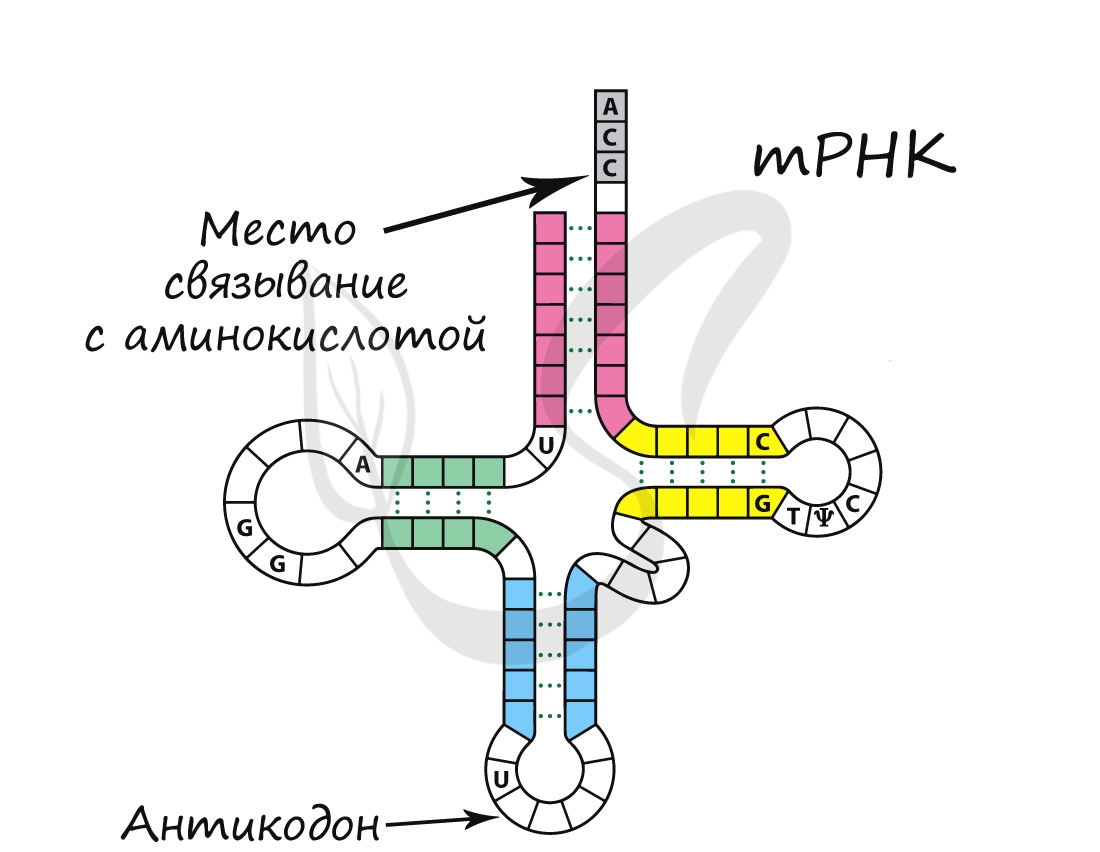
Обеспечивает транспорт аминокислоты к рибосоме во время синтеза белка. Благодаря этому становится возможным соединение аминокислот друг с другом, образуется белок. тРНК имеет характерную форму клеверного листа.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

