Генная инженерия человека кратко
Обновлено: 05.07.2024
Генная инженерия (технология рекомбинантных ДНК, молекулярной клонирование) — современное направление биотехнологии, объединяющее знания, приемы, методики комплекса смежных наук, в частности генетики, химии, биологии. С их помощью удается выделить необходимый ген из генома, перенести этот генетический материал из одного организма в другой с целью получения новых полезных для человека наследственных свойств.
Обычно этот термин связывают с клонированием генов, молекулярным клонированием, технологией рекомбинантных ДНК либо генетическими манипуляциями.
Генную инженерию можно определить как систему экспериментальных приемов, манипуляций, которые с помощью молекулярной биологии позволяют лабораторным путем создать искусственные генетические детерминанты в виде рекомбинантных (измененных) молекул ДНК. Таким образом, благодаря генной инженерии можно целенаправленно конструировать новые биологические объекты.
Характерной чертой генной инженерии является то, что лабораторное воспроизведение некоторых ключевых генетических процессов осуществляется на молекулярном уровне (уровне клетки и молекул). Внедрение в клетку новой генетической информации в виде рекомбинантных молекул ДНК изменяет ее фенотип и генотип, в результате чего экспериментатор получает измененный в соответствии с поставленной целью микроорганизм.
В генах содержится информация, позволяющая синтезировать в организме молекулы РНК и белки, в том числе ферменты. Для того чтобы заставить клетку образовывать новые, неизвестные ей вещества, в ней должны синтезироваться соответствующие наборы ферментов. Для этого нужно целенаправленно изменить находящиеся в ней гены либо внедрить в нее новые, ранее отсутствовавшие.
Изменения генов в живых клетках называют мутациями. Они могут происходить под действием, например, мутагенов — химических излучений или ядов.
Генно-модифицированный организм (ГМО) — это организм, генотип которого был искусственно изменен при помощи генно-инженерных методов.
Генно-инженерные методы направлены на конструирование новых, не существующих в природе сочетаний генов. В результате их использования можно получать рекомбинантные, то есть модифицированные молекулы ДНК и РНК.
С этой целью выделяют отдельные гены (кодирующие необходимый продукт) из клеток какого-то организма и внедряют их в другие организмы: дрожжи, бактерии, млекопитающие. Получив новые гены, они смогут синтезировать конечные продукты с измененными свойствами, необходимыми человеку.
Генная инженерия широко используется во многих сферах человеческой жизни с целью наделения живых организмов желательными свойствами, которыми они не обладали ранее, комбинируя имеющийся генетический материал, удаляя старые или синтезируя новые гены.
На основе генной инженерии сформировалась одна из современных ветвей биотехнологии — отрасль фармацевтической промышленности.
История развития, зачем нужно вмешиваться
Основы классической генетики были заложены в середине XIX В. Так, в 1865 г. чешско-австрийский биолог Грегор Мендель раскрыл принципы передачи наследственных признаков от родительских организмов к их потомкам на примере растений. К сожалению его эксперименты не получили заслуженного признания, и только в 1900 г. Хуго де Фриз, а также другие европейские ученые независимо друг от друга вновь открыли законы наследственности.
Одновременно с этим происходило формирование знаний о ДНК:
- Швейцарский биолог Фридрих Мишер в 1869 г. открыл факт существования макромолекулы.
- Американский биолог Томас Морган в 1910 г., основываясь на характере наследования у дрозофил, обнаружил, что на хромосомах гены расположены линейно и образуют группы сцепления.
- Эйвери Мак Леод и Мак Карти в 1944 г. показали, что именно ДНК является носителем наследственной информации.
- Американец Джон Уотсон и британец Фрэнсис Крик в 1953 г. сделали важнейшее открытие, определив молекулярную структуру ДНК — двойную спираль.
В конце 1960-х гг. происходит активное развитие генетики, а важными объектами ее изучения становятся плазмиды и вирусы. Ученые разработали методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, вирусов и плазмид, а в 1970-х г.г. открыли ряд ферментов, катализирующих реакции превращения ДНК.
Как отдельное направление исследовательской работы генная инженерия зародилась в США в 1972 г., когда в Стэнфордском университете ученые Стэнли Норман Коэн, Пол Берг, Герберт Бойер со своей научной группой смогли создать первую рекомбинантную ДНК, внедрив новый ген в бактерии кишечной палочки (E. coli).
В 1980-х гг. американский биохимик Кэри Маллис (будущий лауреат Нобелевской премии по химии) впервые разработал технику ПЦР. Он обнаружил фермент, участвующий в репликации ДНК — ДНК-полимеразу. Этот специфический фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их как шаблон для дальнейшего копирования генетической информации.
В 1987 г. впервые были проведены полевые испытания генетически модифицированных сельскохозяйственных растений. В итоге вывели устойчивый к вирусным инфекциям сорт помидор.
В 1996 произошел прорыв в истории развития генной инженерии, так как на свет появилась овца Долли — первое клонированное млекопитающее методом пересадки ядра соматической клетки в цитоплазму яйцеклетки. Благодаря этому революционному достижению в генной инженерии впервые стало возможным серьезно относиться к клонированию и выращиванию живых организмов на основе молекул.
Можно выделить 3 стадии в развитии генной инженерии:
- Выдвижение гипотезы и доказывание принципиальной возможности получения рекомбинантных молекул ДНК in vitro (в пробирке). Начался этап формирования гибридов между различными плазмидами.
- Начало работ по получению рекомбинантных молекул ДНК между хромосомными генами прокариот и различными плазмидами. В ходе исследований была доказана их реальная жизнеспособность, стабильность, адаптация к окружающей среде.
- Экспериментальные исследования по внедрению в векторные молекулы ДНК (то есть молекулы, способные переносить генетический код и встраиваться в генетическую структуру клетки-реципиента) генов эукариот. В основном использовались гены животных.
В настоящее время генная инженерия развивается как экспериментальная наука, с помощью которой многие люди избавляются от различных заболеваний, создаются новые сорта растений и т. д.
Какие задачи стоят перед ней
Основными задачами генной инженерии являются:
- Конструирование рекомбинантных ДНК, способных придать клеткам-реципиентам полезные для человечества свойства (синтезирование пищевого и коровьего белка).
- Создание и применение генно-инженерных штаммов бактерий, животных и человека для культивирования вирусов с целью получения вакцин, сывороток, диагностических препаратов, лекарственных средств.
- Создание трансгенных животных.
- Получение трансгенных растений с желаемыми свойствами.
- Разработка методов генной терапии человека.
- получение изолированного гена путем синтеза либо выделения из клеток;
- создание рекомбинантных молекул ДНК, состоящих из фрагментов молекул ДНК, полученных от разных организмов;
- клонирование генов или генетических структур;
- внедрение гена в вектор для переноса в организм;
- перенос вектора с геном в модифицируемый организм и синтез чужеродного белка;
- преобразование клеток организма;
- отбор генетически модифицированных организмов (ГМО) и устранение неудачных вариантов.
Виды, сферы применения генной инженерии
Человек использует генную инженерию для получения трансгенных растений и животных, генной терапии наследственных заболеваний, производства лекарственных препаратов, вакцин, гормонов и т. д.
В настоящее время генная инженерия широко распространена в отраслях народного хозяйства: фармакологической, микробиологической, пищевой промышленности, в сельском хозяйстве.
В медицине:
- Разработка с помощью синтезированных генов интерферонов — белков, вырабатываемых организмом в ответ на вирусную инфекцию, а также гормонов. Ученые рассматривают возможность использования интерферонов в качестве средства лечения от СПИДа и рака. Массовое производство этого полезного белка очень эффективно, ведь всего один литр бактериальной культуры дает столько интерферона, сколько добывают из тысяч литров человеческой крови.
- Производство в промышленных масштабах путем использования генномодифицированных бактерий инсулина, необходимого для лечения сахарного диабета.
- Используя рекомбинантную ДНК, получение человеческого гормона роста — единственного лекарства от гипофизарной карликовости (редкого детского заболевания).
- Клинические испытания около 200 новых диагностических препаратов (генных, а не белковых), а также более 100 лекарственных веществ.
С помощью генно-инженерных методов создали ряд вакцин, которые сейчас проходят испытания по проверке их эффективности против ВИЧ — вируса иммунодефицита человека, вызывающего СПИД.
В настоящее время интенсивно развивается и генная терапия. Так, для борьбы со злокачественными опухолями в организм вводят сконструированную копию гена, который кодирует мощный противоопухолевый фермент.
Важным направлением генной инженерии является обеспечение больных людей органами для пересадки. Например, трансгенная свинья, может стать донором сердца, почек, печени, сосудов и кожи для людей, так как по размерам внутренних органов и физиологии она наиболее близка к человеку.
В сельском хозяйстве:
Главными задачами являются:
- выведение устойчивых к вирусам видов животных и растений, сельскохозяйственных культур;
- защита растений от насекомых-вредителей;
- уменьшение интенсивности обработки полей пестицидами и т. д;
- увеличение витаминов и полезных веществ в зерновых культурах;
- улучшение качества и вкуса пищи;
- получение дизельного топлива из животных и растительных жиров;
- решение экологических проблем — например, очистка почвы от промышленных отходов, защита окружающей среды от загрязнений, разработка новых очистительных сооружений.
В генной терапии —проведение в клетке пациента различных манипуляций с генетическим материалом, в частности с ДНК или РНК, для лечения определенных заболеваний:
- замена мутировавшего гена, провоцирующего болезнь, здоровой копией;
- инактивация неправильно функционирующих мутирующих генов;
- внедрение нового гена, помогающего бороться с заболеванием.
Этапы создания трансгенного организма
Роль в жизни человека, примеры
Генная инженерия как одно из главных направлений научно-технического прогресса способствует ускорению решения вопросов здравоохранения, продовольственных, энергетических, сельскохозяйственных, экологических и иных актуальных задач.
Существует несколько сотен генетически измененных продуктов, употребляемых людьми во всем мире. Чаще всего на упаковке таких продуктов должно быть написано, что они сделаны из генетически модифицированного продукта.
Защитники генетически модифицированных организмов считают, что только они могут спасти человечество от голода, способствуя увеличению мирового производства сельскохозяйственной продукции. Ведь генетически модифицированные сорта растений:
- быстрее созревают и дольше хранятся;
- устойчивые к погоде, болезням;
- могут самостоятельно вырабатывать инсектициды против вредителей;
- способны приносить хороший урожай в отличие от старых сортов, погибающих при неблагоприятных условиях.
Особые возможности открывает генная инженерия перед медициной и фармацевтикой. Благодаря генно-инженерным методам во всем мире успешно практикуют производство лекарств. Так, многие болезни, не поддающиеся в настоящее время диагностике и лечению, например: сердечно-сосудистые, раковые заболевания, умственные и нервные расстройства, вирусные и паразитные инфекции — с помощью генной инженерии можно будет своевременно диагностировать и вылечить.
По мнению медиков, генномодифицированные продукты — основа специальных диет, помогающих в профилактике и лечении различных болезней. Ученые утверждают, что благодаря таким продуктам люди с остеопорозом, сахарным диабетом, онкологическими, сердечно-сосудистыми заболеваниями, болезнями кишечника, печени и др. смогут расширить свой рацион питания.
Некоторые ученые считают, что внесение изменений в генный код животных и растений не противоречит, а соответствует природе, ведь абсолютно все живые организмы, включая и бактерии, и человека — результат естественного отбора и мутаций. Отличие заключается лишь в том, что ученым для образования их новых видов нужно несколько лет, а природа затрачивает на этот процесс столетия и даже тысячелетия.
Самыми распространенными в мире генно-модифицированными растениями являются: хлопок, масличный рапс, кукуруза, соя. В некоторых странах разрешают выращивать трансгенные кабачки, помидоры, рис, проводятся эксперименты на винограде, сахарной свекле, табаке, подсолнечнике, деревьях и т. д.
Основную массу трансгенов выращивают в Аргентине, США, Китае, Канаде. В странах Европы часто действует запрет на ввоз генетически измененного продовольствия, либо требуется обязательная маркировка таких продуктов. В странах ЕС разрешены только три вида генетически измененных растений — три сорта кукурузы.
В России разрешено использовать лишь 14 видов ГМО для продажи и производства пищевых продуктов: 4 сорта картофеля, 1 сорт сахарной свеклы, 8 сортов кукурузы и 1 сорт риса.
Следует отметить, что при употреблении такой пищи сохраняется потенциальная опасность отдаленных последствий для здоровья человека. Хотя опасность продуктов с ГМО официально не доказана, и они разрешены к применению Всемирной организацией здравоохранения, по мнению некоторых ученых к ним нужно относиться с осторожностью до завершения полномасштабных исследований воздействия ГМО на организм.
И тем более, во избежание непредсказуемых последствий, следует особо тщательно подходить к вопросам их применения в детском питании.
Несмотря на существующие риски, на обвинения в бесчеловечности защитников животных и растений, генная инженерия открывает перед человечеством огромные возможности, если умело распоряжаться полученными знаниями.
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора. Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента. Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах. Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. [1] В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — игрунка обыкновенная. [2]
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. [3] Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем.
Генетическая инжене́рия (генная инженерия)
Это совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами и введения их в другие организмы.
Генетическая инженерия не является наукой в широком смысле, но является инструментом биотехнологии, используя методы таких биологических наук, как молекулярная и клеточная биология, цитология, генетика, микробиология, вирусология.
Важной составной частью биотехнологии является генетическая инженерия. Родившись в начале 70-х годов, она добилась сегодня больших успехов. Методы генной инженерии преобразуют клетки бактерий, дрожжей и млекопитающих в "фабрики" для масштабного производства любого белка. Это дает возможность детально анализировать структуру и функции белков и использовать их в качестве лекарственных средств.
В настоящее время кишечная палочка (E. coli) стала поставщиком таких важных гормонов как инсулин и соматотропин. Ранее инсулин получали из клеток поджелудочной железы животных, поэтому стоимость его была очень высока. Для получения 100 г кристаллического инсулина требуется 800-1000 кг поджелудочной железы, а одна железа коровы весит 200 - 250 грамм. Это делало инсулин дорогим и труднодоступным для широкого круга диабетиков. В 1978 году исследователи из компании "Генентек" впервые получили инсулин в специально сконструированном штамме кишечной палочки. Инсулин состоит из двух полипептидных цепей А и В длиной 20 и 30 аминокислот. При соединении их дисульфидными связями образуется нативный двухцепочечный инсулин. Было показано, что он не содержит белков E. coli, эндотоксинов и других примесей, не дает побочных эффектов, как инсулин животных, а по биологической активности от него не отличается. Впоследствии в клетках E. coli был осуществлен синтез проинсулина, для чего на матрице РНК с помощью обратной транскриптазы синтезировали ее ДНК-копию. После очистки полученного проинсулина его расщепили и получили нативный инсулин, при этом этапы экстракции и выделения гормона были сведены к минимуму. Из 1000 литров культуральной жидкости можно получать до 200 граммов гормона, что эквивалентно количеству инсулина, выделяемого из 1600 кг поджелудочной железы свиньи или коровы.

Соматотропин - гормон роста человека, секретируемый гипофизом. Недостаток этого гормона приводит к гипофизарной карликовости. Если вводить соматотропин в дозах 10 мг на кг веса три раза в неделю, то за год ребенок, страдающий от его недостатка, может подрасти на 6 см. Ранее его получали из трупного материала, из одного трупа: 4 - 6 мг соматотропина в пересчете на конечный фармацевтический препарат. Таким образом, доступные количества гормона были ограничены, кроме того, гормон, получаемый этим способом, был неоднороден и мог содержать медленно развивающиеся вирусы. Компания "Genentec" в 1980 году разработала технологию производства соматотропина с помощью бактерий, который был лишен перечисленных недостатков. В 1982 году гормон роста человека был получен в культуре E. coli и животных клеток в институте Пастера во Франции, а с 1984 года начато промышленное производство инсулина и в СССР. При производстве интерферона используют как E. coli, S. cerevisae (дрожжи), так и культуру фибробластов или трансформированных лейкоцитов. Аналогичными методами получают также безопасные и дешевые вакцины.
На технологии рекомбинантных ДНК основано получение высокоспецифичных ДНК-зондов, с помощью которых изучают экспрессию генов в тканях, локализацию генов в хромосомах, выявляют гены, обладающие родственными функциями (например, у человека и курицы). ДНК-зонды также используются в диагностике различных заболеваний.
Технология рекомбинантных ДНК сделала возможным нетрадиционный подход "белок-ген", получивший название "обратная генетика". При таком подходе из клетки выделяют белок, клонируют ген этого белка, модифицируют его, создавая мутантный ген, кодирующий измененную форму белка. Полученный ген вводят в клетку. Если он экспрессируется, несущая его клетка и ее потомки будут синтезировать измененный белок. Таким образом можно исправлять дефектные гены и лечить наследственные заболевания.
Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены трансгенные организмы, экспрессирующие мутантный ген и передающие его потомками. Генетическая трансформация животных позволяет установить роль отдельных генов и их белковых продуктов как в регуляции активности других генов, так и при различных патологических процессах. С помощью генетической инженерии созданы линии животных, устойчивых к вирусным заболеваниям, а также породы животных с полезными для человека признаками. Например, микроинъекция рекомбинантной ДНК, содержавшей ген соматотропина быка в зиготу кролика позволила получить трансгенное животное с гиперпродукцией этого гормона. Полученные животные обладали ярко выраженной акромегалией.
Сейчас даже трудно предсказать все возможности, которые будут реализованы в ближайшие несколько десятков лет.
Генная инженерия — это область биотехнологий, включающая в себя действия по перестройке генотипов. Уже сегодня генная инженерия позволяет включать и выключать отдельные гены, контролируя таким образом деятельность организмов, а также — переносить генетические инструкции из одного организма в другой, в том числе – организмы другого вида. По мере того, как генетики всё больше узнают о работе генов и белков, всё более реальной становится возможность произвольным образом программировать генотип (прежде всего, человеческий), с лёгкостью достигая любых результатов: таких, как устойчивость к радиации, способность жить под водой, способность к регенерации повреждённых органов и даже бессмертие.
В применении к человеку генная инженерия могла бы применяться для лечения наследственных болезней. Однако, технически, есть существенная разница между лечением самого пациента и изменением генома его потомков.
Задача изменения генома взрослого человека несколько сложнее, чем выведение новых генноинженерных пород животных, поскольку в данном случае требуется изменить геном многочисленных клеток уже сформировавшегося организма, а не одной лишь яйцеклетки-зародыша. Для этого предлагается использовать вирусные частицы в качестве вектора. Вирусные частицы способны проникать в значительный процент клеток взрослого человека, встраивая в них свою наследственную информацию; возможно контролируемое размножение вирусных частиц в организме. При этом для уменьшения побочных эффектов учёные стараются избегать внедрения генноинженерных ДНК в клетки половых органов, тем самым избегая воздействия на будущих потомков пациента. Также стоит отметить значительную критику этой технологии в СМИ: разработка генноинженерных вирусов воспринимается многими как угроза для всего человечества.
С помощью генотерапии в будущем возможно изменение генома человека. В настоящее время эффективные методы изменения генома человека находятся на стадии разработки и испытаний на приматах. Долгое время генетическая инженерия обезьян сталкивалась с серьёзными трудностями, однако в 2009 году эксперименты увенчались успехом: в журнале Nature появилась публикация об успешном применении генноинженерных вирусных векторов для излечения взрослого самца обезьяны от дальтонизма. [1] В этом же году дал потомство первый генетически модифицированный примат (выращенный из модифицированной яйцеклетки) — игрунка обыкновенная. [2]
Хотя и в небольшом масштабе, генная инженерия уже используется для того, чтобы дать шанс забеременеть женщинам с некоторыми разновидностями бесплодия. [3] Для этого используют яйцеклетки здоровой женщины. Ребёнок в результате наследует генотип от одного отца и двух матерей.
Однако возможность внесения более значительных изменений в геном человека сталкивается с рядом серьёзных этических проблем.
Генетическая инжене́рия (генная инженерия)
Это совокупность приёмов, методов и технологий получения рекомбинантных РНК и ДНК, выделения генов из организма (клеток), осуществления манипуляций с генами и введения их в другие организмы.
Генетическая инженерия не является наукой в широком смысле, но является инструментом биотехнологии, используя методы таких биологических наук, как молекулярная и клеточная биология, цитология, генетика, микробиология, вирусология.
Важной составной частью биотехнологии является генетическая инженерия. Родившись в начале 70-х годов, она добилась сегодня больших успехов. Методы генной инженерии преобразуют клетки бактерий, дрожжей и млекопитающих в "фабрики" для масштабного производства любого белка. Это дает возможность детально анализировать структуру и функции белков и использовать их в качестве лекарственных средств.
В настоящее время кишечная палочка (E. coli) стала поставщиком таких важных гормонов как инсулин и соматотропин. Ранее инсулин получали из клеток поджелудочной железы животных, поэтому стоимость его была очень высока. Для получения 100 г кристаллического инсулина требуется 800-1000 кг поджелудочной железы, а одна железа коровы весит 200 - 250 грамм. Это делало инсулин дорогим и труднодоступным для широкого круга диабетиков. В 1978 году исследователи из компании "Генентек" впервые получили инсулин в специально сконструированном штамме кишечной палочки. Инсулин состоит из двух полипептидных цепей А и В длиной 20 и 30 аминокислот. При соединении их дисульфидными связями образуется нативный двухцепочечный инсулин. Было показано, что он не содержит белков E. coli, эндотоксинов и других примесей, не дает побочных эффектов, как инсулин животных, а по биологической активности от него не отличается. Впоследствии в клетках E. coli был осуществлен синтез проинсулина, для чего на матрице РНК с помощью обратной транскриптазы синтезировали ее ДНК-копию. После очистки полученного проинсулина его расщепили и получили нативный инсулин, при этом этапы экстракции и выделения гормона были сведены к минимуму. Из 1000 литров культуральной жидкости можно получать до 200 граммов гормона, что эквивалентно количеству инсулина, выделяемого из 1600 кг поджелудочной железы свиньи или коровы.
Соматотропин - гормон роста человека, секретируемый гипофизом. Недостаток этого гормона приводит к гипофизарной карликовости. Если вводить соматотропин в дозах 10 мг на кг веса три раза в неделю, то за год ребенок, страдающий от его недостатка, может подрасти на 6 см. Ранее его получали из трупного материала, из одного трупа: 4 - 6 мг соматотропина в пересчете на конечный фармацевтический препарат. Таким образом, доступные количества гормона были ограничены, кроме того, гормон, получаемый этим способом, был неоднороден и мог содержать медленно развивающиеся вирусы. Компания "Genentec" в 1980 году разработала технологию производства соматотропина с помощью бактерий, который был лишен перечисленных недостатков. В 1982 году гормон роста человека был получен в культуре E. coli и животных клеток в институте Пастера во Франции, а с 1984 года начато промышленное производство инсулина и в СССР. При производстве интерферона используют как E. coli, S. cerevisae (дрожжи), так и культуру фибробластов или трансформированных лейкоцитов. Аналогичными методами получают также безопасные и дешевые вакцины.
На технологии рекомбинантных ДНК основано получение высокоспецифичных ДНК-зондов, с помощью которых изучают экспрессию генов в тканях, локализацию генов в хромосомах, выявляют гены, обладающие родственными функциями (например, у человека и курицы). ДНК-зонды также используются в диагностике различных заболеваний.
Технология рекомбинантных ДНК сделала возможным нетрадиционный подход "белок-ген", получивший название "обратная генетика". При таком подходе из клетки выделяют белок, клонируют ген этого белка, модифицируют его, создавая мутантный ген, кодирующий измененную форму белка. Полученный ген вводят в клетку. Если он экспрессируется, несущая его клетка и ее потомки будут синтезировать измененный белок. Таким образом можно исправлять дефектные гены и лечить наследственные заболевания.
Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены трансгенные организмы, экспрессирующие мутантный ген и передающие его потомками. Генетическая трансформация животных позволяет установить роль отдельных генов и их белковых продуктов как в регуляции активности других генов, так и при различных патологических процессах. С помощью генетической инженерии созданы линии животных, устойчивых к вирусным заболеваниям, а также породы животных с полезными для человека признаками. Например, микроинъекция рекомбинантной ДНК, содержавшей ген соматотропина быка в зиготу кролика позволила получить трансгенное животное с гиперпродукцией этого гормона. Полученные животные обладали ярко выраженной акромегалией.
Сейчас даже трудно предсказать все возможности, которые будут реализованы в ближайшие несколько десятков лет.
Генная инженерия — это область биотехнологий, включающая в себя действия по перестройке генотипов. Уже сегодня генная инженерия позволяет включать и выключать отдельные гены, контролируя таким образом деятельность организмов, а также — переносить генетические инструкции из одного организма в другой, в том числе – организмы другого вида. По мере того, как генетики всё больше узнают о работе генов и белков, всё более реальной становится возможность произвольным образом программировать генотип (прежде всего, человеческий), с лёгкостью достигая любых результатов: таких, как устойчивость к радиации, способность жить под водой, способность к регенерации повреждённых органов и даже бессмертие.

Генная инженерия представляет собой новое направление в сфере молекулярной биологии, которое получило широкое распространение во многих сферах медицины и биологии относительно недавно.
Генная инженерия позволяет целенаправленно, по заранее намеченной программе, экспериментально модифицировать геном с использованием генетической информации из разных гетерологических систем: вирусов, бактерий, насекомых, животных и человека. Применяя методы генной инженерии, ученые способны модифицировать структуру генов, а также создавать гибридные гены.
Следует отметить огромный вклад генной инженерии в улучшение сферы медицинского обслуживания. Так, благодаря генной инженерии стало возможным создание новых диагностических препаратов, вакцин и препаратов для заместительной терапии, а также лечение наследственных заболеваний. Применение генной терапии в лечении такой патологии как первичные иммунодефициты является единственным терапевтическим методом, обеспечивающим полное излечение, что значительно улучшает качество жизни пациентов и снижает риск летального исхода. В последнее время рассматриваются новые варианты применения генной инженерии в трансплантологии и редактировании генома эмбрионов. Возможность применения этой инновационной технологии порождает множество биоэтических вопросов. Считаю, что анализ предполагаемых последствий применения генной инженерии для общества должен создавать рамки возможного вмешательства в геном организмов.
Среди многих достижений генной инженерии, получивших применение в медицине, наиболее значимое — получение человеческого инсулина в промышленных масштабах. Генные инженеры в качестве первой практической задачи решили клонировать ген инсулина. Клонированные гены человеческого инсулина были введены с плазмидой в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали.
Использование генно-инженерного инсулина не вызывало каких-либо патологических реакций в организме, в том числе и иммунопатологических, которые часто наблюдались у пациентов, использующих в терапии диабета инсулин животного происхождения. Масштабное использование генно-инженерного инсулина значительно снизило летальность от диабета, в особенности у пациентов детского возраста, так как именно у этой категории населения преимущественно развивается инсулинозависимый диабет 1 типа. Следующими разрабатываемыми генно-инженерными препаратами были интерфероны и интерлейкины, используемые в терапии вирусных и онкологических заболеваний.
Около 200 новых диагностических препаратов уже введены в медицинскую практику, и более 100 генно-инженерных лекарственных веществ находятся на стадии клинических исследований. Среди них лекарства, используемые в терапии артрозов, сердечно-сосудистых заболеваний, онкологических заболеваний.
Сферы использования генной инженерии в медицине значительно расширяются. Так актуальной является возможность применения генной инженерии в диагностике и терапии наследственных заболеваний.
В настоящее время известно более 4000 наследственных заболеваний, для большинства из которых не найдено эффективных способов лечения. Генные инженеры разрабатывают диагностические препараты, позволяющие обнаруживать генетические аномалии в период беременности, что дает возможность предотвратить рождение ребенка с генетической аномалией [4].
Так в 1989 году в Национальных Институтах Здоровья США впервые была предпринята попытка применить в клинической практике генную терапию для лечения пациентов с диагнозом тяжелая комбинированная иммунная недостаточность (ТКИН). Наиболее обнадеживающие результаты ожидают в тех случаях, когда заболевание обусловлено дефектом одного гена. В этом случае полагают, что удастся вводить нормальный ген в соматические клетки прицельно в то место на хромосоме, где находится дефектный ген. При гомологичной рекомбинации введенный ген заместит дефектный. Такой однократной процедуры в ряде случаев будет достаточно, чтобы излечить болезнь. Однако на практике очень трудно проконтролировать судьбу введенной в клетки ДНК, и на одно правильное встраивание в геном приходится более 1000 случайных. Разрабатывается и другой подход, когда введенный ген не заменяет дефектный, а компенсирует его функцию, встраиваясь в хромосому в другом месте.
Инновационной технологией в редактировании генома является технология CRISPR. По причине легкости редактирования генома с использованием технологии CRISPR существует значительный интерес к перспективам редактирования генома эмбриона человека.
Основной метод применения технологии CRISPR — доставка редактирующих агентов в клетки эмбриона, созданного путем оплодотворения in vitro. В последствии может оказаться более целесообразным и этически приемлемым редактировать гаметогенные клетки-предшественники у будущих родителей. Преимущество зародышевой коррекции аллелей генов, соответствующих патологическим состояниям, заключается в том, что они навсегда исчезнут из генома.
Еще одной сферой использования генной инженерии в медицине является CAR-T-терапия. На сегодняшний день одним из наиболее перспективных направлений в терапии онкологических заболеваний является адоптивная клеточная иммунотерапия. При проведении такой терапии выделяют, активируют и размножают аутологичные T-лимфоциты, а затем вводят их обратно пациенту, что приводит к частичной регрессии или эрадикации опухоли. Введение Т-клеток, модифицированных химерными антигенными рецепторами (CAR-T-клеток), является одним из наиболее активно развивающихся направлений иммуноонкологии [6]. CAR-T-клетки представляют собой генетически модифицированные собственные Т-клетки пациентов, которые содержат химерный антигенный рецептор. Этот рецептор содержит в себе часть антитела, специфического к антигену опухоли и часть, рецептора Т-клеток. С использованием CAR-T-терапии получены обнадеживающие результаты при гематологических опухолевых заболеваниях. Так, клинические испытания CAR-T-клеток, направленных против В-лимфоцитарного антигена CD19, показали их эффективность при лечении резистентных к химиотерапии опухолей В-клеточного происхождения.
Биоэтические проблемы
С точки зрения биоэтики возникает ряд вопросов о допустимости применения генной инженерии по отношению к человеку. Помимо биоэтических проблем существует ряд дополнительных вопросов как в непосредственно самой процедуре генетической модификации клеток организма человека, так и в отдаленных последствиях этой процедуры для отдельного человека и для человеческой популяции в целом.
Использование генной терапии в лечении наследственных заболеваний также сопровождается рядом проблем, так при лечении некоторых заболеваний отдаленным последствием такой терапии является развитие онкологических заболеваний.
Обратной стороной CAR-T-терапии является высокий риск возникновения системных и опасных для жизни побочных эффектов, в первую очередь, гиперцитокинемии (цитокиновый шторм, цитокиновый каскад, синдром выброса цитокинов и синдром лизиса опухоли). Эти осложнения могут спровоцировать развитие синдрома полиорганной недостаточности и, как следствие, привести к летальному исходу. Еще одна существенная проблема применения CAR-T-терапии – неспецифическая цитотоксичность, особенно актуальная в случае терапии солидных опухолей, к которым крайне сложно подобрать специфичные антигены. Неспецифическая цитотоксичность обусловлена развитием интенсивной и быстрой кросс-реакции введенных Т-клеток на здоровые клетки, что часто приводит к летальному исходу.
Примером этических суждений о конкретных последствиях может служить то, что граница между лечением и улучшением в области медицинской генетики не является очевидной, и улучшающая генная инженерия сама по себе может быть благом, но угрозу представляет социальное неравенство относительно распределения выгод генной инженерии так как это может привести к созданию серьезной и необратимой несправедливости. Любые генно-инженерные процедуры будут доступны в первую очередь для развитых стран, в то время как страны третьего мира будут лишены возможности использования генно-инженерных технологий.
Отдельные генетические последовательности, пригодные для улучшающей генной инженерии людей, в будущем могут быть запатентованы. Рынок улучшающей генной инженерии представляется перспективным: все люди будут заинтересованы в улучшении параметров своего потомства, но, иметь доступ к таким процедурам в первую очередь будут жители развитых стран.
Использование генной инженерии приведет не только к усугублению неравенства между жителями отдельных стран, но и к расслоению общества внутри этих стран. Генетически привилегированные люди могут стать не стареющими, здоровыми супер гениями безупречной физической красоты, отличающимися блестящим остроумием и обезоруживающим, умаляющим чувство собственного достоинства юмором, излучающими тепло, эмпатический шарм и ослабленную непоколебимость. Непривилегированные останутся сегодняшними людьми, возможно, не имеющими чувства самоуважения и страдающими от случайных приступов зависти. Мобильность между низшими и высшими классами может исчезнуть, и ребенок, рожденный в бедной семье, не имеющий генетического усовершенствования, не сможет успешно соперничать с супер детьми богатых родителей. Даже если не случится дискриминация или эксплуатация низшего класса, все еще будет что-то разрушительное в перспективе общества с такими крайними формами неравенства.
Примерами категорических суждений являются изменение уникальности и ценности личности человека, подвергшегося воздействию генной инженерии, а также дискриминация по отношению к еще не родившемуся ребенку, в случае проведения генно-инженерных процедур на зародышевой линии.
В воспроизводстве наиболее важными вопросами являются интересы ребенка, который не может дать свое предварительное согласие или свободно вступать в любую форму договора. Ведь эмбрион является будущей личностью, которая не давала разрешения на проведение опытов.
Еще одним вопросом является то, что сегодня никто не может даже приблизительно оценить те последствия, которые повлечет за собой размножение живой материи, созданной искусственно.
Экспертами в области биоэтики также рассматривается вероятность создания биологического оружия при использовании генной инженерии. Наиболее часто рассматриваются варианты создания генно-модифицированных организмов в качестве инфекционного агента, приводящего к развитию пандемий.
Также хочется осветить биоэтические вопросы генетического тестирования. Наиболее глубокие проблемы, относящиеся к прогнозированию, лежат в сфере здравоохранения, где проводится генетическое тестирование. Генные технологии имеют отношение к правам человека и в судебных случаях — например, при установлении отцовства или материнства и при идентификации подозреваемых преступников. Права человека нарушаются и тогда, когда насильственное или даже добровольное тестирование методами генной технологии может представлять угрозу частной жизни индивида, если информация помещается в общедоступную базу данных. Нарушение прав человека в данном случае состоит в том, что подозреваемым становится любой, кто отказывается подвергнуться ДНК-тестированию.
Двигаться вперед или остановиться? Предлагаем поразмышлять….
Автор — Валерия Пугачева
Лещинская, И. Б. Генетическая инженерия / И. Б. Лещинская // Соросовский образовательный журнал. – 1996. – № 1. – С. 32-394.
Мохов, А. А. Использование технологии геномного редактирования: достижения и перспективы / А. А. Мохов, А. А. Чапленко, А. Н. Яворский // Биомедицина. – 2019. – Т. 15, № 2. – С. 34-42.
Молекулярные подходы к безопасной и контролируемой Т-клеточной терапии / Р. С. Калинин [и др.] // Acta Naturae. – 2018. – Т. 10, № 2. – С. 17-25.
Воронцова, З. И. Философские и социокультурные проблемы биогенных технологий / З. И. Воронцова // Новые технологии. – 2009. – № 4. – С. 13-19.
Найдыш, В. М. Философские проблемы антропогенетики генной инженерии (статья вторая) / В. М. Найдыш, Е. Н. Гнатик // Вестник РУДН. – 2009. – № 3. – С. 31-38.
Воронцов, С. А. Морально-этические проблемы развития биотехнологии / С. А. Воронцов // Вестник молодежной науки. – 2017. – Т. 5, № 12. – С. 22-27.
International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity / C. Picard [et al.] // J. Clin. Immunol. – 2018. – Vol. 38, N 1. – P. 96-128.
Первичные иммунодефициты: принципы терапии и организации медицинской помощи / Н. Chapel [et al] // Frontiers in Immunology. – 2014. – Т. 5, № 12. – С. 1-15.

- получать рекомбинантные РНК и ДНК;
- выделять гены из организма (клеток);
- осуществлять манипуляции с генами и вводить их в другие организмы.
Плазмида — внехромосомная молекула ДНК бактерий или дрожжей, как правило, кольцевая, способная к автономной репликации. В генной инженерии используется как вектор.
Значение генной инженерии для медицины
Продукты генной инженерии как‑то исподволь, но прочно вошли в медицинскую практику: лекарства для лечения редких болезней, рекомбинантный инсулин, вакцины против вируса гепатита В — без них современному врачу трудно представить себе мир. Генно-инженерными методами производят некоторые высокоселективные аллергены для кожных проб, некоторые реагенты для иммуноферментного анализа и многое другое. На этапе доклинических испытаний медикаментов приносятся в жертву миллионы генетически измененных животных.
Ниже в порядке усложнения технологии и степени отрыва от реальности представлены основные примеры применения генной инженерии в медицине.
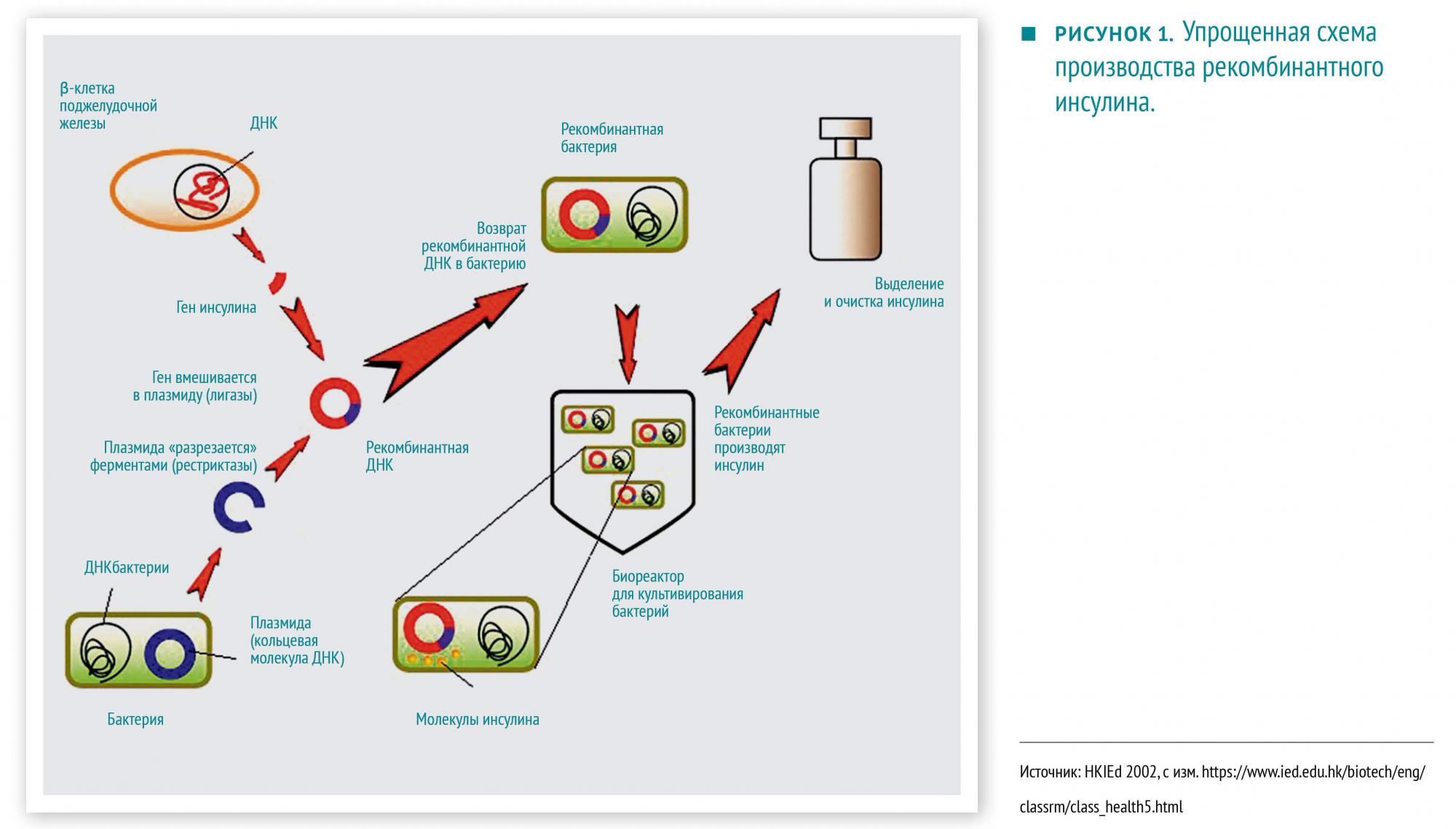
Сегодня на вооружении у врачей есть ряд препаратов, для которых критически важно точное соответствие аналогам в организме. Это препараты заместительной терапии при эндокринологических заболеваниях, гематологических болезнях (эритропоэтин, гранулоцитарный колониестимулирующий фактор, факторы свертывания крови, некоторые моноклональные антитела и др.), вирусных инфекциях (интерфероны), инфаркте миокарда и ишемическом инсульте (фибринолитики) и многих других.
- Идентичность веществ по структуре человеческим. Инсулин, производившийся из поджелудочных желез свиней и крупного рогатого скота, отличался от человеческого по одной и трем аминокислотам, соответственно, это часто приводило к нежелательным реакциям.
- Более низкая цена и удобное производство. Для получения 200 г сухого вещества того же инсулина требуется поджелудочных желез от более чем 6000 коров (или свиней). То же количество может быть произведено бактериями, содержащимися в 1000 л культуральной жидкости.
- Отказ от специфического сырья, которое полностью не очищается, например, гипофизы трупов использовались для получения соматотропного гормона, а моча женщин в менопаузе — традиционный источник фолликулостимулирующего и лютеинизирующего гормонов.
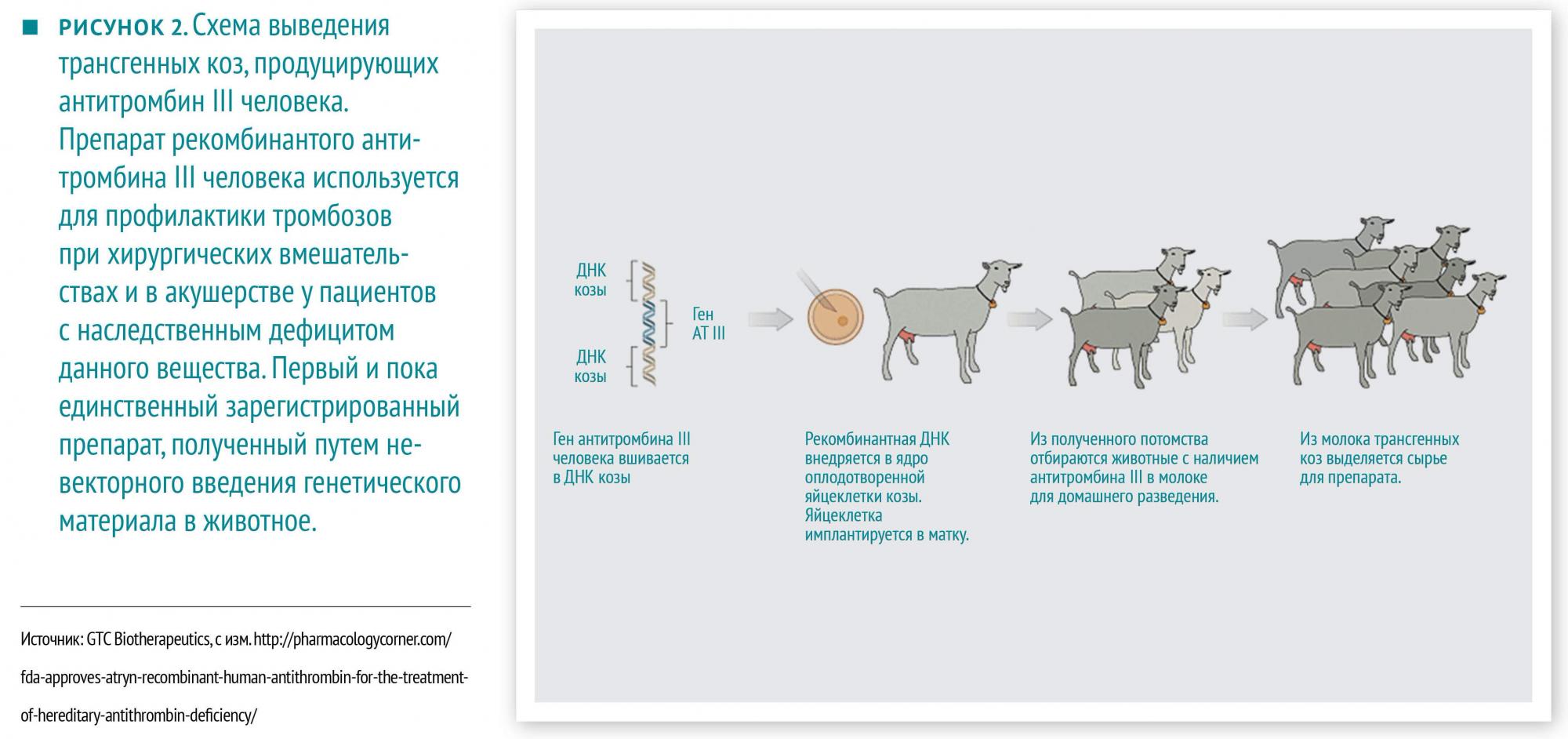
Дальнейшее развитие данной отрасли науки привело к появлению генной терапии. Тут уже всё по‑взрослому, хотя пока и экспериментально. Устраняются посредники типа бактерий, коз и бананов. Как правило, так пытаются лечить тяжелые и редкие наследственные или спорадически возникающие заболевания, патогенез которых обусловлен дефектом какого‑либо одного гена, например, первичные иммунодефициты. При этом другие методы лечения неэффективны или труднодоступны, и терять, в общем, нечего. Результаты впечатляющие, но и цена нежелательных реакций высока.
В начале 2000‑х гг. в Англии и Франции проводились клинические испытания генной терапии Х-сцепленного тяжелого комбинированного иммунодефицита, при котором нарушен синтез общего рецептора нескольких цитокинов, отвечающих за дифференцировку и пролиферацию лимфоцитов. При отсутствии аллогенной трансплантации гемопоэтических стволовых клеток дети умирают от тяжелых инфекций в 1‑й год жизни. В ходе испытаний 20 маленьким пациентам были трансплантированы собственные (то есть дефектные) стволовые клетки костного мозга, в которые был введен ретровирусный вектор, несущий ген нормального белка рецептора и вирусный промотор. Блестящие результаты — восстановление функций иммунной системы, отсутствие рецидива в течение всего периода наблюдения (4–11 лет) — были омрачены развитием Т-клеточного острого лимфобластного лейкоза у 5 детей (известно, что один ребенок погиб). Выяснилось, что ген белка и вирусный промотор у всех 5 заболевших встроились в ДНК рядом с протоонкогенами, т. е. генами, при усилении экспрессии которых возможно неконтролируемое деление клеток. Встраивание генного материала в ДНК хозяина в наше время в основном дело случая.
Первые ошибки были учтены, в настоящее время исследователи выбирают неонкогенные вирусы с известными местами встраивания в человеческую ДНК, или плазмиды.
В общем, в генной инженерии остается достаточно технологических трудностей, иммунологического несоответствия, опасности инфицирования человека вирусами животных с потенциальным появлением новых болезней. Всего этого упрямые и беспринципные ученые не очень‑то и боятся. Понятно, что у человечества хватит мозгов, чтобы как‑то решить эти проблемы, остается надеяться, что хватит ума не наделать новых.
Читайте также:

