Генетический контроль клеточного цикла кратко
Обновлено: 03.07.2024
Клетки организма находятся в одном из трех возможных состояний: в цикле, в стадии покоя с сохранением возможности вернуться в цикл и в стадии терминальной дифференцировки, при которой способность делиться полностью утрачена (нейроны головного мозга, сегментоядерные нейтрофилы).
В норме стимуляция клеточного роста (вхождение клетки в цикл) инициируется факторами роста, которые воспринимаются с помощью соответствующих рецепторов.
Последующая трансдукция сигнала от активированного рецептора до клеточного ядра осуществляется с участием многих других белков - передатчиков сигнала. Это своего рода клеточное "реле". Такая передача часто идет путем фосфорилирования одним белком второго, вторым - третьего и т.д.
Цепи передачи сигналов заканчиваются в клеточном ядре. Там происходит активация так называемых факторов транскрипции, т.е. белков, связывающихся с регуляторными участками определенных генов ДНК и активирующих транскрипцию данных генов. Иными словами, под действием факторов транскрипции на соответствующих генах происходит синтез матричных РНК, а на матрице последних - белков. Это те белки, которые нужны для роста и размножения клеток.
Стадии клеточного цикла и точки его проверки

Точки проверки клеточного цикла
(Г.П. Георгиев, 1999)
Наиболее заметными периодами цикла являются митоз (М) и синтез ДНК (фаза S), между которыми выделяются два промежуточных периода (gap) - G1 и G2. На протяжении фазы G1 существует ответственный момент: так называемая точка рестрикции (R), когда решается, войдет ли клетка в следующий цикл деления или предпочтет стадию покоя G0, в которой она может находиться неопределенно долго.
Вхождение клетки в цикл - процесс вероятностный, определяемый сочетанием ряда внешних и внутренних условий. Однако, после того, как выбор сделан, следующие этапы прохождения по циклу совершаются автоматически. И хотя клетка может быть блокирована на той или иной стадии деления, обычно это является следствием каких-то особых обстоятельств.
Критически важными в цикле являются моменты вхождения клетки в фазу синтеза ДНК (граница фаз G1/S) и в митоз (граница фаз G2/М), где действуют своеобразные контрольно-пропускные пункты "checkpoints", которые проверяют целостность ДНК (готовность к ее репликации) в первом случае и завершенность репликации - во втором.
Регуляция клеточного цикла. Роль циклинов и циклин-зависимых киназ
Взаимодействие фактора транскрипции E2F, белка Rb и циклин-зависимых киназ в регуляции клеточного цикла
(по V. Cumar, R.S. Cotran, S. L. Robbins, 1997)
Для перехода клетки в S-фазу клеточного цикла требуется взаимодействие фактора транскрипции E2F с регуляторными участками генов (гены S-фазы).
В покоящейся клетке E2F находится в комплексе (связанном состоянии) с протеином Rb (ретинобластомы) и не может осуществить эту функцию. Для этого E2F необходимо высвободить из данного комплекса, для чего требуется фосфорилирование рRb . Такое фосфорилирование обеспечивается циклин-зависимыми киназами (сdk).
Конститутивно экспрессируясь в неактивном состоянии, cdk в последующем активируются при взаимодействии с циклинами, в частности с циклином D, который синтезируется в начале фазы G1.
Активные сdk фосфорилируют рRb, который утрачивает связь с E2F, что обеспечивает клетке возможность перехода в S-фазу.
После вступления клетки в S-фазу циклин D разрушается, а сdk возвращаются в неактивное состояние.
Клеточный цикл регулируется как внутриклеточными, так и внеклеточными факторами.
Генетический контроль цикла обеспечивается семейством генов, которые обозначаются как гены клеточного деления – cdc (cell division control). Продукты этих генов представляют собой киназы - ферменты, фосфорилирующие белки по определенным аминокислотам. Поэтому гены клеточного цикла могут обозначаться также cdk (cell division kinase). Основной принцип регуляции клеточного цикла состоит в фосфорилировании и дефосфорилировании участвующих в пролиферации структурных и регуляторных белков.
Последовательность активации киназ клеточного деления определяется циклинами – регуляторными белками, концентрация которых закономерно изменяется в клеточном цикле. Например, концентрация циклина А нарастает к концу G1-периода и снижается по завершению S-периода, причем подавление репликации ДНК оксимочевиной не влияет на этот процесс. К настоящему времени обнаружено 12 циклинов, которые демонстрируют различную динамику концентрации в клеточном цикле. Наряду с комплексами Cyc/Cdk (циклин/циклинзависимая киназа) в регуляции цикла участвуют фосфатазы PP1 и PP2a, которые дефосфорилируют белки, фосфорилированные ранее киназами, циклин-активирующие киназы CAK и ингибиторы киназ CDI.
Важная роль в регуляции клеточного цикла принадлежит белку p53. Он способен узнавать специфические последовательности в ДНК и регулировать активность контролирующих пролиферацию генов. Концентрация p53 в ядре увеличивается к концу G1-периода, но резко снижается при переходе клетки в S-период. Если в клетке возникли повреждения ДНК, концентрация p53 остается на высоком уровне, клетка задерживается в конце G1-периода и не приступает к репликации ДНК до тех пор, пока повреждения не будут исправлены. Если повреждения ДНК репарировать не удалось, p53 выключает гены, блокировавшие апоптоз. Переход G1/S является первой контрольной точкой клеточного цикла (точкой рестрикции R1), в которой клетка принимает решение о репликации ДНК.
Кроме R1 в клеточном цикле есть и вторая контрольная точка - R2. Она соответствует переходу G2/M, когда клетка принимает решение о начале митоза. Главными молекулами, регулирующими начало митоза, являются фосфатаза Cdc25, а также киназы CycB/Cdk1 и weel. Фосфатаза Cdc25 способна активировать киназу CycB/Cdk1, тогда как киназа weel, наоборот, ингибирует ее. Поэтому начало митоза определяется балансом активности ферментов Cdc25 и weel.
События митоза также регулируются циклинами. В частности, циклин B (CycB) контролирует образование митотического веретена, циклин A (CycA) влияет на расхождение хроматид, а циклин B3 (CycB3) контролирует конденсацию хромосом. Для завершения митоза необходима не только определенная последовательность активации циклинзависимых киназ и фосфатаз, но также их своевременная деградация. Она контролируется APC (anaphase promoting complex) - комплексом протеаз с участием убиквитина.
Клеточный цикл регулируется также внешними по отношению к клетке молекулярными сигналами. К ним относятся гормоны, медиаторы, факторы роста, лимфокины, митогены, а также их ингибиторы.
Пролиферирующие клетки отвечают на молекулярные сигналы двух типов. Первый из них усиливает пролиферацию, вызывая переход клеток из состояния G0 в G1 и их прогрессию в клеточном цикле (так действуют многие факторы роста, например, фактор роста фибробластов ФРФ). Второй тип регуляторных белков позволяет клеткам подавлять рост их соседей (как это происходит, например, при секреции макрофагами фактора некроза опухолей ФНО).
Таким образом, в управление клеточным циклом и митозом вовлечено большое число генов. Если функция каких-либо из них утрачивается из-за мутации или нарушения экспрессии, клетки становятся нечувствительными к подавляющим их рост молекулярным сигналам, переходят в режим автономной пролиферации и могут сформировать в итоге опухоли.
Клеточный цикл регулируется как внутриклеточными, так и внеклеточными факторами.
Генетический контроль цикла обеспечивается семейством генов, которые обозначаются как гены клеточного деления – cdc (cell division control). Продукты этих генов представляют собой киназы - ферменты, фосфорилирующие белки по определенным аминокислотам. Поэтому гены клеточного цикла могут обозначаться также cdk (cell division kinase). Основной принцип регуляции клеточного цикла состоит в фосфорилировании и дефосфорилировании участвующих в пролиферации структурных и регуляторных белков.

Последовательность активации киназ клеточного деления определяется циклинами – регуляторными белками, концентрация которых закономерно изменяется в клеточном цикле. Например, концентрация циклина А нарастает к концу G1-периода и снижается по завершению S-периода, причем подавление репликации ДНК оксимочевиной не влияет на этот процесс. К настоящему времени обнаружено 12 циклинов, которые демонстрируют различную динамику концентрации в клеточном цикле. Наряду с комплексами Cyc/Cdk (циклин/циклинзависимая киназа) в регуляции цикла участвуют фосфатазы PP1 и PP2a, которые дефосфорилируют белки, фосфорилированные ранее киназами, циклин-активирующие киназы CAK и ингибиторы киназ CDI.
Важная роль в регуляции клеточного цикла принадлежит белку p53. Он способен узнавать специфические последовательности в ДНК и регулировать активность контролирующих пролиферацию генов. Концентрация p53 в ядре увеличивается к концу G1-периода, но резко снижается при переходе клетки в S-период. Если в клетке возникли повреждения ДНК, концентрация p53 остается на высоком уровне, клетка задерживается в конце G1-периода и не приступает к репликации ДНК до тех пор, пока повреждения не будут исправлены. Если повреждения ДНК репарировать не удалось, p53 выключает гены, блокировавшие апоптоз. Переход G1/S является первой контрольной точкой клеточного цикла (точкой рестрикции R1), в которой клетка принимает решение о репликации ДНК.
Кроме R1 в клеточном цикле есть и вторая контрольная точка - R2. Она соответствует переходу G2/M, когда клетка принимает решение о начале митоза. Главными молекулами, регулирующими начало митоза, являются фосфатаза Cdc25, а также киназы CycB/Cdk1 и weel. Фосфатаза Cdc25 способна активировать киназу CycB/Cdk1, тогда как киназа weel, наоборот, ингибирует ее. Поэтому начало митоза определяется балансом активности ферментов Cdc25 и weel.
События митоза также регулируются циклинами. В частности, циклин B (CycB) контролирует образование митотического веретена, циклин A (CycA) влияет на расхождение хроматид, а циклин B3 (CycB3) контролирует конденсацию хромосом. Для завершения митоза необходима не только определенная последовательность активации циклинзависимых киназ и фосфатаз, но также их своевременная деградация. Она контролируется APC (anaphase promoting complex) - комплексом протеаз с участием убиквитина.
Клеточный цикл регулируется также внешними по отношению к клетке молекулярными сигналами. К ним относятся гормоны, медиаторы, факторы роста, лимфокины, митогены, а также их ингибиторы.
Пролиферирующие клетки отвечают на молекулярные сигналы двух типов. Первый из них усиливает пролиферацию, вызывая переход клеток из состояния G0 в G1 и их прогрессию в клеточном цикле (так действуют многие факторы роста, например, фактор роста фибробластов ФРФ). Второй тип регуляторных белков позволяет клеткам подавлять рост их соседей (как это происходит, например, при секреции макрофагами фактора некроза опухолей ФНО).
Таким образом, в управление клеточным циклом и митозом вовлечено большое число генов. Если функция каких-либо из них утрачивается из-за мутации или нарушения экспрессии, клетки становятся нечувствительными к подавляющим их рост молекулярным сигналам, переходят в режим автономной пролиферации и могут сформировать в итоге опухоли.
Сайт использует файлы cookie. Продолжая пользоваться нашим сайтом, вы соглашаетесь на использование нами ваших данных.
Узнать больше

Вступление
В статье о контрольных точках клеточного цикла мы рассмотрели причины, которые влияют на переход к различным фазам клеточного цикла, факторы, которые клетка учитывает при принятии решения о том, следует ли продвигаться дальше по клеточному циклу. К таким факторам относятся как внешние сигналы (например, молекулярные сигналы), так и внутренние сигналы (например, повреждение ДНК).
Подобные сигналы действуют путем изменения активности регуляторов клеточного цикла ядра внутри клетки. Регуляторы клеточного цикла клетки могут запускать ключевые процессы, такие как репликация ДНК или разделение хромосом. Они также контролируют правильный порядок выполнения событий клеточного цикла и то, что одна фаза (например, G1) запускает начало следующей фазы (например, S).
В этой статье мы рассмотрим некоторые из наиболее важных регуляторов основного клеточного цикла: белки, называемые циклинами, ферменты - циклин-зависимые киназы (Cdks), и комплекс ферментов - анафаза стимулирующего комплекса (APC/C).
Циклины
Циклины — это группа родственных белков, одни из наиболее важных регуляторов клеточного цикла ядра. И у людей, и у большинства других эукариот существует четыре основных типа: G1-циклины, G1/S-циклины, S-циклины и М-циклины.
Как следует из названия, каждый циклин связан с определенной фазой, переходом или набором фаз в клеточном цикле и помогает управлять событиями этой фазы или периода. Например, M-циклин способствует событиям фазы M, таким как разрушение ядерной оболочки и конденсация хромосом [1,2].
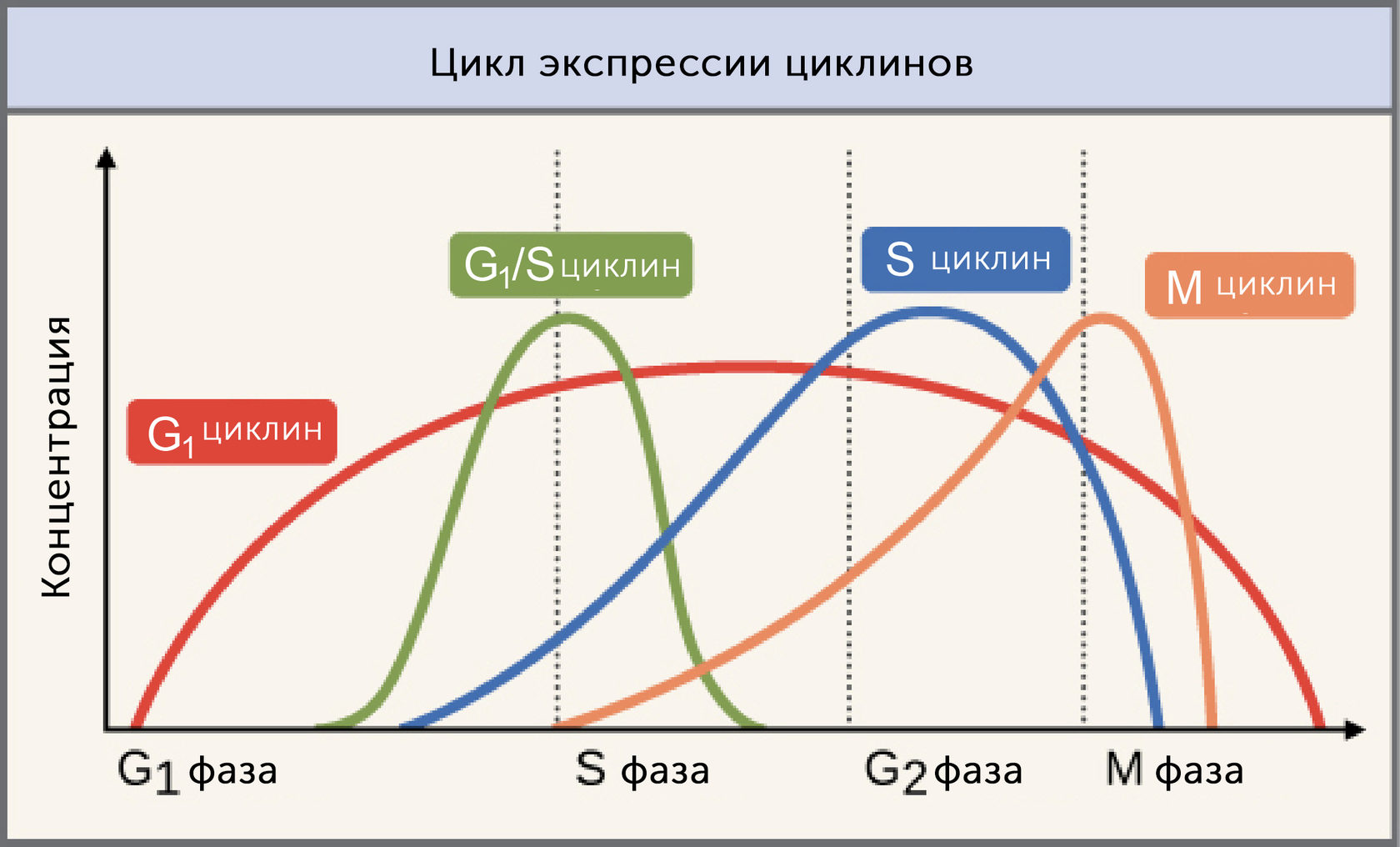
Уровни разных циклинов значительно различаются в зависимости от фазы клеточного цикла, как показано на диаграмме выше. Так, концентрация циклинов остается низкой в течение большей части цикла, но сильно возрастает на стадиях, где они необходимы. М циклин, например, резко достигает пика при переходе от G2 в фазу М1. Циклины необычны тем, что они необходимы для большей части клеточного цикла.
Циклин-зависимые киназы (Cdks)
Чтобы продвигать клеточный цикл вперед, циклин должен активировать или инактивировать многие целевые белки внутри клетки. Циклины управляют событиями клеточного цикла, сотрудничая с семейством ферментов, называемых циклин-зависимыми киназами (Cdks). Сам по себе Cdk неактивен, но, связавшись с циклином, активируется, становясь функциональным ферментом, и приобретает способность модифицировать целевые белки.
Как это работает? Cdks — это киназы, ферменты, которые фосфорилируют (присоединяют фосфатные группы) к специфическим белкам-мишеням. Присоединенная фосфатная группа действует как переключатель, делая целевой белок более или менее активным. Когда циклин присоединяется к Cdk, он создает два важных эффекта: активирует Cdk в качестве киназы, и направляет Cdk к определенному набору белков-мишеней, разному для разных фаз клеточного цикла, контролируемого каждым конкретным циклином. Например, G1/S-циклины посылают Cdks к мишеням S-фазы (например, стимулируя репликацию ДНК), тогда как M-циклины посылают Cdks к мишеням M-фазы (например, разрушая ядерную мембрану).
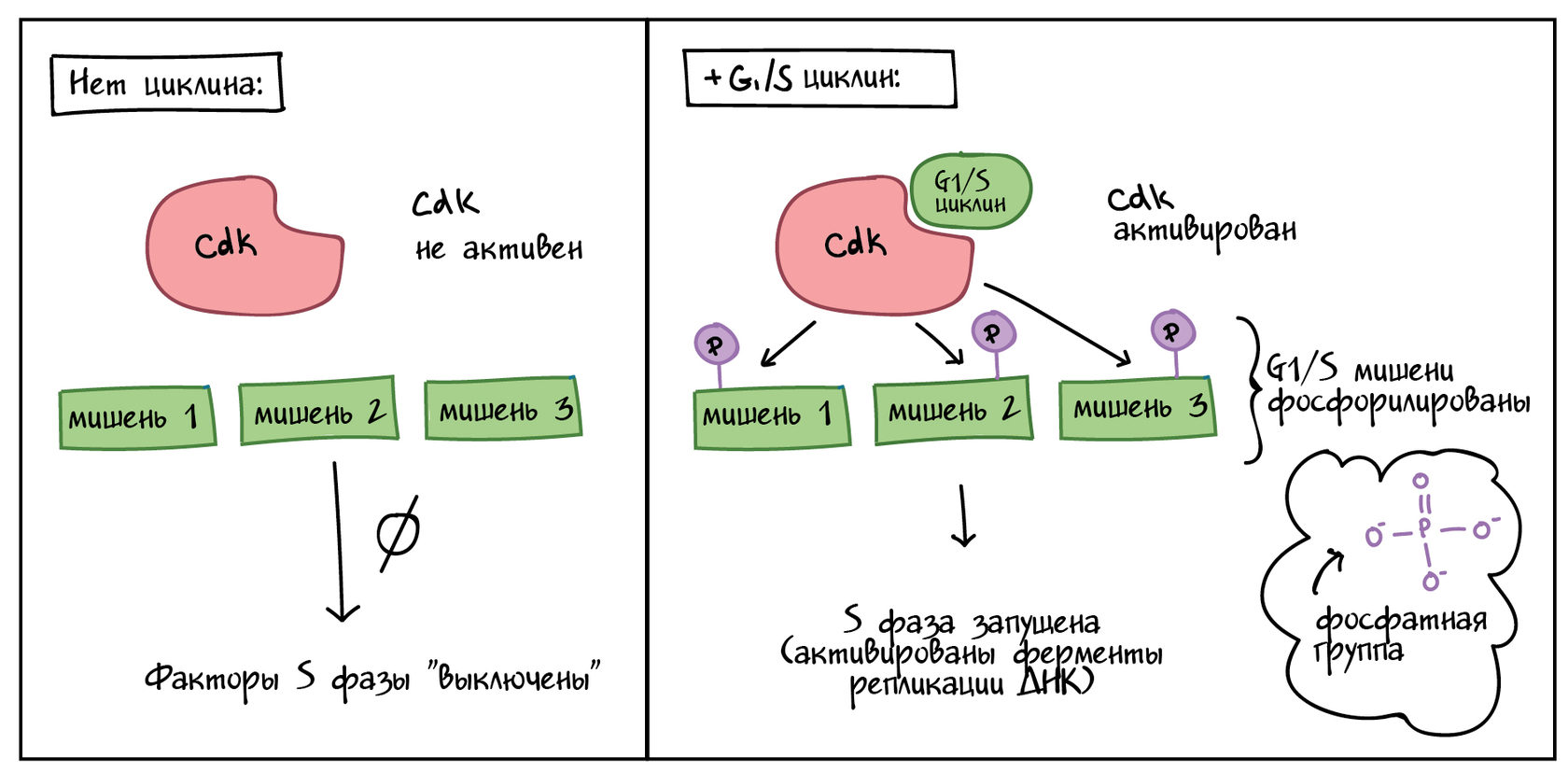
В целом, уровни Cdk остаются относительно постоянными по всему клеточному циклу, но активность Cdk и целевые белки изменяются по мере того, как уровни различных циклинов растут и падают. В дополнение к тому, что Cdks нуждается в связывании с циклином, он также должен быть фосфорилирован на определенном сайте, чтобы активироваться (не показано на диаграммах в этой статье), и может также негативно регулироваться фосфорилированием других сайтов [3,4].
Фактор, способствующий созреванию (MPF)
Известный пример того, как циклины и Cdks работают вместе, контролируя переходы клеточного цикла, — это фактор, способствующий созреванию (MPF). Название восходит к 1970-м годам, когда исследователи обнаружили, что клетки в фазе М содержат неизвестный фактор, который может заставить яйцеклетки лягушки (которая остановилась в G2, фазе) перейти в фазу М. Эта загадочная молекула, названная MPF, была открыта в 1980-х годах как Cdk, связанная со своим партнером M-циклином [7].
MPF — это хороший пример того, как циклины и Cdks могут работать вместе, чтобы управлять переходом клеточного цикла. Как и типичный циклин, M-циклин остается на низком уровне в течение большей части клеточного цикла, но его концентрация увеличивается, когда клетка приближается к G2/М-переходу. По мере накопления M-циклина он связывается с Cdks, уже присутствующими в клетке, образуя комплексы, которые готовы запустить M-фазу. Как только эти комплексы получают дополнительный сигнал (по сути, полностью четкое подтверждение того, что ДНК клетки не повреждены), они становятся активными и приводят в движение события фазы М [7].
Комплексы MPF добавляют фосфатные метки к нескольким различным белкам в ядерной оболочке, что приводит к ее расщеплению (ключевое событие ранней М-фазы), а также активируют мишени, способствующие конденсации хромосом и другим событиям М-фазы. Роль MPF в разрушении ядерной оболочки показана в упрощенной форме на диаграмме ниже.
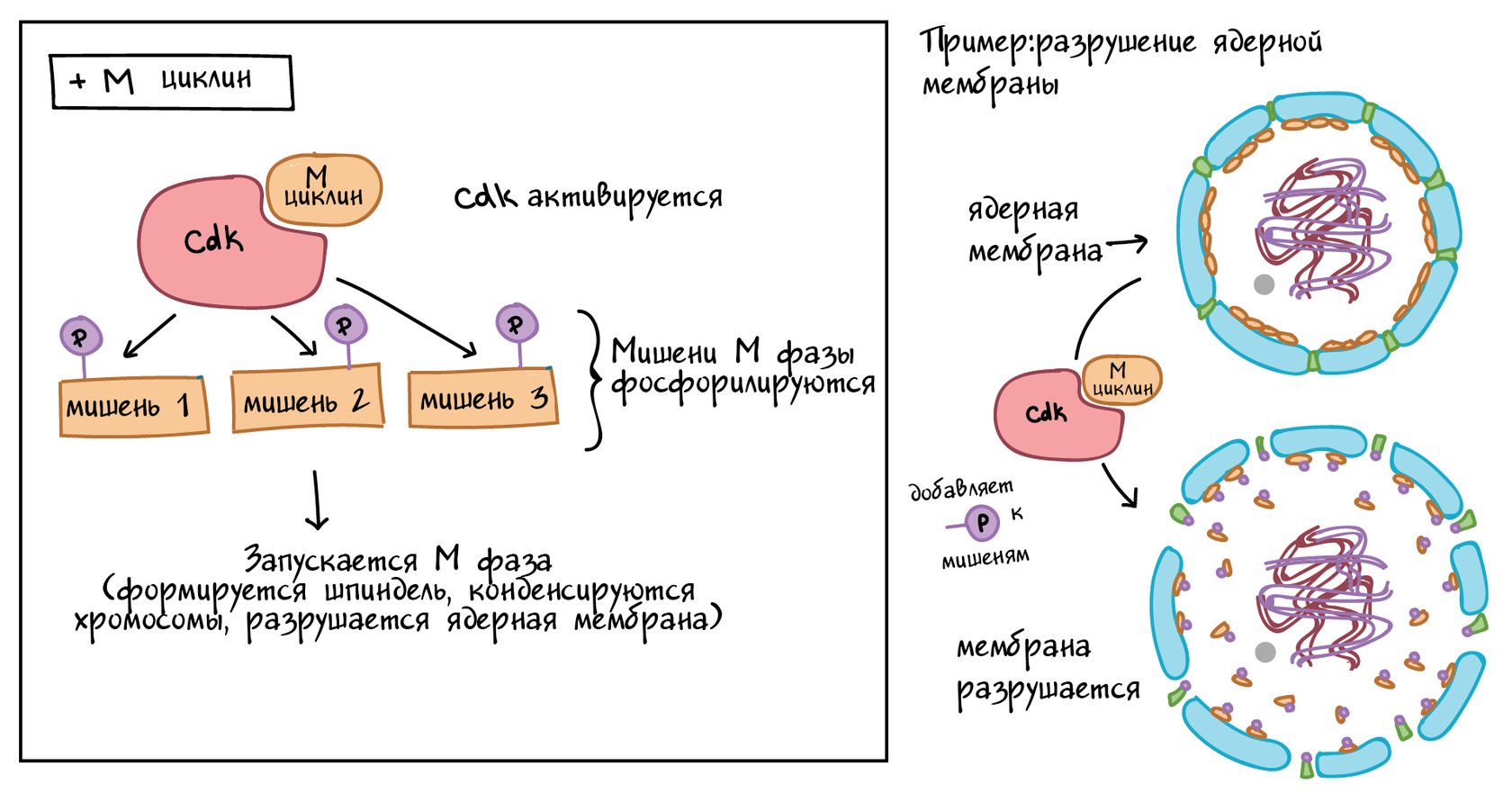
Упрощенная схема, показывающая, как Cdk и M cyclin объединяются в MPF.
Левая панель: комплекс MPF фосфорилирует различные мишени, специфичные для М-фазы, а фосфорилированные мишени вызывают образование веретена, конденсацию хромосом, разрушение ядерной мембраны и другие события ранней М-фазы.
Правая панель: конкретный пример MPF, вызывающего разрушение ядерной оболочки. Комплекс MPF фосфорилирует белки в ядерной оболочке, что приводит к фрагментации ядерной мембраны на везикулы (и высвобождению некоторых белков из мембраны).
Анафаза-стимулирующий комплекс/циклосома (APC/C)
В дополнение к управлению событиями М-фазы, MPF также запускает собственное разрушение, активируя комплекс, стимулирующий анафазу/циклосому (APC/C), белковый комплекс, который вызывает разрушение М-циклинов во время начала анафазы. Разрушение М-циклинов выводит клетки из митоза, позволяя новым дочерним клеткам войти в фазу G1. APC/C также вызывает разрушение белков, которые удерживают сестринские хроматиды вместе, позволяя им разделится в анафазе и переместиться к противоположным полюсам клетки.
Как APC/C выполняет свою работу? Как и Cdk, APC/C является ферментом, но имеет другой тип функций, чем Cdk. Вместо того, чтобы прикреплять фосфатную группу к своим мишеням, он добавляет небольшую белковую метку под названием убиквитин (Ub). Когда цель помечена убиквитином, она отправляется в протеасому (которую можно рассматривать как мусорную корзину клетки) и уничтожается. Например, APC/C прикрепляет метку убиквитина к М-циклинам, вызывая их расщепление протеасомой и позволяя вновь образующимся дочерним клеткам входить в G1-фазу [8].
APC/C также использует убиквитиновые метки для запуска отделения сестринских хроматид во время митоза. Если APC/C получает правильные сигналы в метафазе, он запускает цепь событий, которая разрушает когезин, белковый клей, который удерживает сестринские хроматиды вместе [8,9].
APC/C сначала добавляет метку убиквитина к белку, называемому секурин, и отправляет его на переработку. Секурин обычно связывает и инактивирует белок, называемый сепараза(сепарин).
Когда секурин отправляется на переработку, сепараза становится активной и может выполнять свою работу. Сепараза в свою очередь измельчает когезин — белок, который удерживает сестринские хроматиды вместе, таким образом сепараза разделяет сестринские хроматиды.

Контрольные точки и регуляторы
Cdks, cyclins и APC/C являются прямыми регуляторами клеточных циклов, но они не всегда управляют процессом. Вместо этого они реагируют на сигналы внутри и снаружи клетки. Эти сигналы влияют на активность регуляторов ядра, чтобы определить, можно ли клетке двигаться вперед в клеточном цикле. Положительные сигналы, такие как факторы роста, обычно увеличивают активность Cdks и циклинов, в то время как отрицательные сигналы, такие как повреждение ДНК, обычно уменьшают или блокируют их активность.
р53 работает на нескольких уровнях, чтобы гарантировать, что клетки не передадут свою поврежденную ДНК дочерним клеткам после деления [3].
Во-первых, он останавливает клеточный цикл в контрольной точке G1, запуская производство белков-ингибиторов Cdk (CKI). Белки CKI связываются с комплексами Cdk-циклинов и блокируют их активность (см. диаграмму ниже), выигрывая время для восстановления ДНК.
Вторая задача p53 — активировать ферменты репарации ДНК.
Если повреждение ДНК не поддается устранению, р53 приступает к исполнению своей третьей и последней роли — запуску программируемой клеточной гибели, чтобы поврежденная ДНК не передавалась дальше.
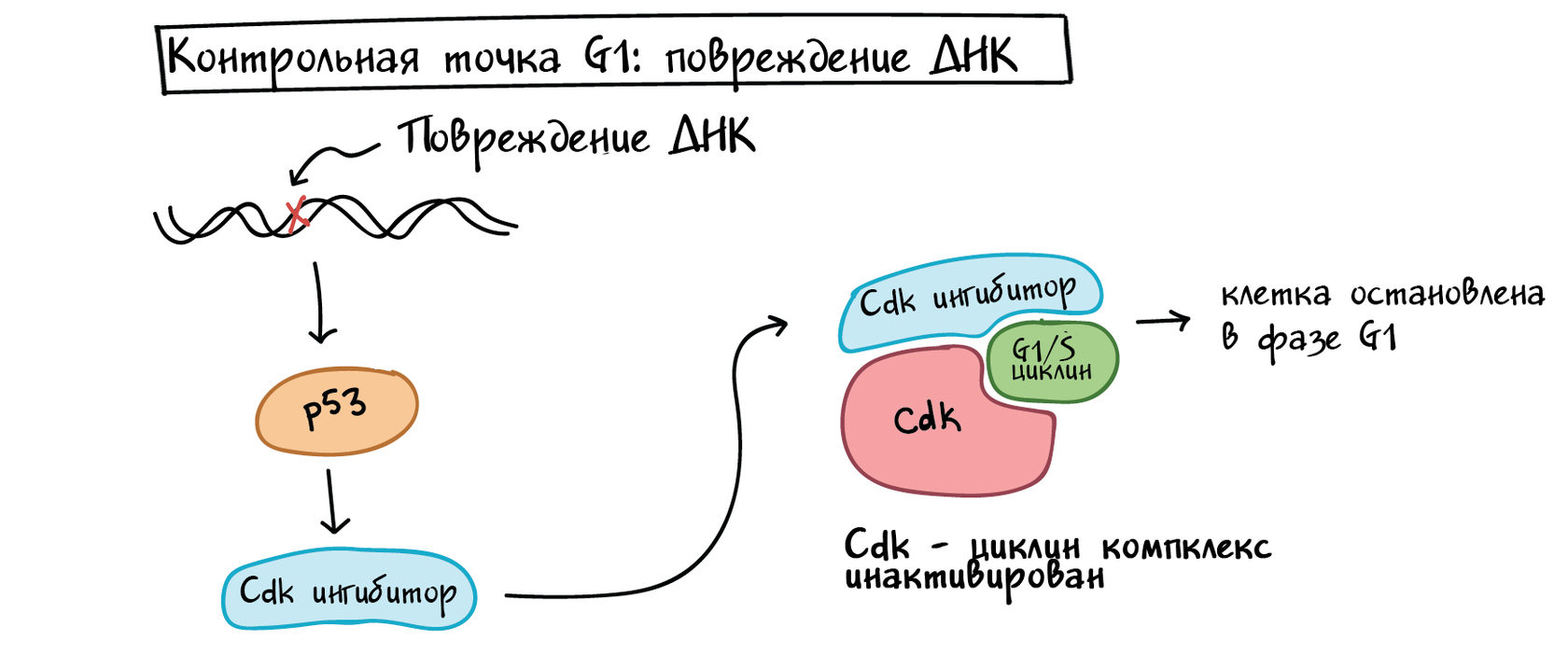
Упрощенная схема того, как p53 останавливает клеточный цикл на контрольной точке G1/S. Р53 активируется повреждением ДНК и вызывает выработку ингибитора Cdk, который связывается с циклиновым комплексом Cdk-G1/S и инактивирует его. Это останавливает клетку в фазе G1 и не позволяет ей войти в S-фазу, давая время для устранения повреждения ДНК.
Гарантируя, что клетки не делятся, когда их ДНК повреждена, p53 предотвращает передачу мутаций (изменений в ДНК) дочерним клеткам. Когда p53 дефектен или отсутствует, мутации могут быстро накапливаться, что может привести к раку. Действительно, из всего человеческого генома р53 является единственным геном, наиболее часто мутирующим при раке [11]. p53 и регуляция клеточного цикла являются ключевыми объектами изучения для исследователей, работающих над новыми методами лечения рака.
Клеточный цикл контролируется путем взаимодействия трех типов
белков: циклинзависимые киназы (Cdk), циклины
- белки, взаимодействующие с Cdk c образованием комплексов
и ингибиторы комплексов Cdk-циклин.
Циклинзависимые киназы (Cdk) - ферменты фосфорилирующие другие
белки, изменяют их функцию. Клеточный цикл контролируется изменением
активности Cdk, которая регулируется периодическим образованием
и распадом их регуляторных субъединиц - циклинов. Смена синтезов
и разрушений различных циклинов обеспечивает переходы и протекания
различных фаз клеточного цикла. При этом концентрация Cdk
постоянна в течении всего клеточного цикла. В разные фазы
клеточного цикла образуются разные циклины, которые связываясь
с Cdk образуют различные Cdk-циклиновые комплексы. Эти комплексы
регулируют разные фазы клеточного цикла и поэтому называются
G1-, G1/S- , S- и М-Cdk (рис.1).
рис.1 Концентрации различных комплексов Cdk-циклин
в клеточном цикле.
Контрольные точки клеточного цикла
1. Точка выхода из G1-фазы, называемая
Старт - у млекопитающих и точкой рестрикции
у дрожжей. После перехода через точку рестрикции R в конце
G1 наступление S становится необратимым, т.е. запускаются
процессы ведущие к следующему делению клетки.
2.
Точка S – проверка точности репликации.
3.
Точка G2/M-перехода – проверка завершения репликации.
4. Переход от метафазы к анафазе митоза.
Контроль различных этапов клеточного
цикла
ARC подавляет S- и M-циклины и не подавляет G1/S-циклины.
В G1-фазе работают различные ингибиторы Cdk.
Внутренние и внешнии сигналы приводят к образованию G1/S-
и S-циклинов и активации G1/S–Cdks.
Активность G1/S–Cdk увеличивается потому что G1/S циклины
не атакуются APC и потому что G1
Cdk ингибиторы так же не действуют на G1/S–Cdks
(у мух и дрожжей) или удаляются от G1/S–Cdks другими
механизмами (у млекопитающих).
S-Cdk инактивирует ингибиторы Cdk и подавляет ARC, которые
в G1-фазе подавляли S-Cdk. S-Cdk фосфорилируют
различные белки, что ведет к началу дупликации ДНК и S-фазы.
После начала S-фазы S/G1-Cdk обеспечивают собственную
инактивацию.
В конце S-фазы, в G2-фазе начинают накапливаться
М-Cdk, приводящая к вступлению клетки в митоз. М-Cdk активирует
ARC-комплекс, управляющий метафазно-анафазным переходом. Основная
функция ARC-комплекса состоит в разрушении когезинов, приводящее
к началу расхождения хромосом
Циклин зависимые киназы Cdk1-5 в клетках млекопитающих
Cdks активируется при связывании с циклинами (так же как фосфориляция
и дефосфориляция киназ). Cdks-фосфорилируют белки участвующие
в кл цикле
M-phase Cdk (M-Cdk) запускают каскад белковых фосфориляций,
запускающих М-фазу к.ц. (конденсация хромосом, разрушение
ядра, перестройка АГ иЭР, потеря адгезии с большинством других
клеток и внеклеточному матриксу, реорганизация цитоскелета)
anaphase-promoting complex (APC) регулятор митоза – инициация
разделения и расхождения хромосом и инактивация М-Cdk в конце
митоза
При выходе из G0 под действием факторов роста начинает
синтезироваться Cdk2-циклинD: распознает в-ва, регулирующие
ферменты синтеза белков, необходимых для репликации ДНК. В
это же время выявляются Cdk4-циклинD, и Cdk5циклинD
циклин-cdks
запускает М-стадию кц, деградация циклина снижает активность
cdks
Cdk2-циклинE появляется в G1 и достигает max
на границе G1-S, после чего его концентрация
резко снижается
Cdk2-циклинА появляется в промежутке G1-S и присутствует
в высокой концентрации на протяжении S
Сdk2-циклинB в конце G2 до М – резко разрушается
в каждой стадии синтезируются свои циклины M-циклины запускают
события митоза, G1/S-циклины – связывают цзк
в конце G1 подготавливает кл к S-фазе, S-циклины
– связывают цзк, запуская репликацию, G1-циклины
обеспечивают прохождение через точку рестрикции.
Регуляция репликации
Перед началом репликации Sc ORC-комплекс (origin recognition
complex) садится на ori - точку начала репликации. Cdc6 представлен
во всем клеточном цикле, но его концентрация возрастает вначале
G1, где он связывается c ОRC комплексом, к которому затем
присоединяются Mcm белки с образованием pre-replicative complex
(pre-RC). После сборки pre-RC клетка готова к репликации.
Для инициации репликации S-Cdk соединяется с протеинкиназой
(?), которая фосфорилирует pre-RC. При этом Cdc6 диссоциирует
от ОRC после начала репликации и фосфорилируется, после чего
убиквитинируется SCF и деградирует. Изменения в pre-RC препятствуют
повторному запуску репликации. S-Cdk так же фосфорилирует
некоторые Mcm белковые комплексы, что запускает их экспорт
из ядра. Последующая дефосфориляция белков вновь запустит
процесс образования pre-RC.
Регуляция митоза
В эмбриональных клетках синтез М-циклина постоянен во всем
клеточном цикле и накопление его происходит из-за уменьшения
деградации. У большинства клеток М-циклин синтезируется во
время G2 и М-фаз. Накопление циклина ведет к накоплению M-Cdk.
Cdk ингибируется, фосфорилируясь протеинкиназой Wee1. Активация
Cdc25 в поздней G2 дефосфорилирует M-Cdk, так же происходит
репрессия Wee1. Две протеинкиназы фосфорилируют Cdc25 – Polo
kinase и M-Cdk. M-Cdk так же фосфорилирует и ингибирует Wee1.
Способность M-Cdk активировать свой собственный активатор
(Cdc25) и ингибировать свой собственный ингибитор (Wee1) предполагает,
что активация M-Cdk в митозе резко усиливается при наличии
такой позитивной обратной связи. Малое количество активированных
Cdc25 активируют M-Cdk, которые активирует еще больше Cdc25
и супрессируют Wee1. Это приводит к большей дефосфориляции
M-Cdk и активации и тд. Такой механизм обеспечивает полную
активацию всех M-Cdk
Фосфорилирование ламинов M-Cdk приводит к их деградации. М-Cdk
фосфорилирует несколько субъединиц конденсинов, запуская конденсацию
хромосом.
M-Cdk фосфорилирует различные белки, запуская реорганизацию
микротрубочек и другие события ведущие к организации веретена
деления.
Циклин-зависимые
киназы
G1/S, S, возможно М
G1/S, S, возможно М
В животных клетках имеются, по крайней мере, 7 различных
Cdk. Cdk1,2,4,6 напрямую участвуют в регуляции клеточного
цикла, тогда как остальные фосфорилируют другие Cdk и называются
Cdk-активирующие киназы (CAK).
Cdk7,8,9 являются регуляторами РНК полимеразы II. Cdk5 участвует
в дифференцировке нервных клеток.
У дрожжей Sc и Sp все события клеточного цикла контролируются
одной Cdk1. У многоклеточных организмов события контролируются
Cdk1 и Cdk2. Также у высших эукариот имеются Cdk4 и Cdk6
которые регулируют клеточный цикл в ответ на внеклеточные
сигналы.
Cdk фосфорилируют сотни различных белков по сериновым (S)
или треониновым (T) аминокислотным остаткам. Cdk узнает
мотиф другого белка по которому необходимо фосфорилировать:
[S/T*]PX[K/R], где S/T*- место фосфорилирования, X – любая
аминокислота, K/R-основные аминокислоты лизин (K) или аргинин
(R).
В отсутствии циклина активный центр Cdk заблокирован.
Cdk состоит из нескольких доменов: Т-петля (инактивирующая
петля) – закрывает активный центр в отсутствии циклина.
L12 helix, PSTAIRE helix.
Циклины
| Вид | G1 | G1/S | S | M |
| S.cerevisiae | Cln3 |
Циклины - цитоплазматические белки. Разрушение циклинов
происходит в протеосомах (см. обзор Протеасомы). Циклин
B – белок киназный домен, регуляторная субъединица. Начинает
синтезироваться в G1, достигает max в S и ранней профазе
и быстро разрушается в начале анафазы М. Когда концентрация
регуляторной субъединицы возрастает – активируется киназный
домен. Фосфорилирование специфических белков приводит к
компактизации х-м, разрушению ядерной об-ки и сборке веретена.
Циклин фосфорилирует сериновые и треониновые остатки ламинов
вызывая их деполимеризацию, фосфорилирует гистон H1, участвует
в фосфорилировании блокирующим везикулярный транспорт –
разрушение ЭПР и АГ, фосфорилирует участок легкой цепи миозина,
ингибируя АТФ-азную активность и связывание с F-актином
– блокировка цитокинеза в раннем митозе. После разрушения
циклина белки дефосфорилируются.
Циклины – активаторы Cdk. Циклины, так же как и Cdk вовлечены
в различные, помимо контроля клеточного цикла, процессы.
Циклины разделяются на 4 класса в зависимости от времени
действия в клеточном цикле: G1/S, S, M и G1 циклины.
G1/S циклины (Cln1 и Cln2 у S. cerevisiae, циклин E у позвоночных)
достигает максимальной концентрации в поздней G1-фазе и
падает в S-фазе.
G1/S cyclin–Cdk комплекс запускает начало репликации ДНК
выключая различные системы подавляющие S-phase Cdk в G1-фазе
G1/S циклины также инициируют дупликацию центросом у позвоночных,
образование веретенного тела у дрожжей. Падение уровня G1/S
сопровождается увеличением концентрации S циклинов (Clb5,
Clb6 у Sc и циклин A у позвоночных), который образует S
циклин-Cdk комплекс который напрямую стимулирует ДНК репликацию.
Уровень S циклина остается высоким в течении всей S, G2-фаз
и начала митоза, где помогает началу митозу в некоторых
клетках.
М-циклины (Clb1,2,3 и 4 у Sc, циклин B у позвоночных) появляется
последним. Его концентрация увеличивается, когда клетка
переходит к митозу и достигает максимума в метафазе. М-циклин-Cdk-комплекс
включает сборку веретена деления и выравнивание сестринских
хроматид. Его разрушение в анафазе приводит к выходу из
митоза и цитокиезу.
G1 циклины (Cln3 у Sc и циклин D у позвоночных) помогает
координировать клеточный рост с входом в новый клеточный
цикл. Они необычны, так как их концентрация не меняется
от фазы клеточного цикла, а меняется в ответ на внешние
регуляторные сигналы роста.
APC комплекс (Anaphase-Promoting Complex)
Убиквитин лигаза митоза - APC состоит из 12 субъединиц и регулирует
различные процессы митоза, такие как разделение сестринских
хроматид (запускает разрушение когезинов), переход к анафазе,
анафазное расхождение хромосом, выход из митоза, разрешение
S-фазы. ARC разрушает митотический циклин B.
Имеются различные белки регулирующие активность ARC комплекса,
такие как Mps1, Bub1, Bub3, BubR1, Mad1 и Mad2. Они ингибируют
ARC комплекс, что ведет к остановке клеточного цикла в метафазе
митоза.
• CDK являются основными регуляторами клеточного цикла и активны, только находясь в комплексе с другими белками-циклинами
• Циклины получили свое название потому, что в процессе клеточного цикла их уровень в клетке периодически меняется
• На разных фазах клеточного цикла CDK может образовывать комплекс с разными циклинами
Клеточный цикл контролируется центральной системой контроля. Ключевым компонентом этой системы является небольшое семейство протеинкиназ, которые называются циклин-зависимыми киназами, или CDKs. Эта киназа представляет собой комплекс, состоящий из двух полипептидов. Один из них, CDK, связывает АТФ и содержит активный центр.
Однако он обладает киназной активностью, только будучи связан с другим полипептидом, называемым циклином. На рисунке ниже показано, что связывание с циклином вызывает конформационнные изменения в молекуле CDK, в результате которых субстрат получает доступ к каталитическому центру. Активность каждого комплекса CDK с циклином изменяется таким образом, что проявляется только в определенные фазы клеточного цикла, а в остальное время комплекс остается в неактивном состоянии.
Различные протеинкиназы проявляют активность в различные фазы клеточного цикла. Некоторые активны в G1 период, другие в момент репликации клеточной ДНК, а остальные — в митозе. В течение относительно недолгого периода активности, каждая киназа фосфорилирует большое количество белков, что приводит либо к их активации и к запуску основных событий клеточного цикла, либо к ингибированию их активности, при котором предотвращается повторение предыдущего события цикла. Например, CDK, которая инициирует митоз, фосфорилирует белки ламиньг, при этом происходит разрушение ядерной оболочки. Также фосфорилируется большой набор других белков, которые регулируют сборку митотического веретена.
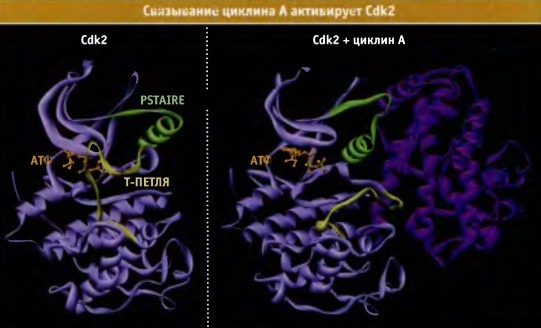
Связывание циклина с CDK вызывает в последней конформационные изменения.
Т-петля изменяет свое положение, что обеспечивает доступ субстратов.
Также происходит реориентация боковых цепей некоторых аминокислот,
в результате чего индуцируются изменения, необходимые для переноса фосфатных групп.
Впервые CDK были идентифицированы при изучении cdc дрожжевых мутантов. При секвенировании ДНК гена cdc2+ S. pombe оказалось, что он гомологичен гену CDC28 почкующихся дрожжей Saccharomyces cerevisiae. Фактически было показано, что ген почкующихся клеток может функционально заменить ген делящихся дрожжей. Иными словами, когда этот ген трансфецировали в клетки мутанта дрожжей cdc2ts, они могли расти при непермиссивной температуре. Это говорило о том, что исследователи имели дело с ортологическими белками, т. е. с белками, разделяющими одну и ту же функцию. Затем было показано, что эти белки являются протеинкиназами.
Когда методом генетической комплементации с использованием мутанта cdc2 S. pombe был выделен гомолог этого гена, присутствующий в клетках человека (CDC2), стало очевидно, что киназа является сохранившимся в эволюции регулятором митоза. Это предположение стимулировало дальнейший поиск общих белков, участвующих в контроле цикла в различных клетках, и общих принципов регуляции деления клеток эукариот. В остальной части настоящей главы, для обозначения киназного гена, вместо названия с учетом того или иного организма (cdc2, CDC28, CDC2) мы будем использовать его общее название Cdk1.
При исследовании деления эмбриональных клеток морского ежа и моллюска в начале 1980-х гг. Тим Хант и другие сотрудники из лаборатории Джоан Рудерман отметили периодические изменения в содержании белков, уровень которых снижался одновременно с наступлением деления. Позже эти белки были названы циклины. Такие периодические колебания в изменении уровня белков обнаруживались только в исследованиях на отдельных клектах или на популяции клеток, синхронно вступающих в цикл.
Изменения уровня белков были выражены очень сильно; накопление белков происходило в интерфазе за счет их синтеза, и затем содержание их резко падало в результате протеолиза, как раз перед началом расхождения хромосом при наступлении анафазы. Появление и исчезновение двух белков происходили синхронно с клеточным циклом и в каждом делении. Такая периодичность появления циклина говорит о том, что он образует комплекс с CDK, и поэтому киназа активна лишь в определенные краткие периоды каждого клеточного цикла.
Дальнейший прогресс в выяснении роли CDKs и циклинов был достигнут после проведения элегантных оригинальных исследований контроля клеточного цикла у Xenopus laevis. Был идентифицирован фактор, способствующий созреванию (maturationpromoting/actor, MPF). Он обладал активностью, обусловливающей мейотичес-кое созревание ооцитов лягушки. Последующая очистка фактора и его биохимическая характеристика показали, что он состоит из Cdk1 и циклина. Сейчас известно, что активность MPF резко увеличивется и столь же резко снижается при каждом митозе или мейозе. Это схематически показано на рисунке ниже. Резкое снижение уровня белка обусловлено протеолизом циклина, а увеличение частично объясняется повышением его содержания. Идентификации MPF способствовало обнаружение того факта, что аналогичные белки контролируют клеточный цикл у всех эукариот.
Для организации клеточного цикла у некоторых организмов достаточно одного циклина и одной CDK. Например, в клетках дрожжей S. pombe присутствует только одна CDK и только один вид циклина, и один и тот же CDK-циклиновый комплекс вызывает переходы G1/S и G2/M. Эти данные не согласуются с точкой зрения о том, что CDK-циклиновые комплексы вызывают только один переход. Поэтому предполагается, что для прохождения клетки через два перехода необходимы различные уровни CDK-циклиновой активности.
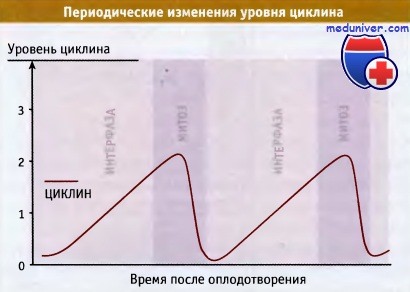
Ученые обнаружили первые циклины, когда они заметили,
что повышенный их уровень связан с наступлением митоза в эмбриональных клетках.
После завершения митоза уровень циклина резко падает.
При более низком уровне активности наступает S-фаза, а при более высоком наступает митоз. Поскольку уровень циклина в клетке со временем увеличивается, такой механизм позволяет запускать переход клеток в S-фазу и в митоз, причем это происходит в правильной последовательности, и с участием одного и того же CDK-циклинового комплекса.
У большинства организмов на протяжении каждого клеточного цикла действует много циклинов, причем эти разные белки появляются и исчезают на разных стадиях. При этом, в зависимости от названия фазы клеточного цикла, в течение которой они присутствуют, циклины подразделяются на три класса: G1-циклины, ответственные за продвижение цикла от фазы G1 к S-фазе; S-фазные циклины, которые необходимы для инициации репликации ДНК; и М-фазные, или митотические, циклины, инициирующие митоз. Во многих клетках находится более одного представителя каждого класса циклинов; даже такие простые эукариоты, как дрожжи S. cerevisiae, содержат девять различных циклинов. Все девять взаимодействуют с одной и той же каталитической субъединицей.
Поскольку каталитическая субъединица в каждом CDK комплексе одна и та же, циклиновые субъединицы должны не только активировать субъединицу киназы, но также распознавать белки, которые необходимо фосфорилировать.
У Метазоа различные классы циклинов обычно обозначают буквами. Циклин D связан с G1, а циклины А и Е с S-фазой. Циклины А и В связаны с митозом.
Наряду со многими классами циклинов, для большинства многоклеточных эукариот характерно присутствие нескольких представителей каждого класса (которые обозначаются циклин B1, В2 и т. д.). Таким образом, общее количество циклинов достаточно велико. Например, геном человека, кодирует, по меньшей мере, 12 циклинов, которые участвуют в регуляции клеточного цикла. Зачем клетке так много циклинов? Сейчас накоплено много данных, полученных на большом количестве организмов, которые свидетельствуют о том, что большое количество вариантов циклинов обеспечивает разные способы их регулировки.
Так, некоторые циклины обнаруживаются только в определенных участках клетки, например в ядре, или в центросоме, в то время как другие присутствуют не во всех, а лишь в некоторых тканях животных. Уровень циклинов также может регулироваться во времени, т. е. различные циклины, характерные для какой-либо одной фазы цикла, могут, в зависимости от времени, либо появляться, либо исчезать. Смысл такой регуляции пока не вполне ясен, но возможно, что она необходима для того, чтобы клеточный цикл соответствовал типу клеток. Таким образом, для крупных животных, для которых характерно присутствие многих типов клеток, необходимо большое количество циклинов.
Хотя различные представители семейства циклинов появляются в различное время цикла и в различных участках клетки, они обладают общими молекулярными свойствами. В первичной структуре у них присутствует последовательность, состоящая примерно из 150 аминокислот, которая называется циклиновый домен. Эта последовательность представляет собой область, посредством которой циклин связывется с каталитической субъединицей CDK. Вне циклинового домена первичная последовательность циклинов существенно варьирует по составу, хотя многйе циклины содержат там гидрофобный участок, участвующий в узнавании субстрата. Несмотря на различия, среди циклинов существует значительная функциональная избыточность, и один циклин может заменить другой, хотя и не всегда с одинаковым результатом. Такая избыточность впервые была обнаружена у дрожжей и сейчас показана для клеток мышей. Например, в отсутствие циклина Е, мыши развиваются и живут нормально. Не исключено поэтому, что другие циклины компенсируют потерю этого циклина, участвующего в инициации S-фазы, хотя обычно они не выполняют присущие ему функции.
В клетках Метазоа также содержится несколько циклин-зависимых киназ. Киназа CDK1 играет важную роль в митозе, a CDK2, CDK4 и CDK6 участвуют в ранних фазах клеточного цикла. Большинство киназ связывается с одним или двумя различными циклинами, причем для каждой CDK существует свой набор циклинов. Поэтому в тот или иной момент времени в клетке находится много разных CDK-циклиновых комплексов. Разные сочетания субъединиц CDK и циклинов позволяют достигнуть очень тонкой регуляции в определенные моменты жизни клетки и в определенном месте. Это относится как к отдельной клетке, так и к многоклеточному организму. Также следует иметь в виду, что для каждого CDK-цик-линового комплекса существует определенный набор субстратов. Стадии цикла клеток млекопитающих, в которых действуют различные CDK-циклины, показаны на рисунке ниже, справа.
Подводя итог изложенному выше, подчеркнем, что переход клеток в разные стадии цикла регулируется CDK-циклиновыми комплексами. Циклины представляют собой белки, уровень которых в клетке меняется в зависимости от фаз цикла. Таким образом, специфичность различных фаз клеточного цикла определяется активностью CDK, которая регулируется циклинами.
Изменения уровня MPF в митотическом цикле позволяют предполагать,
что он служит регулятором митоза. В клетках делящихся дрожжей различные переходы в клеточном цикле контролируются единственным CDK-циклиновым комплексом (Cdk1-циклин В) (левый рисунок),
в то время как в клетках млекопитающих эти же задачи выполняют различные CDK-циклиновые комплексы (правый рисунок). График, иллюстрирующий положение, согласно которому различные пороговые значения активности одной Cdk1 стимулируют различные процессы в цикле делящихся дрожжевых клеток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

