Где применяются алкены в жизни кратко
Обновлено: 30.06.2024
Предельные углеводороды находят широкое применение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы (метан и пpопан-бутановая смесь) используются в качестве ценного топлива.
Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей.
Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) - пpозpачная жидкость без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь твеpдых алканов С19-С35) - белая твеpдая масса без запаха и вкуса (tпл= 50-70°C) - пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т. д.
Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти.
Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.
В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
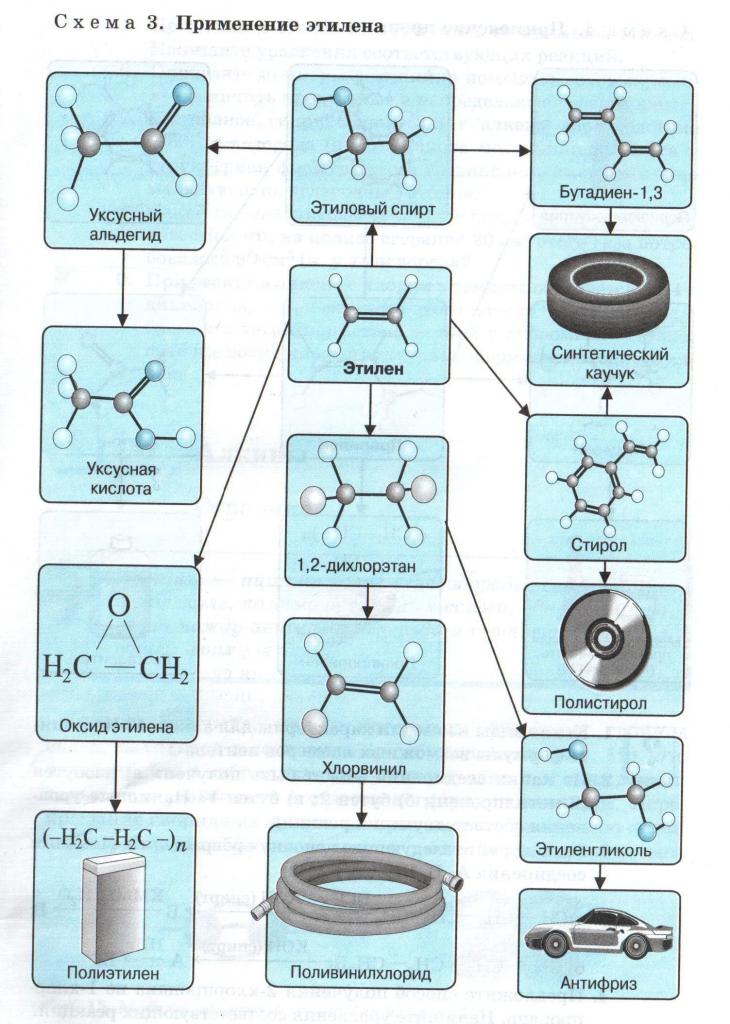
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона) , этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений. Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С (СН3)2 применяется в производстве синтетического каучука.
К углеводородным соединениям класса алкенов относятся вещества, обладающие высокой реакционной способностью. Это свойство дает возможность получать из алкенов важные продукты, в которых нуждаются различные отрасли от транспорта до фармацевтической промышленности. Широкое и массовое применение алкенов является причиной постоянного роста их производства.
Получение алкеновых углеводородов
Главный источник сырья для алкенов – предельные углеводороды, выделяемые из нефти, нефтяных попутных газов и природного газа, а также их производные.
Основные способы получения алкенов в промышленности
- Высокотемпературная переработка горючих полезных ископаемых.
- Пиролиз.
Процесс пиролиза (термического разложения) высокомолекулярных алканов и циклоалканов проводится при и давлениях порядка (близких к атмосферному), без доступа воздуха. Реакция протекает быстро, в течение .

Пиролиз – распространенный способ получения наиболее востребованных алкенов – этилена и пропилена.

Отличие крекинга от пиролиза состоит в более низкой рабочей температуре процесса (450 — 550℃ 450 — 550℃) и в большей длительности, однако при этом требуется повышенное давление .

Крекингом нефти и газойля получают значительную часть бутилена, изобутилена и более высокомолекулярных алкенов.
При термической обработке каменного угля образуется коксовый газ, содержащий этилен. В ряде случаев его выделение оказывается экономически выгодным и производится в промышленных масштабах.

Нагревание алканов до на катализаторе приводит к отнятию водорода:

Лабораторный синтез алкенов
Алкены получают в лаборатории с помощью таких методов, как:
Отщепление гидроксогруппы OHOH и водорода HH от молекулы спирта протекает при 150℃ и выше в присутствии сильного водопоглощающего агента, например, концентрированной серной или фосфорной кислоты:

Данный способ может применяться и для промышленного синтеза в том случае, если стоимость этанола, получаемого из сельскохозяйственного сырья, оказывается ниже, чем у нефтепродуктов.
- Дегалогенирование и дегидрогалогенирование галогенпроизводных алканов.
Если в дигалогеналкане галогенизированы атомы углерода, расположенные в молекулярной цепочке рядом, они могут быть отщеплены с образованием алкена цинком либо другим активным металлом – магнием:
От молекулы моногалогеналкана возможно отнятие водорода и галогена щелочью, растворенной в спирте. В результате отщепления в молекуле возникает двойная связь:

Водород отщепляется от наименее гидрированного углеродного атома в молекуле галогеналкана (правило Зайцева).
В присутствии специального катализатора Линдлара алкины гидрируются до алкенов:

Полное гидрирование приводит к образованию алканов.
Области применения алкенов
В качестве химического сырья или конечного продукта алкены широко востребованы в промышленности.

Синтез полимеров
Из этилена и его производных получают полиэтилен, тефлон (политетрафторэтилен), полистирол, поливинилхлорид; из пропилена – полипропилен. Этилен и пропиленгликоли, получаемые окислением соответствующих алкенов, используются в производстве полиуретанов.
Из этилен-пропиленовых эластомеров изготавливают резины и изоляционные материалы. Бутен (бутилен) представляет собой сырье для получения изопрена, бутадиена, изобутилена, продуктами полимеризации которых являются каучуки.
Производство горюче-смазочных материалов и антифризов
В качестве добавок к бензинам применяются:
- этилбензол;
- изопропилбензол, или кумол (получают на основе пропена);
- изооктан (синтезируют с использованием бутена).


Производные этилена и изобутилена входят в состав машинных масел. Многоатомные спирты этиленгликоль и пропиленгликоль используются как основа для антифризов.
Бутилен содержится в газовых смесях для сварки и резки металлов.
Производство растворителей
Этилен служит сырьем для синтеза диоксана, дихлорэтана и трихлорэтилена – органических растворителей широкого назначения.

Другой распространенный растворитель – бутанон, или метилэтилкетон – получают из бутена.
Сельское хозяйство
Дихлорэтан применяют также для обеззараживания семян и помещений сельскохозяйственного назначения. В сельском хозяйстве используется и непосредственно этилен как растительный гормон, особенно в качестве стимулятора роста и созревания плодов.
Фармацевтическое производство
Широкое применение в медицине находят производные пропена – изопропанол и глицерин как эффективные антисептики, компоненты препаратов для лечения кожных заболеваний и растворители. Глицерин также предотвращает высыхание вязких препаратов – мазей, паст – и способствует увеличению срока их годности. Он входит в состав противоожоговых и противокашлевых средств.

Получаемый из этилена диэтиловый эфир применяется в медицинской практике как препарат для общего наркоза и местной анестезии.

Пищевая и легкая промышленность
Путем окисления этилена на катализаторе получают уксусный альдегид, являющийся сырьем для производства уксусной кислоты.

Текстильная промышленность также использует глицерин для обработки волокон и тканей.

Алкены состава применяются в производстве поверхностно-активных веществ в составе моющих средств, препаратов для обработки текстиля и другой продукции.
Разнообразие сфер применения алкенов и их производных можно представить в схематическом виде:

Заключение
Алкены вследствие высокой реакционной способности относятся к веществам, мало распространенным в природе. Исключение – этилен, вырабатываемый в растительных тканях. Однако большие объемы производства алкенов для удовлетворения потребностей разных отраслей превращают алкены в широко распространённый вид химического сырья.
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.

Этилен ускоряет созревание овощей и фруктов (помидоров, дынь, апельсинов, мандаринов, лимонов, бананов) при введении небольших количеств его в воздух теплиц.
Дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.

Полиэтилен используется для изготовления упаковочной пленки, посуды, труб, электроизоляционных материалов.
Этиленгликоль используется в производстве охлаждающих жидкостей и теплоносителей.

Пропилен в промышленности применяется, в основном, для синтеза полипропилена. Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
Полипропилен по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Волокно из полипропилена прочнее всех известных синтетических волокон.
Бутилены применяют для производства бутадиена, изопрена, полиизобутилена, бутилкаучука, метилэтилкетона.
Изобутилен — сырье для получения бутилкаучука, изопрена, трет-бутанола; используется для алкилирования фенолов при синтезе ПАВ. Его сополимеры с бутенами применяют как присадки к маслам и герметики.
Высшие алкены С10-С18 применяют при синтезе ПАВ, а также для получения высших спиртов.
В органической химии можно встретить углеводородные вещества с разным количеством углерода в цепи и C=C-связью. Они являются гомологами и называются алкенами. Из-за своего строения они химически более активны, чем алканы. Но какие именно реакции для них характерны? Рассмотрим их распространение в природе, разные способы получения и применение.
Что из себя представляют?
Алкены, которые также называются олефинами (маслянистые) получили свое название от этен-хлорида, производного первого представителя этой группы. У всех алкенов есть хотя бы одна двойная C=C-связь. CnH2n - формула всех олефинов, а название образовывается от алкана с таким же количеством углеродов в молекуле, только суффикс -ан меняется на -ен. Арабской цифрой в конце названия через дефис обозначают номер углерода, от которого начинается двойная связь. Рассмотрим основные алкены, таблица поможет вам запомнить их:
Если молекулы имеют простое неразветвленное строение, то добавляют суффикс -илен, это также отражено в таблице.
Где их можно встретить?
Так как реакционная способность алкенов весьма высока, их представители в природе встречаются крайне редко. Принцип жизни молекулы олефинов — "давай дружить". Нет вокруг других веществ — не беда, будем дружить между собой, образуя полимеры.
Но они есть, и небольшое количество представителей входит в состав сопутствующего нефтяного газа, а высших — в нефти, добываемой на территории Канады.
Самый первый представитель алкенов этен — это гормон, стимулирующий созревание плодов, поэтому его в небольших количествах синтезируют представители флоры. Есть алкен цис-9-трикозен, который у самок мухи домашней играет роль полового аттрактанта. Еще его называют мускалур. (Аттрактант — вещества природного или синтетического происхождения, которое вызывает влечение к источнику запаха у другого организма). С точки зрения химии, алкен этот выглядит так:
Так как весьма ценным сырьем являются все алкены, способы получения их искусственным путем весьма разнообразны. Рассмотрим наиболее распространенные.
А если нужно много?
В промышленности класс алкенов, в основном, получается при крекинге, т.е. расщеплении молекулы под воздействием высоких температур, высших алканов. Для реакции необходим нагрев в диапазоне от 400 до 700 °C. Расщепляется алкан так, как ему захочется, образуя алкены, способы получения которых мы рассматриваем, с большим количеством вариантов строения молекул:
Еще один распространенный способ называется дегидрирование, при котором от представителя ряда алкана в присутствии катализатора отделяют молекулу водорода.
В лабораторных условиях алкены и способы получения отличаются, они основаны на реакциях элиминирования (отщепления группы атомов без их замещения). Чаще всего элиминируются атомы воды из спиртов, галогены, водород или галогенводород. Наиболее распространенный способ получения алкенов — из спиртов в присутствии кислоты, как катализатора. Возможно использование и других катализаторов
Все реакции элиминирования подчинены правилу Зайцева, гласящему:
Атом водорода отщепляется от того углерода, соседствующего с углеродом, несущим группу -OH, у которого меньше водородов.
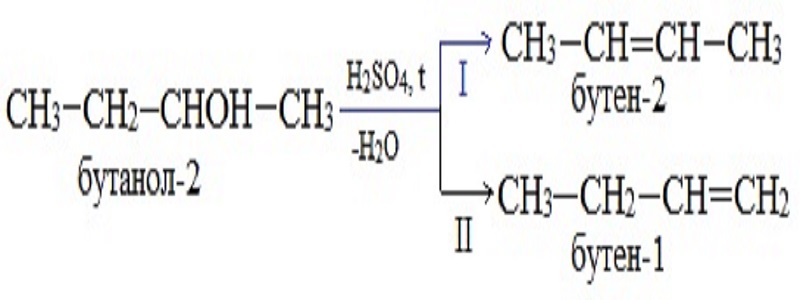
Применив правило, ответьте, какой продукт реакции будет преобладать? Позже вы узнаете, правильно ли ответили.
Химические свойства
Алкены активно реагируют с веществами, разрывая свою пи-связь (еще одно название связи C=C). Ведь она не такая прочная, как одинарная (сигма-связь). Углеводород из ненасыщенного превращается в насыщенный, не образуя других веществ после реакции (присоединение).
Далее перечислены самые распространенные реакции алкенов, которые проводятся в разных видах деятельности человека:
- присоединение водорода (гидрирование). Присутствие катализатора и нагревания нужна для ее прохождения;
- присоединение молекул галогенов (галогенирование). Является одной из качественных реакций на пи-связь. Ведь при реакции алкенов с бромной водой, она из бурой становится прозрачной;
- реакция с галогенводородами (гидрогалогенирование);
- присоединение воды (гидратация). Условиями прохождения реакции является нагревание и присутствие катализатора (кислоты);
Реакции несимметричных олефинов с галогенводородами и водой подчиняются правилу Марковникова. А значит, водород присоединится к тому углероду из двойной углерод-углеродной связи, у которого уже больше атомов водорода.
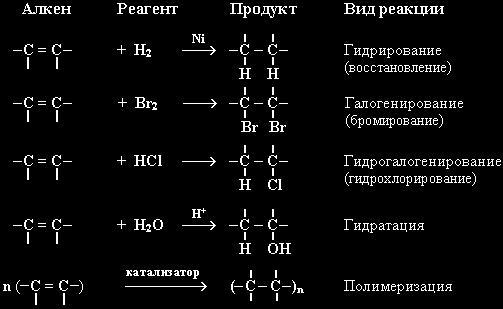
- горение;
- неполное окисление каталитическое. Продуктом являются циклические оксиды;
- реакция Вагнера (окисление перманганатом в нейтральной среде). Эта реакция алкенов — еще одна качественная C=C-связь. При протекании розовый раствор марганцовки обесцвечивается. Если ту же реакцию провести в соединенной кислой среде, продукты будут уже другими (карбоновые кислоты, кетоны, углекислый газ);
- изомеризация. Характерны все виды: цис- и транс-, перемещение двойной связи, циклизация, скелетная изомеризация;
- полимеризация — главное свойство олефинов для промышленности.
Применение в медицине
Большое практическое значение имеют продукты реакции алкенов. Многие из них используются в медицине. Из пропена получают глицерин. Этот многоатомный спирт является прекрасным растворителем, причем, если его использовать вместо воды, растворы будут более концентрированными. В медицинских целях в нем растворяют алкалоиды, тимол, йод, бром и др. Также глицерин применяют при приготовлении мазей, паст и кремов. Он предотвращает их высыхание. Сам по себе глицерин является антисептиком.
При реакции с хлороводородом получаются производные, которые применяются как местная анестезия при нанесении на кожу, а также для кратковременного наркоза при незначительных хирургических вмешательствах, при помощи ингаляций.
Алкадиены — это алкены с двумя двойными связями в одной молекуле. Основное их применение — производство синтетического каучука, из которого потом изготавливают различные грелки и спринцовки, зонды и катетеры, перчатки, соски и многое другое, что просто незаменимо при уходе за больными.
Применение в промышленности
производство тефлона, этилового спирт, уксусная кислота
Более широкое применение нашли алкены и их производные в промышленности. (Где и как используются алкены, таблица выше).

Это лишь малая часть использования алкенов и их производных. С каждым годом потребность в олефинах только возрастает, а значит, возрастает потребность и в их производстве.
Алкены (олефины) — непредельные углеводороды, содержащие в структуре молекулы одну двойную связь.
Второе название — олефины —алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Общая формула
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Физические свойства
- обладают резким запахом;
- отсутствует цвет;
- нерастворимы в воде.
Алкенам присущи реакции присоединения, проходящие по двойной связи.
Применение
- производство пластмасс, пакетов, пленок, упаковок,
- использование в получении полимеров, эфиров, спирта, каучука.
Уравнения реакций, характеризующих химические свойства алкенов
Способы получения алкенов
Реакции присоединения алкенов
Реакции присоединения галогенводородов происходят согласно правилу Марковникова.
Исключением является реакция бромоводорода с участием пероксида водорода (перекисный эффект Хараша).
При присоединении хлороводорода HCl к пропилену атом водорода преимущественно присоединяется к атому углерода группы \(СН_2=\) , поэтому преимущественно образуется 2-хлорпропан.
Читайте также:

