Физические свойства многоатомных спиртов кратко
Обновлено: 02.07.2024
Напомним, что многоатомные спирты – это органические соединения, в молекулах которых содержится несколько гидроксильных групп. Общая формула многоатомных спиртов — CnH2n+1(OH)k, где n и k – целые числа более 2. Классификация, строение, изомерия и номенклатура спиртов рассмотрены раннее в соответствующем разделе. В настоящем разделе рассмотрим свойства и получение многоатомных спиртов.
Важнейшие представители многоатомных спиртов содержат от двух до шести гидроксильных групп. Двухатомные спирты (гликоли) или алкандиолы, содержащие две гидроксильные группы в своей молекуле, трехатомные спирты (алкантриолы) – три гидроксильные группы. Четырех-, пяти- и шестиатомные спирты (эритриты, пентиты и гекситы) содержат 4, 5 и 6 ОН-групп соответственно.
Физические свойства многоатомных спиртов
Многоатомные спирты хорошо растворяются в воде и спиртах, хуже в других органических растворителях. Спирты с небольшим числом углеродных атомов представляют собой вязкие сладковатые на вкус жидкости. Высшие члены ряда — твердые вещества. По сравнению с одноатомными спиртами они имеют более высокие плотности и температуры кипения. Тривиальные названия, названия по систематической номенклатуре и физические свойства некоторых спиртов представлены в таблице:
![физические свойства многоатомных спиртов]()
Получение многоатомных спиртов
Получение гликолей
Гликоли могут быть получены практически всеми способами получения одноатомных спиртов. Выделим основные:
Получение глицерина
За счет разрыва С2-С3 связи образуется небольшое количество этиленгликоля и треита (стереоизомер эритрита).
Помимо глюкозы каталитическому гидрированию можно подвергнуть и другие полисахариды, содержащие глюкозные звенья, например, целлюлозу.

4. Гидролиз жиров щелочью проводят с целью получения мыла (калиевые или натриевые соли сложных карбоновых кислот): Такой процесс называется омылением.
Получение четырехатомных спиртов (эритритов)
В природе эритрит (бутантетраол-1,2,3,4) содержится как в свободном виде, так и виде сложных эфиров в водорослях и некоторых плесневых грибах.

Искусственно его получают из бутадиена-1,4 в несколько стадий:

Пентаэритрит (тетраоксинеопентан) в природе не встречаются. Синтетически можно получить при взаимодействии формальдегида с водным раствором ацетальдегида в щелочной среде:
Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов сходны со свойствами одноатомных спиртов. Однако наличие в молекулах многоатомных спиртов нескольких гидроксильных групп увеличивает их кислотность. Поэтому они могут вступать в реакции с щелочами и с гидроксидами тяжелых металлов, образуя соли.
Замещение второй гидроксогруппы этиленгликоля происходит труднее (под действием РСl5 или SOCl2 – замещение происходит легче).
- Взаимодействие с кислотами ведет к образованию сложных эфиров:

Взаимодействие с азотной кислотой
Данные соединения являются взрывчатыми веществами. Тринитроглицерин, кроме этого, используют в медицине в качестве лечебного препарата.

Взаимодействие с уксусной кислотой
Обычно в качестве R выступает терефталевая кислота. Продуктом такой реакции является терилен, лавсан:


При дегидратации этиленгликоля получается соединение, имеющее 2 таутомерные формы (кето-енольная таутомерия):

Дегидратация этиленгликоля может происходить с одновременной его димеризацией:

Диэтиленгликоль далее может опять вступить в реакцию с этиленгликолем, в результате чего образуется 1,4-диоксан (сильнейший печеночный яд!):

При дегидратации 1,4-бутандиола можно получить тетрагидрофуран (оксолан):

Дегидратация других гликолей сопровождается процессом пинаколиновой перегруппировки:
- Окисление многоатомных спиртов приводит к образованию альдегидов или кетонов.

При окислении этиленгликоля вначале получается гликолевый альдегид, далее глиоксаль, который при дальнейшем окислении переходит в дикарбоновую кислоту:

При окислении глицерина образуется смесь соответствующего альдегида и кетона:
Многоатомные спирты содержат в своих молекулах несколько гидроксильных групп, связанных с разными атомами углерода. Двухатомные спирты называют гликолями; простейший представитель — этиленгликоль. Простейший трёхатомный спирт — глицерин.
Этиленгликоль и глицерин — это жидкие вязкие бесцветные вещества, смешивающиеся с водой в любых соотношениях. Их температуры кипения — \(197,6\)°C и \(290\)°C. Физические свойства многоатомных спиртов обусловлены образованием водородных связей между их молекулами, а также с молекулами воды.
Этиленгликоль — ядовитое вещество. Глицерин имеет сладковатый вкус, гигроскопичен. Он входит в состав жиров и постоянно присутствует в нашем организме.
![]()
Этиленгликоль используется для приготовления антифризов — смесей, не замерзающих на морозе. Он также служит сырьём для производства полиэтилентерефталата (ПЭТФ), из которого производят волокно лавсан, а также пластиковые бутылки, плёнки, контейнеры для еды.

Глицерин используют в фармацевтической и косметической промышленности для изготовления мазей и кремов (как вещество, смягчающее кожу), а также в производстве тканей и выделке кож. Из него получают сосудорасширяющее лекарство нитроглицерин. Нитроглицерин находит также применение как взрывчатое вещество.
44. Многоатомные спирты
Особенности строения многоатомных спиртов:
1) содержат в молекуле несколько гидроксильных групп, соединенных с углеводородным радикалом;
2) если в молекуле углеводорода заменены гидроксильными группами два атома водорода, то это двухатомный спирт;
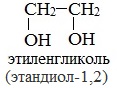
3) простейшим представителем таких спиртов является этиленгликоль (этандиол-1,2):
4) во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода;
5) для получения спирта, в котором хотя бы две гидроксильные группы находились бы при одном атоме углерода, проводилось много опытов, но спирт получить не удалось: такое соединение оказывается неустойчивым.
Физические свойства многоатомных спиртов:
1) важнейшие представители многоатомных спиртов – это этиленгликоль и глицерин;
2) это бесцветные сиропообразные жидкости сладковатого вкуса;
3) они хорошо растворимы в воде;
4) эти свойства присущи и другим многоатомным спиртам, например этиленгликоль ядовит.
Химические свойства многоатомных спиртов.
1. Как вещества, которые содержат гидроксильные группы, многоатомные спирты имеют сходные свойства с одноатомными спиртами.
2. При действии галогеноводородных кислот на спирты происходит замещение гидроксильной группы:
3. Многие спирты обладают и особыми свойствами: многоатомные спирты проявляют более кислые свойства, чем одноатомные и легко образуют алкоголяты не только с металлами, но и с гидроксидами тяжелых металлов. В отличие от одноатомных спиртов, многоатомные спирты реагируют с гидроксидом меди, давая комплексы синего цвета (качественная реакция на многоатомные спирты).

4. На примере многоатомных спиртов можно убедиться, что количественные изменения переходят в изменения качественные: накопление гидроксильных групп в молекуле обусловило в результате их взаимного появления у спиртов новых свойств по сравнению с одноатомными спиртами.
Способы получения и применения многоатомных спиртов: 1) подобно одноатомным спиртам, многоатомные спирты могут быть получены из соответствующих углеводородов через их галогенопроизводные; 2) наиболее употребительный многоатомный спирт – глицерин, он получается расщеплением жиров, а в настоящее время все больше синтетическим способом из пропилена, который образуется при крекинге нефтепродуктов.
Многоатомные спирты (полиспирты, полиолы) – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
Многоатомные спирты — соединения, у которых две или несколько гидроксильных групп расположены у соседних атомов углерода.
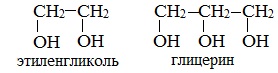
Важнейшими представителями многоатомных спиртов являются двухатомный спирт этандиол-1,2 (этиленгликоль), и трехатомный спирт пропантриол-1,2,3 (глицерин):
Существуют многоатомные спирты, содержащие и большее количество групп -ОН в молекуле, например, пятиатомный спирт ксилит, который используют в качестве заменителя сахара:
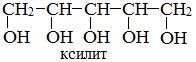
или шестиатомный спирт гексанол (сорбит):
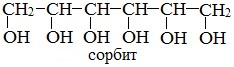
Двухатомные спирты, содержащие две гидроксильные группы -ОН, называются гликолями, или диолами, трехатомные спирты, содержащие три гидроксильные группы, — глицеринами, или триолами.
I. Гликоли (диолы)
Этиленгликоль С2Н4(ОН)2 — представитель предельных двухатомных спиртов - гликолей.
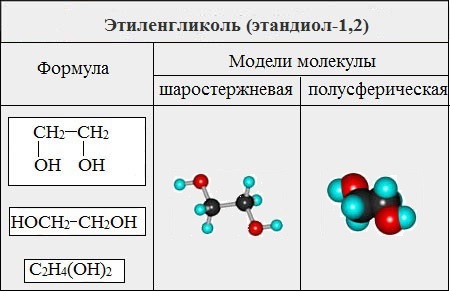
II. Глицерины (триолы)
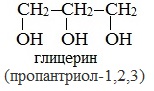
Глицерин (С 3 Н 5 ОН) 3 — простейший представитель трехатомных предельных спиртов - глицеринов .
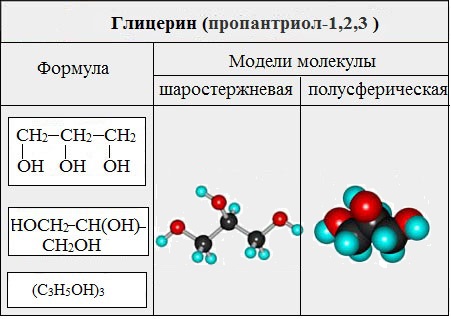
Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
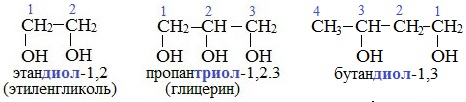
Физические свойства
Этиленгликоль — сиропообразная, вязкая бесцветная жидкость, tпл = 11,5 0 C, tкип = 197,6 0 C. Этиленгликоль гигроскопичен, смешивается с водой и этиловым спиртом в любых отношениях. Он сильно понижает температуру замерзания воды, поскольку раствор этиленгликоля в воде имеет низкую температуру замерзания (60%-ый раствор замерзает при -49 0 С).
Этиленгликоль используется также для производства синтетического волокна полиэфирного волокна – лавсана.
Этиленгликоль очень токсичен! Это сильный яд! Этиленгликоль вызывает длительное угрожающее жизни угнетение центральной нервной системы и поражение почек. Продуктами его превращения в организме являются щавелевая кислота и другие не менее ядовитые соединения. Он имеет спиртовой запах, в связи, с чем может быть принят за этиловый спирт и стать причиной тяжелых отравлений.

Глицерин – бесцветная, вязкая, сиропообразная жидкость, сладкая на вкус. Не ядовит. Глицерин не имеет запаха, его tпл = 18 0 С, tкип = 290 0 С. Глицерин гигроскопичен, хорошо смешивается с водой и этанолом. На этом свойстве основано применение глицерина в косметической промышленности, где глицерин используется для увлажнения кожи.

Абсолютно чистый безводный глицерин затвердевает при +18 0 С, но получить его в твердом виде чрезвычайно сложно.
Глицерин широко распространен в живой природе. Он играет важную роль в процессах обмена в организмах животных, входит в состав большинства липидов – жиров и других веществ, содержащихся в животных и растительных тканях и выполняющих в живых организмах важнейшие функции. Благодаря этим свойствам глицерин является важным компонентов многих пищевых продуктов, кремов, косметических средств.
Этиленгликоль и глицерин, благодаря наличию гидроксильных групп, могут образовывать водородные связи с молекулами воды, этим объясняется их не ограниченная растворимость в воде.
Физические свойства: этиленгликоль и глицерин при обычных условиях представляют собой бесцветные вязкие жидкости, легко смешивающиеся с водой; температура кипения этиленгликоля около 200°С, а глицерина - чуть ниже З00°С. Этиленгликоль ядовит, глицерин сладкий на вкус.
1. Качественная реакция на многоатомные спирты

Голубой осадок Сu(ОН)2 растворяется в многоатомных спиртах с образованием синефиолетового раствора глицерата меди (II).
2. Реакции этерификации с органическими и неорганическими кислотами


Тринитрат глицерина (тривиальное название - нитроглицерин) - известное взрывчатое вещество и не менее известное лекарственное (сосудорасширяющее) средство.
Гликоли
1. Окисление алкенов перманганатом калия в нейтральной среде (гидроксилирование)
Читайте также:


