Физические свойства карбоновых кислот кратко
Обновлено: 04.07.2024
Характеристики и физические свойства карбоновых кислот
Органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединенных с углеводородным радикалом, называют карбоновыми кислотами.
Первые три члена гомологического ряда карбоновых кислот, включая пропионовую кислоту, — жидкости, имеющие резкий запах, хорошо растворимые в воде. Следующие гомологи, начиная с масляной кислоты, — также жидкости, обладающие резким неприятным запахом, но плохо растворимые в воде. Высшие кислоты, с числом атомов углерода 10 и более, представляют собой твердые вещества, без запаха, нерастворимые в воде. В целом, в ряду гомологов с увеличением молекулярной массы уменьшается растворимость в воде, уменьшается плотность и возрастает температура кипения (табл. 1).
Таблица 1. Гомологический ряд карбоновых кислот.
Плотность, г/см 3
Температура кипения, o С
Получение карбоновых кислот
Карбоновые кислоты получают окислением предельных углеводородов, спиртов, альдегидов. Например, уксусную кислоту – окислением этанола раствором перманганата калия в кислой среде при нагревании:

Химические свойства карбоновых кислот
Химические свойства карбоновых кислот обусловлены в первую очередь особенностями их строения. Так, растворимые в воде кислоты способны диссоциировать на ионы:
Благодаря наличию в воде иона H + они имеют кислый вкус, способны менять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты – слабые электролиты.
Карбоновые кислоты обладают химическими свойствами, характерными для растворов неорганических кислот, т.е. взаимодействуют с металлами (1), их оксидами (2), гидроксидами (3) и слабыми солями (4):
R-COOH + KOH → R-COOK + H2O (3);
Специфическое свойство предельных, а также непредельных карбоновых кислот, проявляемое за счет функциональной группы, — взаимодействие со спиртами.
Карбоновые кислоты взаимодействуют со спиртами при нагревании и в присутствии концентрированной серной кислоты. Например, если к уксусной кислоте прилить этиловый спирт и немного серной кислоты, то при нагревании появляется запах этилового эфира уксусной кислоты (этилацетата):
Специфическое свойство предельных карбоновых кислот, проявляемое за счет радикала, — реакция галогенирования (хлорирования).

Применение карбоновых кислот
Карбоновые кислоты служат исходным сырьем для получения кетонов, галогенангидридов, виниловых эфиров и других важных классов органических соединений.
Муравьиная кислота широко применяется для получения сложных эфиров, используемых в парфюмерии, в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), в качестве растворителя и консерванта.
Водный раствор (70-80%-ной) уксусной кислоты называется уксусной эссенцией, а 3-9%-ный водный раствор – столовым уксусом. Эссенция нередко используется для получения уксуса в домашних условиях путем разведения.
Примеры решения задач
а) CH4→ CH3Cl → CH3OH → HCHO → HCOOH → HCOOK.
Напишите уравнения реакций, укажите условия их протекания.
Галогенпроизводные алканов подвергаются гидролизу в водной или щелочной среде с образованием спиртов:
В результате окисления первичных спиртов, например, дихроматом калия в кислой среде в присутствии катализатора (Cu, CuO, Pt, Ag) образуются альдегиды:
Альдегиды легко окисляются до соответствующих карбоновых кислот, например, перманганатом калия:
Карбоновые кислоты, проявляют все свойства, присущие слабым минеральным кислотам, т.е. способны взаимодействовать с активными металлами с образованием солей:
| Задание | Напишите уравнения реакций между следующими веществами: а) 2-метилпропановой кислотой и хлором; б) уксусной кислотой и пропанолом-2; в) акриловой кислотой и бромной водой; г) 2-метилбутановой кислотой и хлоридом фосфора (V). Укажите условия протекания реакций. |
| Ответ | а) в результате реакции взаимодействия между 2-метилпропановой кислотой и хлором происходит замещение атома водорода в углеводородном радикале, находящемся в a-положение; образуется 2-метил-2-хлорпропановая кислота |
б) в результате реакции взаимодействия между уксусной кислотой и пропанолом-2 происходит образование сложного эфира – изопропиловый эфир уксусной кислоты.
в) в результате реакции взаимодействия между акриловой кислотой и бромной водой присоединение галогена по месту двойной связи в соответствии с правилом Марковникова; образуется 2,3-дибромпропановая кислота
г) в результате реакции взаимодействия между 2-метилбутановой кислотой и хлоридом фосфора (V) образуется соответствующий хлорангидрид
Карбоновыми кислотами называют соединения, в которых содержится карбоксильная группа:

.
Карбоновые кислоты различают:
- одноосновные карбоновые кислоты;
- двухосновные (дикарбоновые) кислоты (2 группы СООН).
В зависимости от строения карбоновые кислоты различают:
- алифатические;
- алициклические;
- ароматические.
Примеры карбоновых кислот.

Если в радикале водород поменять на любую функциональную группу, то такие кислоты называются гетерофункциональными. Среди них: аминокислоты (протон замещен на амино-группу), нитрокислоты (атом водорода замещен на нитро-группу) и т.д.
Если число атомов углерода в кислоте больше 6, то такая кислота называется жирной.
Строение карбоновых кислот.
Карбоксильная группа состоит из С=О и ОН группы. На свойства кислоты влияют оба эти показателя. В группе С=О атом углерода обладает частично положительным зарядом и притягивает неподеленную пару атома кислорода из гидроксильной группы. При этом на кислороде электронная плотность понижается и связь О-Н ослабляется:

Как называть карбоновых кислот?
Наличие СООН группы обозначается окончанием –овая кислота.
Нумеровать цепь начинают с атома углерода карбоксильной группы, например:

Карбоксильную группу рассматривают в качестве заместителя. Например,

Изомерия карбоновых кислот.
Для карбоновых кислот характерна изомерия углеродного скелета, положение кратной связи, межклассовая изомерия, пространственная изомерия и изомерия положения функциональной группы:




Физические свойства карбоновых кислот.
Общая формула кислот CnH2n+1COOH. Низшие кислоты в нормальных условиях представляют собой жидкости, которые обладают характерным запахом. Начиная с С10 – твердые вещества.
Твердые кислоты нерастворимы в воде, а кислоты с 1-3 количеством атомов углерода неограниченно смешиваются с водой.

Получение карбоновых кислот .
1. Окисление первичных спиртов перманганатом калия и дихроматом калия:

2. Гибролиз галогензамещенных углеводородов, содержащих 3 атома галогена у одного атома углерода:

3. Получение карбоновых кислот из цианидов:

При нагревании нитрил гидролизуется с образованием ацетата аммония:

При подкисления которого выпадает кислота:

4. Использование реактивов Гриньяра:

5. Гидролиз сложных эфиров:

6. Гидролиз ангидридов кислот:

7. Специфические способы получения карбоновых кислот:
Муравьиная кислота получается при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением:

Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:

Бензойную кислоту получают окислением монозамещенных гомологов раствором перманганата калия:

Реакция Каннициаро. Бензальдегид обрабатывают 40-60% раствором гидроксида натрия при комнатной температуре.

Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:

Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.

1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:

Карбоновые кислоты – слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:

2. Образование функциональных производных карбоновых кислот:


3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты – реакция этерификации:

4. Образование амидов, нитрилов:



3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:

4. Реакция присоединения.

5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:

Исключение: муравьиная кислота:

6. Реакция серебряного зеркала:



8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:

9. Двухосновная кислота легко отщепляет СО2 при нагревании:
Кислоты состава С4-С9 – вязкие маслянистые жидкости с неприятным запахом, напоминающим запах пота, плохо растворимые в воде (разветвленные кислоты до С13 — жидкости). Высшие карбоновые кислоты (с С10) — твердые вещества, без запаха, нерастворимые в воде.
Алифатические карбоновые кислоты с количеством атомов углерода более 10 относят к высшим жирным кислотам (ВЖК), так как подавляющее большинство из них могут быть выделены из жиров животного или растительного происхождения.
Ненасыщенные кислоты при комнатной температуре – жидкости. Все дикарбоновые и ароматические кислоты при комнатной температуре – кристаллические вещества.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. С увеличением молекулярной массы кислот растворимость в воде уменьшается. Высшие карбоновые кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде.
Монокарбоновые кислоты хорошо растворяются также во многих органических растворителях.

С увеличением числа атомов углерода в молекулах кислот и соответственно, с ростом относительной молекулярной массы температура кипения увеличивается, запах ослабевает и исчезает.
Температуры плавления кислот с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным числом. С увеличением числа углеродных атомов в молекуле кислоты температура плавления уменьшается и где-то после С25 практически сходит на нет.
При одной и той же длине углеводородного радикала температуры плавления и кипения ненасыщенных кислот зависят от наличия кратных связей – с ростом их числа соответствующие температуры уменьшаются.
Температуры кипения и плавления кислот значительно выше температур кипения и плавления спиртов и альдегидов с тем же количеством атомов углерода.
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей. Водородная связь, образуемая водородом гидроксильной группы одной молекулы с карбонильным кислородом другой, более прочная, чем в спиртах.
В твердом и жидком состоянии молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей в устойчивые циклические димеры:
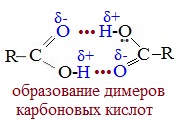
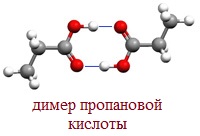
Между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
Молекулы муравьиной и уксусной кислот за счёт водородных связей могут образовывать димеры, которые не разрушаются даже в паровой фазе. Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
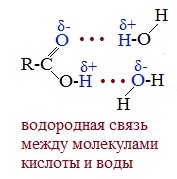
Растворимость карбоновых кислот в воде несколько выше, чем у спиртов, так как и с водой кислоты образуют более прочные водородные связи.
В водных растворах кислоты образуют линейные димеры:
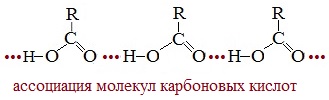
Отсутствие среди карбоновых кислот газообразных веществ связано с межмолекулярной ассоциацией (соединением) молекул посредством водородных связей.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 101 0 С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 118 0 C. Безводная уксусная кислота застывает при температуре ниже + 16,8 0 С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
3-9% водный раствор кислоты известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.

Пальмитиновая и стеариновая кислоты — твердые вещества, белого цвета, жирные на ощупь, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях.

Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4 0 С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
Муравьиная кислота — простейший представитель насыщенных карбоновых кислот. В молекуле муравьиной кислоты содержится один атом углерода (как у метана), поэтому её ещё называют метановой кислотой. Это единственная кислота, в которой карбоксильная группа соединена с атомом водорода, а не с углеводородным радикалом.
Муравьиная кислота — резко пахнущая жидкость , хорошо растворимая в воде. Она ядовита . При попадании на кожу вызывает ожоги.

Уксусная кислота — гомолог муравьиной. В её молекуле — два атома углерода, один из которых входит в состав функциональной группы. Другое название уксусной кислоты — этановая :

Уксусная кислота — бесцветная жидкость с характерным резким запахом, неограниченно растворимая в воде.
При температуре \(16,5\) °С безводная уксусная кислота превращается в твёрдое кристаллическое вещество, похожее на лёд. Поэтому её иногда называют ледяной уксусной кислотой.
\(70\)–\(80\) % раствор уксусной кислоты называют уксусной эссенцией , а \(5\)–\(9\) % раствор применяется в быту под названием столового уксуса .

Ненасыщенная олеиновая кислота C 17 H 33 COOH отличается от насыщенной агрегатным состоянием. Она представляет собой маслянистую жидкость . В воде не растворяется.

Карбоновые кислоты
Ключевые слова конспекта: Карбоновые кислоты. Предельные одноосновные карбоновые кислоты. Муравьиная кислота. Уксусная кислота.
Понятие и формулы карбоновых кислот
Органические вещества, содержащие в молекуле карбоксильную группу, связанную с углеводородным радикалом, называют карбоновыми кислотами .

Органических кислот великое множество. Мы будем знакомиться с предельными одноосновными карбоновыми кислотами, в молекулах которых с предельным углеводородным радикалом связана одна карбоксильная группа. Общая формула этих кислот СnН2n+1СООН, или RCOOH.
Однако в молекуле первого представителя гомологического ряда предельных одноосновных карбоновых кислот вместо углеводородного радикала с карбоксильной группой связан атом водорода. Эту кислоту называют муравьиной кислотой, её формула НСООН.
Формулы, а также тривиальные и международные названия некоторых представителей гомологического ряда предельных одноосновных карбоновых кислот приведены в таблице.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые кислоты — жидкости с резким запахом, хорошо растворимые в воде. По мере роста углеводородного радикала растворимость кислот падает, температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты — твёрдые вещества, нерастворимые в воде.

Основным способом получения карбоновых кислот служат реакции окисления. Исходные вещества в подобных синтезах — спирты и альдегиды:
Пищевую уксусную кислоту получают биотехнологическим путём — сбраживанием сахарсодержащих растворов при действии особых микроорганизмов.
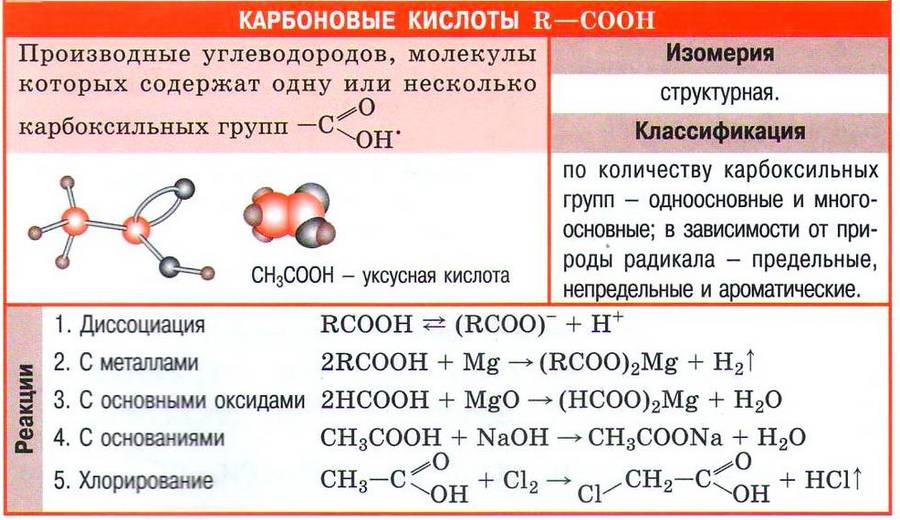
Химические свойства карбоновых кислот

Следует учесть, что химические свойства карбоновых кислот, как и кислот неорганических, обусловлены их способностью диссоциировать с образованием катиона водорода:
Почему же в уравнении электролитической диссоциации соляной кислоты ставится знак равенства, а в аналогичном уравнении для уксусной кислоты — знак обратимости? Дело в том, что в отличие от соляной кислоты уксусная является слабой, распаду на ионы в водном растворе подвергается только небольшая часть её молекул.
Благодаря наличию в растворе катионов водорода карбоновые кислоты проявляют все характерные для кислот свойства: имеют кислый вкус, изменяют окраску индикаторов, реагируют с активными металлами, основными и амфотерными оксидами, основаниями, солями. Рассмотрим свойства карбоновых кислот на примере уксусной кислоты СН3СООН.

Уксусная кислота реагирует с активными металлами с образованием солей (ацетатов) и выделением водорода:

Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:

При взаимодействии уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:

Одно из важнейших химических свойств карбоновых кислот вам уже знакомо. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами, образуя сложные эфиры. Сама реакция вам уже знакома, это реакция этерификации. Так, в результате взаимодействия уксусной кислоты и этилового спирта образуется сложный эфир — этиловый эфир уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах, не только придавая им кисловатый вкус, но и предохраняя их от порчи и поражения вредителями.
Муравьиная кислота выделяется железами внутренней секреции муравьёв и некоторых видов медуз. Жжение листьев крапивы также обусловлено раздражением кожи муравьиной кислотой.
Области применения карбоновых кислот в промышленности, в технике и технологии, в быту также весьма обширны. Муравьиную кислоту применяют для протравливания текстиля и бумаги, обработки кожи, получения лекарственных средств, как консервант фруктовых соков и зелёных кормов. Она входит в состав средства для местной анестезии. Её также используют при крашении тканей и бумаги.
Уксусную кислоту используют как приправу к пище, как растворитель лаков, для производства лекарственных средств, например аспирина, для получения пластмасс, ядохимикатов, красителей. В продаже встречается уксусная эссенция — 70%-ный раствор уксусной кислоты. С кислотой такой концентрации необходимо обращаться очень осторожно! Её пары могут вызвать ожоги дыхательных путей, а употребление внутрь неразбавленной уксусной эссенции смертельно опасно. Хранить эссенцию нужно в месте, недоступном для детей и домашних животных.

Читайте также:

