Физические свойства халькогенов кратко
Обновлено: 02.07.2024
К элементам VI главной подгруппы (или 16-ой группы по новой номенклатуре ЮПАК) периодической системы элементов Д.И.Менделеева относятся кислород (О), сера (S), селен (Se), теллур (Te) и полоний (Ро). Групповое название этих элементов - халькогены (термин "халькоген"происходит от греческих слов "chalkos"-медь и "genos"- рожденный ), то есть "рождающие медные руды", обусловлено тем, что в природе они встречаются чаще всего в форме соединений меди (сульфидов, оксидов, селенидов и т.д.).
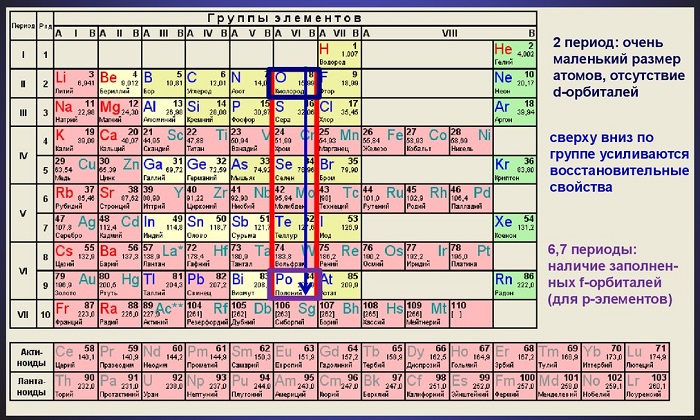
В основном состоянии атомы халькогенов имеют электронную конфигурацию ns 2 np 4 с двумя неспаренными р-электронами. Они принадлежат к четным элементам. Некоторые свойства атомов халькогенов представлены в таблице.
При переходе от кислорода к полонию размер атомов и их возможные координационные числа увеличиваются, а энергия ионизации (Еион) и электроотрицательность (ЭО) уменьшаются. По электроотрицательности (ЭО) кислород уступает лишь атому фтора, а атомы серы и селена также азоту, хлору, брому; кислород, сера и селен относятся к типичным неметаллам.
В соединениях серы, селена, теллура с кислородом и галогенами реализуются степени окисления +6, +4 и +2. С большинством других элементов они образуют халькогениды, где находятся в степени окисления -2.
Халькогены — это группа химических элементов, которые размещены в главной подгруппе 6 группы периодической таблицы Менделеева.
Описание и общая характеристика
Родоначальник этой группы — кислород. Кроме него сюда входят такие элементы как селен, сера, теллур и полоний.
Среди них: неметаллы — сера и кислород, промежуточные элементы между металлами и неметаллами — теллур и селен, и один металл — полоний.
С уменьшением порядочного номера элементов группы радиус атомов уменьшается, поэтому наименьший радиус имеется у кислорода, а наибольший - у полония.
Строение молекул и физические свойства
Электронная конфигурация атомов этих элементов характеризуется шестью электронами на внешнем энергетическом уровне.
Все халькогены могут проявлять разные степени окисления: для кислорода это -2 и +2 (в соединении с фтором), для атома теллура, а также для селена и серы это +2, +4 и +6.
Для кислорода и серы характерно такое свойство как аллотропия. Так как у них есть два неспаренных электрона, то возможны разные варианты строения простых веществ. Например, в зависимости от того, какую связь образует элемент О (кислород) - двойную или тройную, соответственно различают кислород и озон.
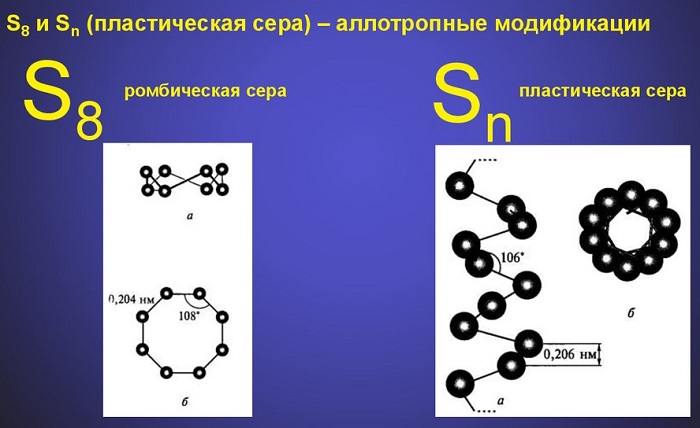
Также образовывать аллотропные вещества может сера, создавая многоатомные циклы и цепи.
Аллотропные модификации элементов имеют также различные физические свойства: такие характеристики как растворимость в воде и температура кипения у озона намного выше, чем у кислорода, а виды многоатомных цепей у серы такие как ромбическая и моноклинная, в отличие от пластической — растворяются в органических жидкостях, но при этом все они не растворяются в воде.
Химические свойства халькогенов
Кислород, как наиболее элетроотрицательный элемент этой группы — может выступать окислителем почти всех простых и некоторых сложных веществ.

Только взаимодействуя со фтором он выступает в качестве восстановителя с положительной степенью окисления. С неметаллами он взаимодействует при довольно высоких температурах.

Так как сера имеет высокую реакционную способность (особенно если она находится в твёрдом агрегатном состоянии, а не в расплаве) - она может соединяться почти со всеми простыми веществами, кроме инертных газов.
Её скорость взаимодействия с водородом и хлором увеличивается с увеличением температуры. Также она может гореть во фторе и окисляться при высоких температурах с образованием оксида серы.

Полоний, селен и теллур хотя и не имеют такой большой реакционной способности, как у двоих предыдущих представителей этой группы элементов, тем не менее — так же могут реагировать почти со всеми простыми веществами. Селениды, полониды и теллуриды металлов именуются наиболее устойчивыми.
Всем халькогенам характерна реакция диспропорционирования (в виде взаимодействия с водой).
Биологическая роль халькогенов
В этой группе есть как элементы, жизненно необходимые, так и те, биологическую роль которых не обнаружили. К первым относится сера, селен и, как ни странно, кислород; ко вторым — теллур и полоний.
Представители первой группы имеют место в составе биомолекул организма человека. Главное значение здесь по праву принадлежит кислороду.

Он окисляет питательные вещества, в результате чего выделяется энергия, необходимая для жизнедеятельности, принимает участие в защитных свойствах организма, также в медицине огромную роль играет его применение при различных заболеваниях, по причине которых у человека нарушаются дыхательные функции.
Другая форма кислорода — озон — используется для обеззараживания воздуха и дезинфекции помещений. Ещё его применяют для очистки питьевой воды. В природе его можно обнаружить в воздухе из-за характерного чувства приятной свежести и некоего запаха.
Теперь поговорим о сере. Она также, как и предыдущий элемент, относится по содержанию в организме к макроэлементам. Чтобы понять её большое значение, достаточно сказать, что она входит в состав таких биомолекул как белки, аминокислоты, гормоны, витамины.

Также её обнаружили в составе костей, в нервной ткани и в каротине волос. Кроме всего этого она некоторым образом участвует и в защитной системе организма, обезвреживая ядовитые соединения.

Селен может выступать в различных соединениях в роли аналога серы, замещая её. Его также обнаружили в составе некоторых ферментов.
Находясь в активном центре одного из них — он участвует в защите клеток от действия пероксида водорода и органических пероксидов. Физиологическая роль этого элемента в процессе жизнедеятельности доказывается его способностью предохранять ткани от некроза. Ещё одна из функций селена — предохранение от отравления кадмием и ртутью.
Поэтому, если обобщить: сера и кислород — жизненно необходимые, селен — физиологически активен, а роль полония и теллура не обнаружена.
3774 дн. с момента
как существует сайт


Владельцы сайта
Подгруппа кислорода
Химия неметаллов VIA группы.mp4
Халькогены – элементы шестой группы периодической таблицы Менделеева. В группе находятся три неметалла (кислород, сера, селен), металл (полоний) и полуметалл (теллур). Поэтому халькогены являются как окислителями, так и восстановителями. Металлические свойства усиливаются в группе сверху вниз: кислород – газ, полоний – твёрдый металл. К халькогенам также относится искусственно синтезированный ливерморий с сильными металлическими свойствами.
Халькогены в природе встречаются чаще всего в составе руды – сульфидов, пиритов, оксидов, селенидов. К халькогенам относятся неметаллы и металлы. В группе сверху вниз свойства меняются следующим образом: металлические свойства усиливаются; свойства окислителя ослабевают; электроотрицательность уменьшается; термическая устойчивость ослабевает.
Общая характеристика группы халькогенов: неметаллы – кислород, сера, селен; металлы – теллур, полоний; валентность: II – О; IV и VI – S; II, IV, VI – Se, Te, Po;
электронная конфигурация – ns 2 np 4 ; гидриды – H 2 R; оксиды – RO 2 , RO 3 ; кислородные кислоты – H 2 RO 3 , H 2 RO 4 .

По электронному строению халькогены относятся к р-элементам. На внешнем энергетическом уровне находится шесть электронов. До завершения р-орбитали не хватает двух электронов, поэтому в соединениях халькогены проявляют свойства окислителя. С увеличением в группе количества энергетических уровней связь с внешними электронами ослабевает, поэтому теллур и полоний являются восстановителями. Находясь на границе металлов и неметаллов, теллур относится к металлоидам или полуметаллам. Является аналогом серы и селена, но менее активен.
Элементы VIA группы и их символы. В неорганической химии халькогенами называют р-элементы VIA группы или подгруппы кислорода периодической системы Д.И. Менделеева. В неё входят пять элементов: кислород О, сера S, селен Se, теллур Te, полоний Po. Название халькогены происходит от греческих χαλχος –медь и γεννάω - рождаю (образующие руды).
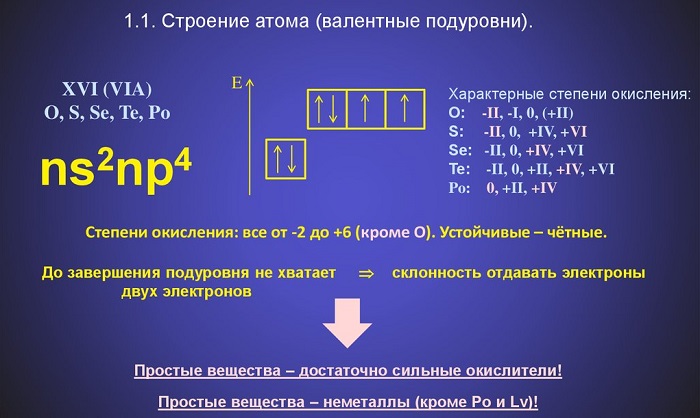
Характерное для халькогенов строение внешнего электронного уровня и степени окисления элементов. У атомов халькогенов одинаковое строение внешнего энергетического уровня – ns2np4. Этим объясняется сходство их химических свойств. Для всех элементов (кроме полония и кислорода) характерны степени окисления (+VI), (+IV) и (-II); полоний в соединениях проявляет состояния окисления (+IV), (+II) и (-II); для кислорода типична степень окисления (-II), исключение составляют его фториды OF2 и O2F2 со степенями (+II) и (+I) соответственно и перекись водорода Н2О2, а также её производные, где она равна (- I ). Такие значения степеней окисления следуют из электронного строения халькогенов:
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т.е. отсутствуют свободные орбитали, хотя иногда он может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцептерному способу. У атомов серы и других элементов подгруппы в невозбужденном состоянии валентность и степени окисления такие же, однако, при подводе энергии (например, при нагревании), число неспаренных электронов может быть увеличено путем перевода s- и р-электронов на d-подуровень внешнего слоя. Устойчивость состояния окисления (+VI) понижается от S к Te, устойчивость состояния (+IV) повышается от S к Po, а устойчивость состояния (-II) понижается от O к Po.
Зависимость физических и химических свойств халькогенов от электронного строения. Физические и химические свойства халькогенов закономерно изменяются с увеличением порядкового номера. Появление новых электронных слоёв влечет за собою увеличение радиусов атомов, уменьшение электроотрицательности, понижение окислительной активности незаряженных атомов и усиление восстановительных свойств атомов со степенью окисления (-II), поэтому с увеличением заряда ядра неметаллические свойства ослабевают, а металлические возрастают от О к Ро. В целом все элементы подгруппы кислорода, кроме полония – неметаллы, хотя и менее активные, чем галогены. Селен и теллур, однако, известны в металлических и аморфных модификациях.
Халькогеноводороды. Водородные соединения элементов подгруппы, они также называются халькогеноводородами (хальководородами), отвечают формуле Н2 R : Н2О, Н2S, Н2Se, Н2Те, Н2Ро. Их устойчивость уменьшается от О к Ро. При растворении соединений в воде образуются кислоты (формулы те же), кислотность которых увеличивается в том же порядке, что объясняется уменьшением энергии связи в ряду соединений Н2 R . Вода Н2О, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом и считается нейтральной. Халькогеноводороды проявляют соответственно большие и меньшие кислотные свойства, чем водородные соединения элементов VА группы и галогеноводороды.
Соединения халькогенов с кислородом (оксиды и гидроксиды). Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3, кроме того сера встречается в формах R2О3, (RО3)2, (RО3)3 и RО4. Их гидроксидам соответствуют кислоты типа Н2RО3 и Н2RО4, а также в некоторых случаях Н2RО6 и RО2 * n Н2О. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 еще и восстановительные. По сравнению с элементами VА группы все указанные гидроксиды более кислотные, а по сравнению с элементами VIIА группы – более основные. Полоний образует амфотерный гидроксид РоО(ОН)2.
II . Кислород (Оху genium ) О
Физиологическое действие кислорода. В воздухе имеется приблизительно 1,1*1015 т кислорода. Он играет исключительно важную роль в природе, так как является жизненно важным элементом, необходимым для функционирования почти всех живых организмов (исключение составляют анаэробные бактерии), тления и гниения погибших растений и животных (при этом сложные органические вещества превращаются в более простые, а в конечном результате в СО2, воду и азот).
Процесс окисления органических веществ, служащих источником энергии для клеток, с помощью усвоенного при дыхании кислорода в присутствии ферментов с образованием СО2 и Н2О называется диссимиляцией или дыханием, обратный процесс носит название ассимиляции:
Диссимиляция протекает во всех аэробных организмах, в том числе и в растениях, лишенных воздействия солнечного света; ассимиляция представляет собой процесс фотосинтеза, идущий в основном природном источнике свободного кислорода – растениях (помимо них в восполнении кислорода имеет место фотохимическое разложение водяного пара в верхних слоях атмосферы, что, вероятно, сыграло важную роль в образовании свободного кислорода до возникновения жизни на Земле).
Кислород поступает через легкие в кровь и связывается с гемоглобином (хромофор красных кровяных телец) с образованием оксигемоглобина и в таком виде подводится к клеткам. Под действием ферментов кислород окисляет также приносимую кровью глюкозу (виноградный сахар) С6Н12О6; освобождаемая при этом энергия используется для протекания различных жизненных процессов (работа мускулов, нагревание тела и т.д.).
Озон ядовит, предельно допустимым является его содержание в воздухе, равное 10-5 % (в приземном слое атмосферы содержание этого газа обычно лежит в пределах 10-7-10-6 %),однако, небольшое содержание О3 в атмосфере благоприятно влияет на организм человека.
II .1. Дикислород (обычный кислород) О2
Физические свойства дикислорода. Обычный кислород (дикислород) О2 – бесцветный газ, не имеющий вкуса и запаха, несколько более тяжелый, чем воздух, умеренно растворимый в воде. На разрыхляющих молекулярных p -орбиталях кислорода размещаются два неспаренных электрона, создающих магнитное поле, что придаёт молекуле элемента магнитные свойства. Парамагнитность её проявляется, в частности, в том, что жидкий кислород притягивается магнитом. Жидкая модификация кислорода имеет бледно-голубой цвет, твердая (кристаллы гексагональной формы) – синий. Хорошими поглотителями кислорода являются платиновая чернь, активированный (активный) древесный уголь и благородные металлы в расплаве.
Химические свойства дикислорода. Химическая связь в молекуле кислорода - ковалентная неполярная. Этот элемент образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре дикислород относительно мало реакционноспособен; при температурах выше 1500 оС вследствие ослабления связи кислород-кислород активность О2 возрастает. В атомарном состоянии кислород ещё более активен, чем в молекулярном. Химическое присоединение О2 называется окислением (кислород выступает в химических реакциях окислителем, так как по значению относительной электроотрицательности является вторым элементом, уступая фтору); оно бывает быстрым и медленным. Медленное окисление – это, например, процессы ржавления, дыхания, усвоения пищи организмом, гниения, старения резины, отвержения масляных красок. Быстрое окисление, часто сопровождаемое появлением пламени (выделение теплоты и света), называется горением, а медленное – тлением. Постепенное окисление различных веществ на воздухе называется ржавлением. В результате окисления образуются оксиды. Скорость окисления зависит от природы окисляемого вещества, от температуры, а также от условий смешения. Самопроизвольное окисление при обычной температуре называется аутооксидацией. Скорость реакций окисления, как и скорость других химических реакций, увеличивается при повышении температуры и наличии катализаторов. Особо важную роль для ускорения процессов окисления играет наличие воды.
Дикислород взаимодействует со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он образует оксиды непосредственно (кроме галогенов, золота и платины – их оксиды получаются косвенным путем; исключение составляет О2F2, который образуется прямо при взаимодействии газов), например:
S + O2 ® SO2; 2HN2S + 3O2 ® 2H2O + 2SO2
Сложные вещества при определенных условиях также взаимодействуют с кислородом. При этом образуются оксиды, а иногда и простые вещества, например:
2С2Н2 + 5О2 ® 4СО2 + 2Н2О; 4 N Н3 + 3О2 ® 2 N 2 + 2Н2О
Обнаружение и получение дикислорода. В газовом анализе кислород обнаруживают по яркому возгоранию тлеющей лучины при содержании не менее 30% (недооценка этого свойства чистого кислорода часто приводит к несчастным случаям в космонавтике и медицине, где он наиболее часто используется); по коричневому окрашиванию щелочного раствора пирогаллола (пирогалловой кислоты); по окрашиванию в интенсивно красный цвет смеси растворов пирокатехина С6Н4(ОН)2 и F е S О4; по окрашиванию бесцветного аммиачного раствора С u С l 2 в синий цвет.
1. В промышленности из воздуха путем фракционной конденсации и дистилляции (способ Линде), а также при получении водорода путем электролиза воды (как побочный продукт).
2. Нагреванием кислородсодержащих веществ, а именно хлоратов в присутствии катализатора - пиролюзита MnO 2 (реакция 1), нитратов (реакция 2), перманганатов при умеренных или очень высоких температурах (соответственно реакции 3 и 4), пероксидов (реакция 5):
Читайте также:

