Физические свойства этиленгликоля и глицерина кратко
Обновлено: 02.07.2024
Физические и теплофизические свойства этиленгликоля и глицерина и его водных растворов. Плотность, теплоемкость, вязкость, температуропроводность, теплопроводность, поверхностное натяжение, температуры замерзания и кипения.
Этиленгликоль (этандиол - 1,2 ; гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол) - это простейший двухатомный спирт, HO-CH2CH2-OH = C2H4(OH)2. Этиленгликоль, вернее его смеси часто применяется в качестве антифризов, тем и известны в основном. Чиистый этиленгликоль представляет собой прозрачную бесцветную маслянистую. Этиленгликоль не имеет запаха и обладает сладковатым вкусом - это примечание глупое, потому, что Этиленгликоль весьма токсичен.
Глицерин (триоксипропан, глицерол, пропантриол-1,2,3. ) - трехатомный спирт, его химическая формула HOCH2CH(OH)-CH2OH = C3H8O3). Глицерин находит широкое применение в при изготовлении бумаги, косметики и мыла, а также в производстве кондитерских изделий и алкогольных напитков; применяется в технологических процессах, предотвращает замораживание рабочих жидкостей, способствует продлению срока службы деталей из эластомеров. Глицерин является бесцветной вязкой жидкостью, неограниченно растворимой в воде. Обладает сладким вкусом.
Этиленгликоль представляет собой гигроскопичную бесцветную жидкость, почти без запаха, имеющую температуру кипения 197˚С и смешивающуюся с водой во всех отношениях. Чаще всего этиленгликоль используется при получении полиэфирного связующего, применяемого в производстве листового стеклопластика.
Глицерин представляет собой вязкую гигроскопичную бесцветную жидкость, не имеющую запаха и обладающую сладким вкусом. Он смешивается с водой во всех отношениях и является хорошим растворителем спиртов, этиленгликоля, пропиленгликоля, аминов и многих органических и неорганических солей. Глицерин используется в основном при производстве насыщенных полиэфирных смол.
Этиленгликоль и глицерин подобны одноатомным спиртам. Они реагируют с активными металлами.
Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
Применение:
Глицерин – в парфюмерии, косметике, медицине – растворитель, компонент мазей;
для производства тринитроглицерина
Этиленгликоль (ЭГ) – в антифризах, 66%-й ЭГ замерзает при –60 °C; в синтезе лавсана [–СН2СН2О (О) СС (О) O–]n;
растворитель (tкип = 198 °С).
Этиленгликоль (этандиол, гликоль ) — это простейший двухатомный спирт, его химическая формула HO-CH2CH2-OH. Этиленгликоль широко применяется в качестве антифриза, также используется в органическом синтезе. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Этиленгликоль не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен .
Глицерин (триоксипропан) — это простейший представитель трехатомных спиртов, его химическая формула HOCH2CH (OH) -CH2OH (C3H8O3). Глицерин находит широкое применение в при изготовлении бумаги, косметики и мыла, а также в производстве кондитерских изделий и алкогольных напитков; применяется в технологических процессах, предотвращает замораживание рабочих жидкостей, способствует продлению срока службы деталей из эластомеров. Глицерин является бесцветной вязкой жидкостью, неограниченно растворимой в воде. Обладает сладким вкусом.
Теплофизические свойства этиленгликоля
19 раз больше вязкости воды.
При проведении инженерных расчетов проще использовать приближённые формулы для определения физических свойств этиленгликоля.
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. [3]
Содержание
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона

1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [4] или комплекса диметилсульфат-ДМФА [5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен [6] [7] . По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела) [8] . Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол [9] .
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой [10] .
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение многоатомных спиртов
I . Получение двухатомных спиртов
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):

2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:

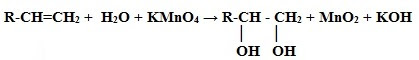
II . Получение трёхатомных спиртов (глицерина)
Омыление жиров (триглицеридов):

Химические свойства многоатомных спиртов
1. С активными металлами:
2. С гидроксидом меди( II ) – качественная реакция!

2) При обработке многоатомных спиртов галогеноводородами в присутствии серной кислоты происходит замещение гидроксильных групп на атомы галогена:

3) При окислении многоатомных спиртов образуются многоосновные карбоновые кислоты:

Специфические свойства многоатомных спиртов. При реакции с гидроксидом меди образуются комплексные соединения меди, окрашенные в ярко-синий цвет.
Читайте также:

