Физические свойства циклоалканов кратко
Обновлено: 02.07.2024
Циклоалканы — являются предельными (насыщенными) углеводородами, содержащими замкнутый углеродный цикл.
Основную формулу для циклоалканов можно записать в кратком виде:
C n H 2 n , где n ≥ 3
Молекулы циклоалканов содержат в своем составе атомы углерода, для которых характерно состояние s p 3 -гибридизации. Каждый атом углерода образует четыре σ -связи С – С или С – Н . Изменение длины, прочности связей и валентных углов определяется размерами цикла.
В том случае, когда цикл небольшой, что характерно для молекул циклопропана и циклобутана, валентные углы между связями С – С обладают значительными отличиями по сравнению с валентными углами между связями С – С в алканах (109°35′). В связи с этим, в малых циклах можно наблюдать напряжение, являющееся причиной высокой реакционной способности таких циклоалканов.
Особенности строения объясняют легкость вступления низших циклоалканов в реакции присоединения, в процессе которых разрывается углеродный цикл. Циклобутан, как и циклопропан, обладает аналогичной способностью вступать в реакции присоединения. Но с другой стороны, циклобутан характеризуется меньшим угловым напряжением по сравнению с аналогичным показателем циклопропана. Этот факт обуславливает усложненность течения реакций присоединения к циклобутану.
Циклобутан обладают неплоским строением. К примеру, для молекулы циклобутана характерен перегиб по линии, которая соединяет первый атом углерода с третьим в кольце:
Большие циклы обладают усложненным и неплоским строением. Этим объясняется отсутствие углового напряжения в молекулах больших циклоалканов. Соединения, для которых характерен большой цикл, не вступают в реакции присоединения. Данные вещества способны вступать в реакции замещения, характерные для алканов.
Циклопентан обладает неплоским строением. Молекула циклопентана имеет форму своеобразного конверта:
Номенклатура и изомерия
Циклоалканы характеризуются структурной изомерией. Она связана со следующими условиями:
- количество углеродных атомов в кольце;
- количество углеродных атомов в заместителях;
- положение заместителей в цикле.
Изомеры, которые обладают разным количеством углеродных атомов в цикле, отличаются по размерам углеродного цикла.
Изомеры, которые характеризуются неодинаковым количеством углеродных атомов в цикле, — это этилциклопропан и метилциклобутан. Данные циклоалканы можно записать с помощью общей формулы С 5 Н 10 .
Изомеры, которые обладают неодинаковым количеством атомов углерода в заместителях, обладают разным строением заместителей у одинакового углеродного цикла.
Структурные изомеры, которые обладают неодинаковым количеством атомов углерода в заместителях, с различным числом углеродных атомов в заместителях — 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан.
Существуют изомеры, обладающие неодинаковым положением однотипных заместителей в углеродном цикле.
В качестве примера таких изомеров можно привести 1,1-диметилциклогексан и 1,2-диметилциклогексан.
Межклассовая изомерия проявляется таким образом: циклоалканы изомерны алкенам.
Циклопропану и пропену соответствует формула С 3 Н 6 .
Геометрическую (цис-транс-) изомерию можно наблюдать в случае циклоалканов. У соединений, которые обладают парой заместителей, находящихся у соседних углеродных атомов в цикле, цис-транс-изомерия объясняется различным взаимным расположением в пространстве заместителей по отношению к плоскости цикла.
В цис-изомерах заместители расположены с одной стороны по отношению к плоскости цикла. При рассмотрении транс-изомеров можно наблюдать расположение заместителей по разные стороны от плоскости цикла.
В молекуле 1,2-диметилциклопропана можно наблюдать расположение двух групп С Н 3 с одной стороны от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер).
В случае 1,1-диметилциклопропана цис-транс-изомерия не характерна.
Правила номенклатуры циклоалканов:
- Роль главной углеродной цепи играет цикл. Углеводородные радикалы, не входящие в основную цепь, выполняют функцию заместителей.
- Нумерация атомов углерода в цикле происходит таким образом, что атомам углерода, соединенным с заместителями, присвоены минимально возможные номера. При этом отсчет начинают с самого приближенного к главной группе конца цепи.
- При формулировке наименования каждого радикала принято указывать впереди цифры, обозначающие их положение в главной цепи. Если заместители одинаковые, эти цифры отделяют запятой. Число одинаковых заместителей обозначают с помощью приставок ди- (два), три- (три), тетра- (четыре), пента- (пять) и так далее. В качестве примеров можно привести 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
- Наименования заместителей, включая приставки и цифры, размещают по алфавиту. К примеру, 1,1-диметил-3-этилциклопентан.
Физические и химические свойства циклоалканов
Каждый углеродный атом в молекулах циклоалканов обладает s p 3 -гибридизацией. С другой стороны, углы между орбиталями гибридного типа в циклобутане и циклопропане значительно меньше 109°28'. Это объясняется наличием в молекулах напряжения, в связи с чем, малые циклы обладают большой реакционной способностью.
Физические свойства циклоалканов:
- в обычных условиях первые два представителя гомологического ряда ( C 3 — C 4 ) являются газообразными веществами, ( C 5 — C 11 ) — жидкостями, начиная с C 12 — веществами с твердым агрегатным состоянием;
- циклоалканы обладают температурами кипения и плавления, которые выше по сравнению с аналогичными показателями соответствующих алканов;
- циклоалканы плохо растворяются в воде;
- в том случае, когда количество углеродных атомов увеличивается, можно наблюдать рост молярной массы, что в результате приводит к повышению температуры плавления.
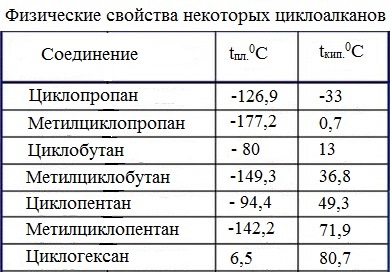
Температуры, при которых плавятся и кипят некоторые циклоалканы:
Циклоалканы с малым циклом (например, циклопропан, циклобутан и их замещенные гомологи) характеризуются высокой напряженностью связей в кольце, что позволяет им участвовать в реакциях присоединения.
По мере уменьшения цикла и увеличения углового напряжения в цикле упрощается процесс, при котором происходят реакции присоединения. Свойство вступать в такие реакции уменьшается в ряду: циклопропан — циклобутан — циклопентан.
Малые циклы и циклопентан (при жестких условиях) способны взаимодействовать с водородом. В процессе кольцо разрывается, и образуются алканы.
Простое присоединение водорода циклопропаном и циклобутаном при нагреве и наличии катализатора:
Реакция присоединения водорода циклопентаном в жестких условиях:
Циклогексан и циклоалкан, которые обладают большим количеством углеродных атомов, не вступают в реакции в цикле с водородом.
Циклопропан и циклобутан вступают в химическое взаимодействие с галогенами. В процессе галогены присоединяются к молекуле. При этом кольцо разрывается. Процесс бромирования характеризуется небольшой скоростью и избирательностью.
Присоединение циклопропаном брома приводит к формированию 1,3-дибромпропана:
Реакции присоединения, сопровождающиеся разрывом цикла, можно наблюдать при взаимодействии циклопропана и его гомологов с алкильными заместителями у трехчленного цикла с галогеноводородами.
Присоединение йодоводорода циклопропаном:
Процесс, при котором присоединяются галогеноводороды к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и другие), протекает, согласно правилу Марковникова.
Присоединение бромоводорода к метилциклопропану в распространенных случаях сопровождается образованием 2-бромбутана:
В больших циклах (циклопентане, циклогексане) за счет того, что молекулы обладают неплоским строением, не возникает угловое напряжение. По этой причине большие циклы характеризуются повышенной устойчивостью по сравнению с малыми, что исключает разрыв связей С-С в процессе реакций присоединения. Данные вещества проявляют химические свойства, схожие с алканами, участвуя в реакциях замещения без разрыва кольца.
Галогенирование циклопентана, циклогексана и циклоалканов, которые обладают большим числом углеродных атомов в цикле, реализуется, согласно механизму радикального замещения.
Хлорирование циклопентана на свету или при нагреве приводит к образованию хлорциклопентана:
В процессе хлорирования метилциклопентана замещение легче протекает у третичного атома углерода:
Циклоалканы вступают в химические реакции с разбавленной азотной кислотой в условиях нагрева. В результате можно наблюдать образование нитроциклоалканов.
Реакция нитрования циклопентана:
В процессе нагрева циклоалканы при наличии катализаторов вступают в химические реакции дегидрирования, то есть отщепляется водород. Циклогексан и его производные дегидрируются при повышении температуры в присутствии катализатора до бензола и его производных.
Образование бензола в процессе дегидрирования циклогексана:
Когда отщепляется водород от метилциклогексана, получается толуол:
Как и все углеводороды, алканы горят, окисляясь до углекислого газа и воды. Общий вид уравнения сгорания циклоалканов:
C n H 2 n + 3 n / 2 O 2 → n C O 2 + n H 2 O + Q
Реакция горения циклопентана:
2 C 5 H 10 + 15 O 2 → 10 C O 2 + 10 H 2 O + Q
Окисление циклогексана с помощью азотной кислоты или при наличии катализатора сопровождается образованием адипиновой (гександиовой) кислоты:
Способы получения соединений, применение
Циклоалканы получают путем дегидрирования алканов. При этом алканы, у которых углеродный скелет удлинен, а количество углеродных атомов в главной цепи составляет от 5 и более, нагревают в присутствии металлов, катализирующих процесс. Процесс сопровождается образованием циклических соединений.
При дегидроциклизации отщепляется водород, и образуется замкнутый цикл. Пентан и его гомологи, которые содержат пять углеродных атомов в основной цепи, при нагреве над платиновым катализатором формируют циклопентан и его гомологи:
Алканы с углеродной цепью, в которой содержится 6 и более углеродных атомов в главной цепи, в процессе дегидрирования формируют стабильные шестиатомные (шестичленные) циклы. Таким образом, происходит образование циклогексана и его гомологов.
При увеличении температуры гексан в присутствии оксида хрома (III) в зависимости от условий способен формировать циклогексан и далее бензол:
В процессе дегидрирования гептан при наличии катализатора способен формировать метилциклогексан, а затем, толуол:
Дегидроциклизация алканов является наиболее распространенным методом синтеза циклоалканов в промышленных объемах.
Образование циклогексана в процессе гидрирования бензола при повышении температуры и наличии катализатора:
Гидрирование толуола с образованием метилциклогексана:
С помощью данного метода получают исключительно циклогексан и его гомологи с шестичленным кольцом.
Еще одним способом получения циклоалканов является дегалогенирование дигалогеналканов. Процесс протекает под действием активных металлов. Используют дигалогеналканы, в которых между атомами галогенов размещено от трех и более углеродных атомов.
Химическая реакция 1,4-дибромбутана с цинком сопровождается образованием циклобутана:
С помощью дегалогенирования дигалогеналканов синтезируют циклоалканы определенного строения, включая циклоалканы с малыми циклами ( C 3 и C 4 ) .
На промышленных предприятиях нефтехимической отрасли применяют нафтены, как сырье для производства ароматических углеводородов с помощью каталитического риформинга. Наиболее ценным с практической точки зрения является циклогексан. Данное вещество используют в синтезе таких материалов, как:
- капролактам;
- адипиновая кислота;
- другие соединения, которые используют для получения синтетических волокон.
Циклопропан используют для наркоза. Применение данного соединения имеет некоторые ограничения по причине взрывоопасности.
Циклоалканы (циклопарафины) – органические насыщенные соединения, атомы углерода в молекулах которых, соединяясь образуют циклы. Общая формула – CnH2n . Строение, получение и свойства циклоалканов отличаются от свойств нормальных алканов с тем же числом углеродных атомов.
В молекулах циклоалканов углеродные атомы связаны между собой σ – связями. Устойчивость циклопарафинов, т.е. прочность С-С связей возрастает с увеличением количества атомов углерода, образующих цикл. Циклы делят на малые (С3, С4) и обычные (C5 – С7).
В качестве представителя малого цикла рассмотрим циклопропан:

В отличие от трехчленных циклов, устойчивость пяти- и шестичленных циклических алканов на столько высока, что они не способны к разрыву.
В качестве представителя обычного цикла рассмотрим циклогексан.
Для молекулы циклогексана не характерно плоское строение, напротив — ей присуще несколько форм — конформаций. Наиболее выгодной с энергетической точки зрения являются конформации кресла (более устойчива) и ванны. Валентные углы образованные гибридными орбиталями атомов углерода в цикле равны 109,5°, атомы водорода у соседних атомов углерода расположены относительно друг друга в положении энергетически выгодном.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей устойчивости обычных циклов по сравнению с малыми. Для них возможны реакции замещения и невозможны реакции присоединения.
Физические свойства циклоалканов
При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами. С увеличением размера цикла, температуры кипения и плавления растут. Циклоалканы С3 — С4 представляют собой газы, С5 — С16 — жидкости, C17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка.
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:

Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.

- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:

Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
1. Реакции присоединения




- Взаимодействие с сильными карбоновыми кислотами:
2. Реакции замещения (радикальный механизм)


3. Реакция дегидрирования
В присутствии катализатора ведет к образованию бензола:

4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
Атомы углерода в молекулах циклоалканов связаны между собой только σ – связями. Циклоалканы широко распространены в природе. Они входят в состав нефти, смоляных кислот, стероидных гормонов, простограндинов, терпенов, витаминов и т.д.
Существует несколько классификаций циклоалканов: по числу атомов углерода в цикле, по количеству циклов в молекуле, по способу соединения циклических составляющих и т.д.
Устойчивость циклоалканов связана с степенью напряжения энергетического состояния молекулы. Устойчивость циклоалканов тем ниже, чем меньше атомов углерода входит в состав цикла.
Для циклоалканов характерна изомерия углеродного скетлета, стерео- или цис-транс-изомерия, пространственная изомерия а также межклассовая изомерия с алкенами.
Химические свойства циклоалканов
Для малых циклоалканов (С3-С4) характерны реакции присоединения, протекающие по радикальному механизму, в результате чего может происходить даже разрыв цикла. К таким реакциям относят галогенирование, которое проводят под действием УФ-излучения и при нагревании. Температура нагрева влияет на характер продуктов реакции присоединения хлора, присоединение брома, вне зависимости от внешних факторов протекает с разрывом цикла:
![]()
C).
Для малых циклов характерны реакции гидрирования, в результате которых образуются алканы. Условием протекания реакции служит нагрев и присутствие катализатора – никеля или платины:
Для циклоалканов среднего размера (С5-С6) характерны реакции замещения, протекающие по радикальному механизму, например, галогенирование. В этом случае получают моногалогенпроизводные циклоалканов. Однако, можно получить и полигалогенпроизводные циклоалканов:
Окисление циклоалканов приводит к образованию двухосновных карбоновых кислот, циклических спиртов или циклических кетонов:
Для циклоалканов характерны реакции изомеризации:
Реакция дегидрирования циклогексана и его производных – один из способов получения бензола и его гомологов (реакция протекает при нагревании и в присутствии катализатора – платины):
Физические свойства циклоалканов
Низшие циклоалканы (С3-С4) – газообразные вещества, средние (С5-С11) – жидкости, а высшие (> C12) – твердые вещества. Циклоалканы практически нерастворимы в воде. С ростом молекулярной массы, температура плавления циклоалканов увеличивается.
Получение циклоалканов
Низшие циклоалканы получают путем их синтеза из дигалогенпроизводных алканов:
Средние циклоалканы получают следующим способом:
Циклоалканы с 5-ю и более атомами углерода можно получить пиролизом кальциевых или натриевых солей двухосновных карбоновых кислот (метод Ружичка). Циклогексан и его производные получают из нефти или по реакции гидрирования бензола и его гомологов.
Примеры решения задач
| Задание | Относительная плотность паров циклоалкана по азоту равна 5. Определите формулу циклоалкана и назовите его. |
| Решение | Пусть формула циклоалкана СхНу. Рассчитаем молекулярную массу циклоалкана с использованием значения его относительной плотности паров по азоту: |
Формула циклоалканов в общем виде – CnH2n, выведем формулу для вычисления молекулярной массы циклоалкана с использованием общей формулы:
Приравняем полученные значения молекулярных масс:
Следовательно, формула циклоалкана – С10Н20, это циклодекан.
| Задание | 1,875 г органического соединения при н.у. занимает объем, равный 1л. При сжигании 4,2 г этого вещества образуется 13,2 г углекислого газа и 5,4 г воды. Определите формулу органического соединения. |
| Решение | Количества вещества газообразного соединения можно определить с использованием следующих формул: |
Приравняем правые части записанных выше формул и выразим молярную массу:
Тогда молярная масса органического соединения будет равна:
M = 1,875×22,4/1 = 42 г/моль.
При сжигании органических веществ углерод преобразуется в углекислый газ, а водород – в воду. Составим пропорции:
Согласно 1 уравнению n(C):n(CO2) = 1:1, следовательно n(C) = n(CO2) = 5,4/18×2 = 0,3 моль. Масса углерода будет равна 3,6 г. Согласно 2 уравнению n(H):n(H2O) = 2:1, следовательно n(H) = 2×n(H2O) = 13,2/44 = 0,6 моль. Масса углерода будет равна 0,6 г. Проверим наличие кислорода в составе органического соединения:
m(O2) = m – m(C) – m(H) = 4,2 – 3,6 – 0,6 = 0г.
Следовательно, в составе органического соединения нет кислорода. Составим пропорцию:
Следовательно, формула СН2. Молярная масса – 14 г/моль, однако, известно (см. вычисления выше), что истинная молярная масса вещества 42г/моль. Тогда:
По физическим свойствам циклоалканы мало отличаются от линейных алканов, имеющих то же число атомов в молекулах.
Циклопропан и циклобутан – газы, циклопентан и циклогексан – жидкости (они входят в состав некоторых сортов нефти, отсюда еще одно их название – нафтены), высшие циклоалканы – твердые вещества.
Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях.
Читайте также:

