Физические свойства бензола и его гомологов кратко
Обновлено: 05.07.2024
Бензол (циклогексатриен – 1,3,5) – органическое вещество, простейший представитель ряда ароматических углеводородов.
Формула – С6Н6 (структурная формула – рис. 1). Молекулярная масса – 78, 11.
Рис. 1. Структурные и пространственная формулы бензола.
Все шесть атомов углерода в молекуле бензола находятся в sp 2 гибридном состоянии. Каждый атом углерода образует 3σ-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Шесть атомов углерода образуют правильный шестиугольник (σ-скелет молекулы бензола). Каждый атом углерода имеет одну негибридизованную р-орбиталь, на которой находится один электрон. Шесть р-электронов образуют единое π-электронное облако (ароматическую систему), которое изображают кружочком внутри шестичленного цикла. Углеводородный радикал, полученный от бензола носит название C6H5 – — фенил (Ph-).
Химические свойства бензола
Для бензола характерны реакции замещения, протекающие по электрофильному механизму:
— галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3)
— нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот)
— алкилирование по Фридею-Крафтсу
Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях:
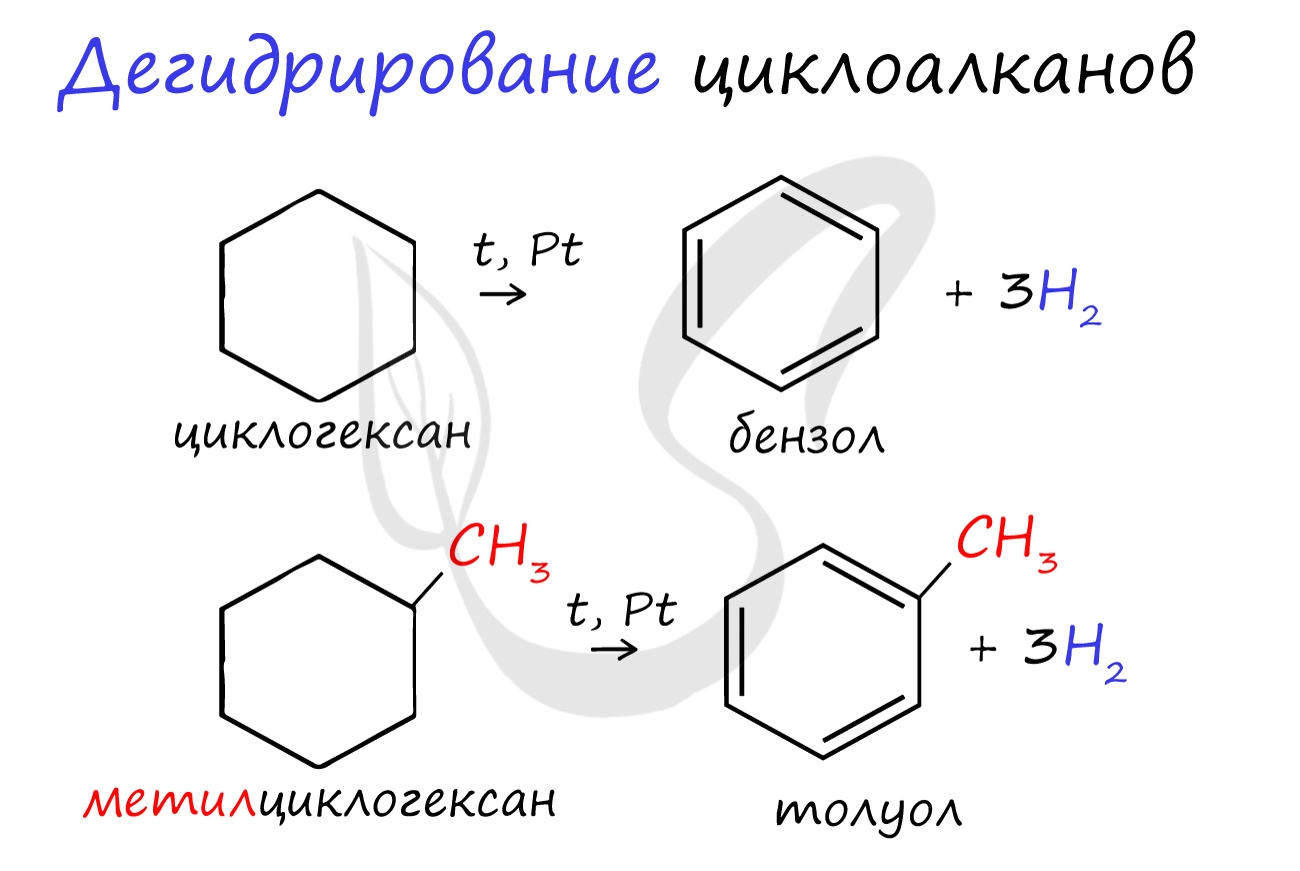
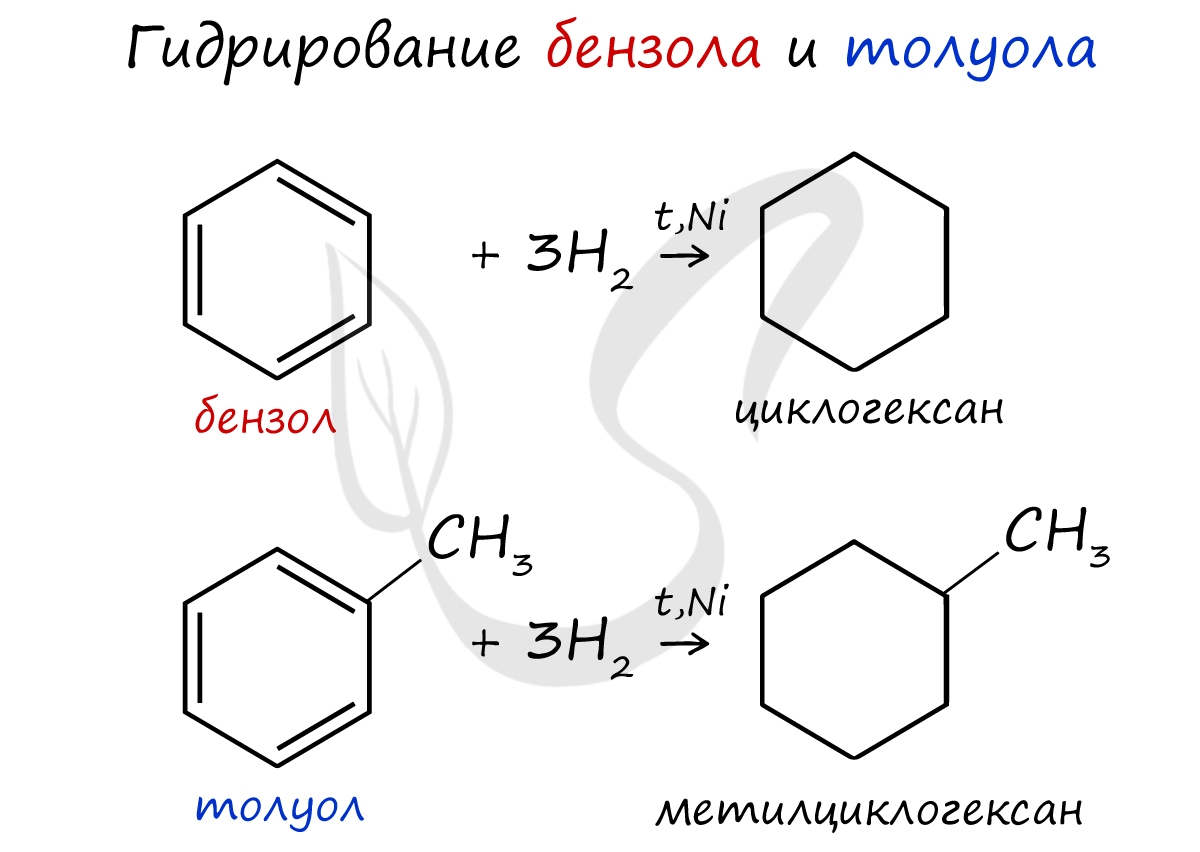
— гидрирование (реакция протекает при нагревании, катализатор – Pt)
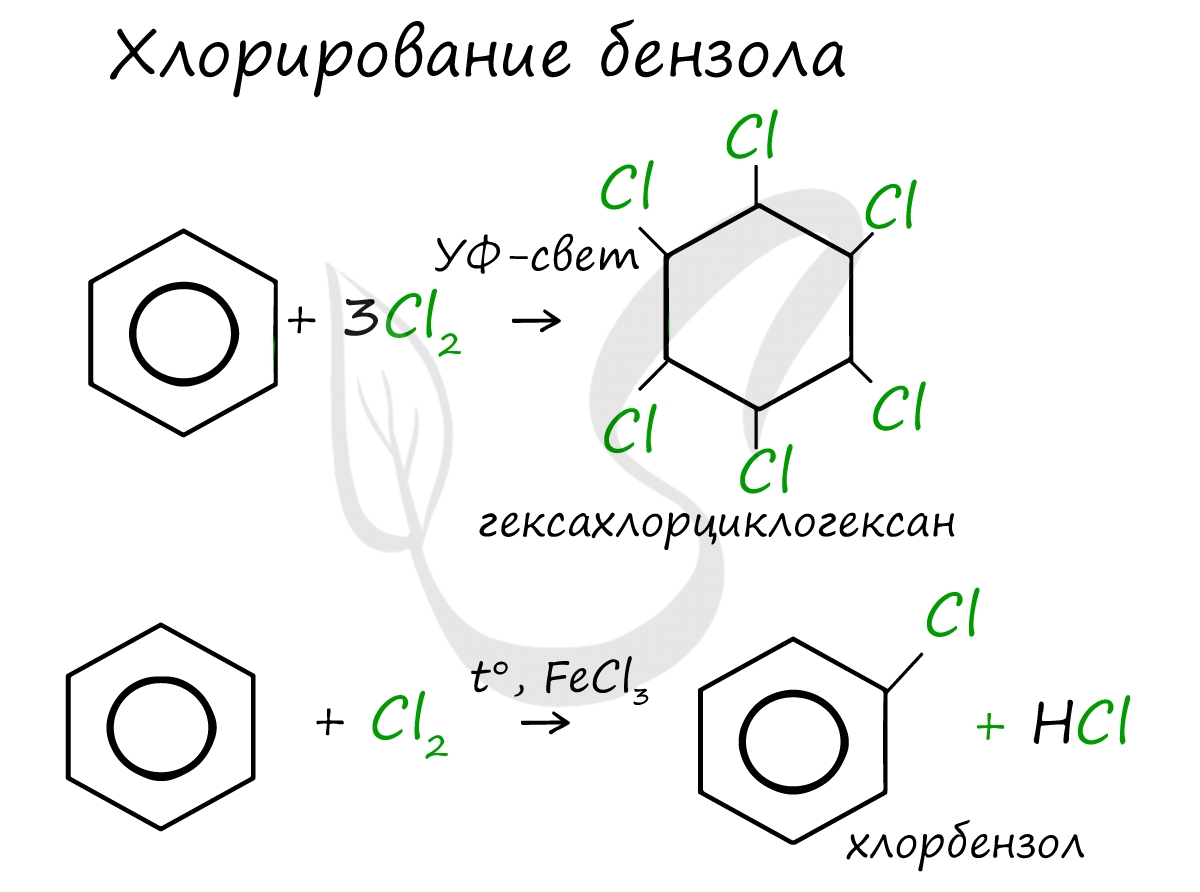
— присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6)
Как и любое органическое соединение бензол вступает в реакцию горения с образованием в качестве продуктов реакции углекислого газа и воды (горит коптящим пламенем):
Физические свойства бензола
Бензол – жидкость без цвета, но обладающая специфическим резким запахом. Образует с водой азеотропную смесь, хорошо смешивается с эфирами, бензином и различными органическими растворителями. Температура кипения – 80,1 " width="6" height="7" />
С, плавления – 5,5 " width="6" height="7" />
С. Токсичен, канцероген (т.е. способствует развитию онкологических заболеваний).
Получение и применение бензола
Основные способы получения бензола:
— дегидроциклизация гексана (катализаторы – Pt, Cr3O2)
— дегидрирование циклогексана (реакция протекает при нагревании, катализатор – Pt)
![]()
С, катализатор – активированный уголь)
Бензол служит сырьем для производства гомологов (этилбензола, кумола), циклогексана, нитробензола, хлорбензола и др. веществ. Ранее бензол использовали в качестве присадки к бензину для повышения его октанового числа, однако, сейчас, в связи с его высокой токсичностью содержание бензола в топливе строго нормируется. Иногда бензол используют в качестве растворителя.
Примеры решения задач
| Задание | Запишите уравнения, с помощью которых можно осуществить следующие превращения: CH4 → C2H2 → C6H6 → C6H5Cl. |
| Решение | Для получения ацетилена из метана используют следующую реакцию: |
2CH4 → C2H2 + 3Н2↑ (t " width="6" height="7" />
= 1400 " width="6" height="7" />
C).
Получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании (t " width="6" height="7" />
= 600 " width="6" height="7" />
C) и в присутствии активированного угля:
Реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (III):
| Задание | К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль бромной воды. Какое количество вещества и сколько граммов каких продуктов при этом получилось? |
| Решение | Запишем уравнение реакции бромирования бензола в присутствии хлорида железа (III): |
Продуктами реакции являются бромбензол и бромоводород. Молярная масса бензола, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 78 г/моль. Найдем количество вещества бензола:
По условию задачи бензол вступил в реакцию с 1 моль брома. Следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу. Согласно уравнению реакции n(C6H6): n(C6H5Br) : n(HBr) = 1:1:1, следовательно n(C6H6) = n(C6H5Br) = : n(HBr) = 0,5 моль. Тогда, массы бромбензола и бромоводорода будут равны:
Молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 157 и 81 г/моль, соответственно.
Бензол является ароматическим углеводородным соединением, представляющим собой прозрачную жидкость, которая имеет слегка сладковатый запах. Структурная формула бензола - C6H6.
Это вещество является составной частью нефтепродуктов, применяется в промышленной и медицинской областях, входит в состав пластмассы, резины и различных красок.
Характеристики и физические свойства бензола
Некоторые углеводородные соединения сильно похожи на бензол. Однако они отличаются видом реакции, в которую вступают. Так, этилен, являющийся ненасыщенным углеводородом, вступает в реакцию присоединения, в то время как бензол вступает в реакцию замещения. Это происходит из-за того, что атомы бензола располагаются в одной плоскости.
Еще одним отличием является наличие в формуле бензола бензольного кольца. Таким образом, если в химической формуле вещества имеется бензольное кольцо — однозначно это бензол.
Строение этого углеводорода представлено в виде шестиугольника.
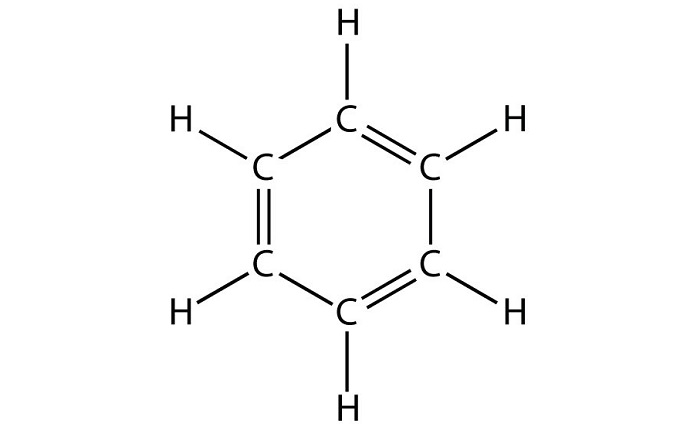
Данный углеводород имеет следующие физические свойства:
вещество представляет собой жидкость, имеющую не совсем приятный запах;
температура плавления бензола составляет 5,5 0 C;
температура кипения — 80 0 C;
общая плотность вещества — 0,879 г/см 3 ;
молярная масса 78,1 г/моль;
без проблем реагирует с органическими растворителями;
при попадании воздуха образует взрывоопасное соединение;
в процессе горения на свету видны следы копчения;
растворим в воде, нагретой до 25 0 C.
Получение бензола
Российским ученым-химиком Зелинским Н. Д. было доказано, что бензол возможно получить не только в процессе коксования угля, при котором данное сырье нагревается, выделяя бензол и иные летучие вещества. Данное вещество может быть образовано из циклогексана, в случае взаимодействия его с платиной или палладием.
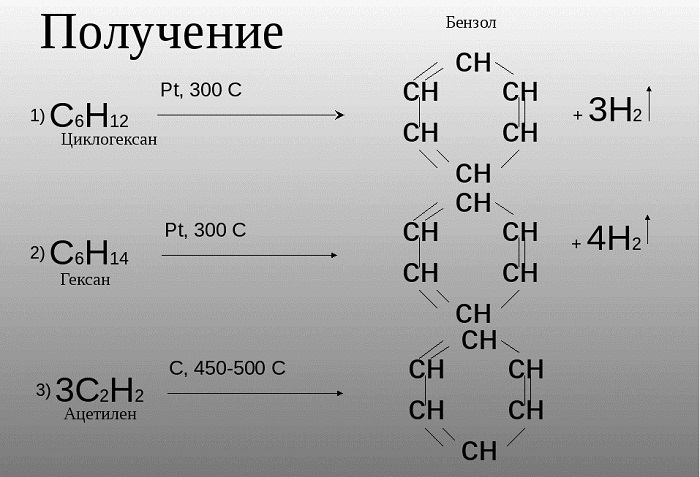
Также, бензол можно получить путем нагревания гексана.
Зелинский также считал, что бензол возможно получить путем тримеризации ацетилена:
В настоящее время, большой популярностью пользуются такие способы получения бензола, как получение его из циклопарафинов и предельных углеводородов. Связано это прежде всего, с тем, что необходимость этого вещества сильно возросла.
Химические свойства бензола
Бензол активно вступает в реакции с кислотами, а также веществами из класса алкенов, галогенов, аренов и хлоралканов. В основном данный углеводород вступает в реакцию замещения. Высокая температура и сильное давление оказывают влияние на разрыв бензольного кольца.
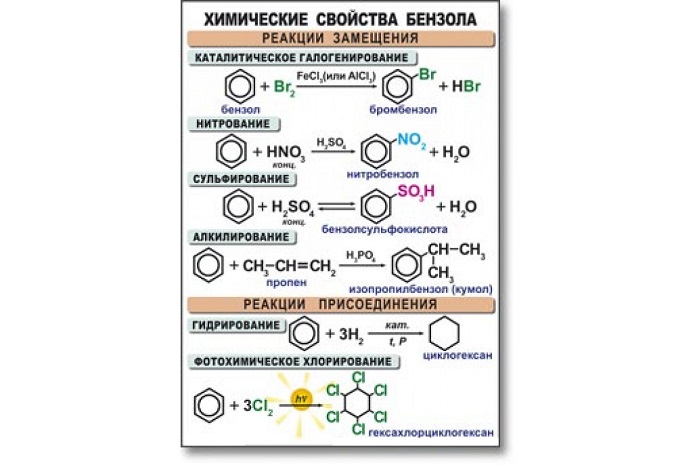
Уравнения реакции бензола:
- в случае наличия катализатора, бром вступает в реакцию с хлором, образуя при этом хлорбензол:
- алкилирование бензола. Алкилбензол образуется в результате соединения бензола с алканами:
- к гомологам бензола относятся алкилбензолы, которые вступают в реакцию окисления, образуя при этом бензойную кислоту:
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.

Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
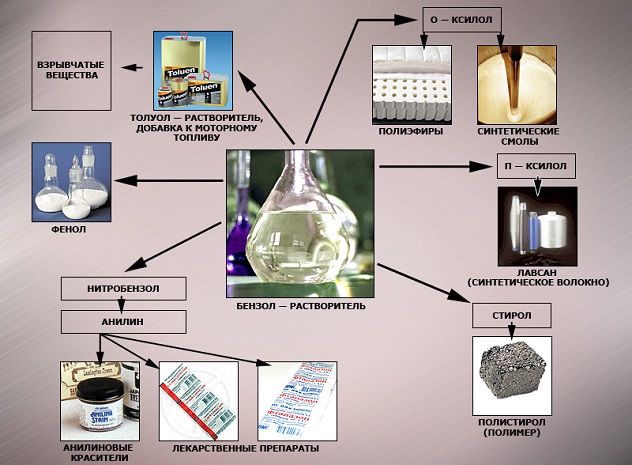
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Арены - ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда - бензол - C6H6. Общая формула их гомологического ряда - CnH2n-6.
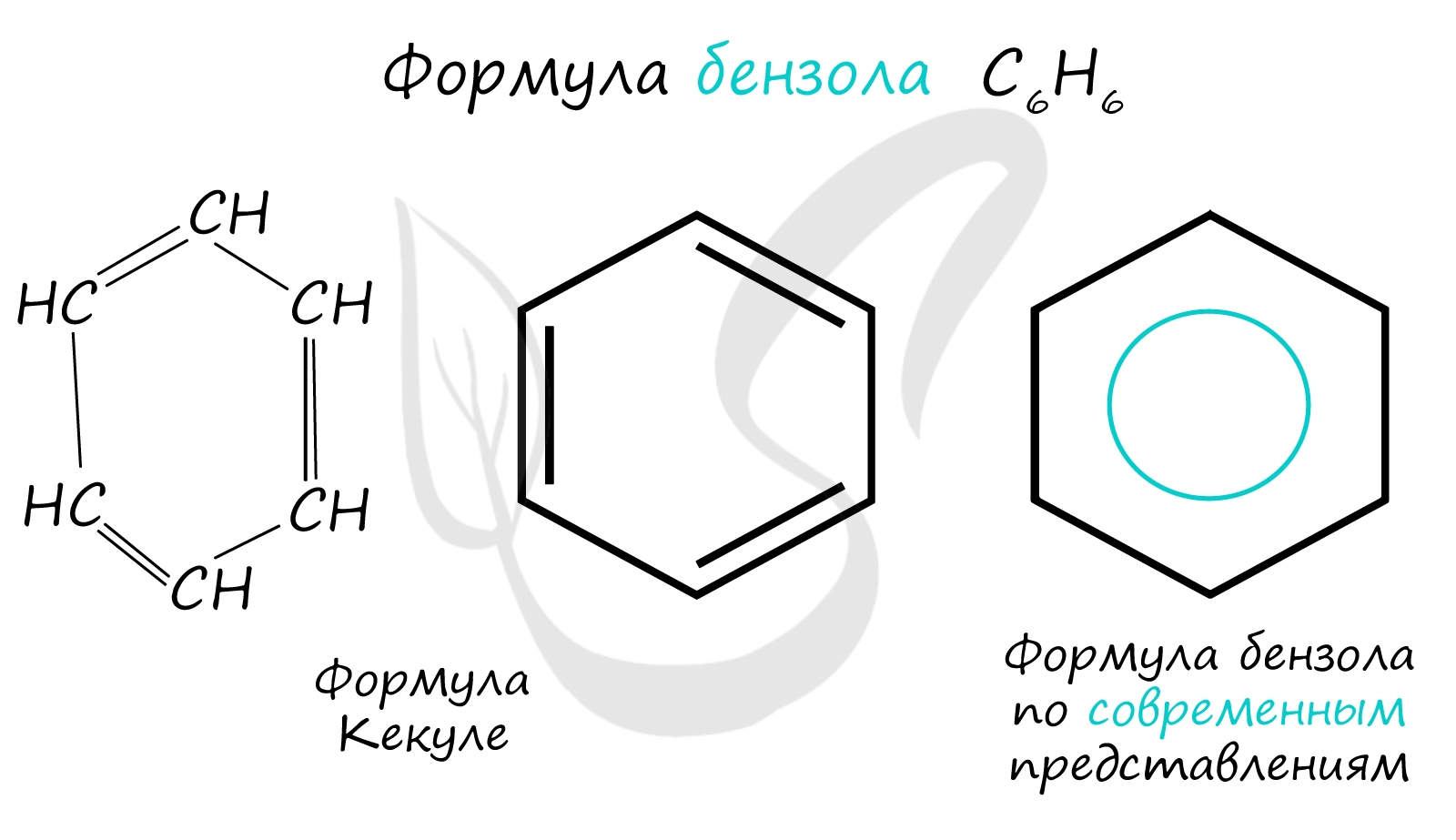
Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с тремя двойными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям двойные связи в молекуле бензола постоянно перемещаются, поэтому более верно рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp 2 гибридизации. Валентный угол - 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
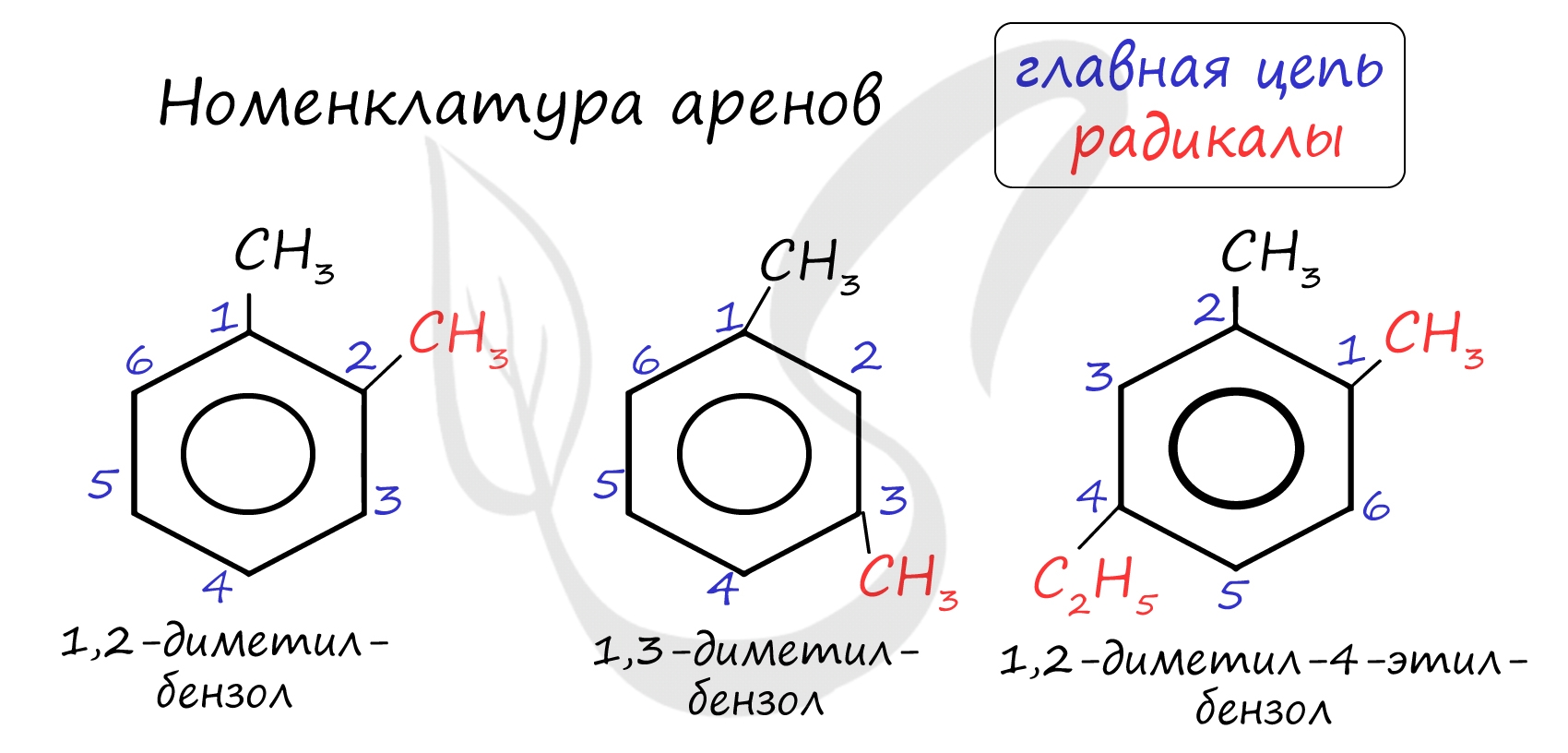
Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
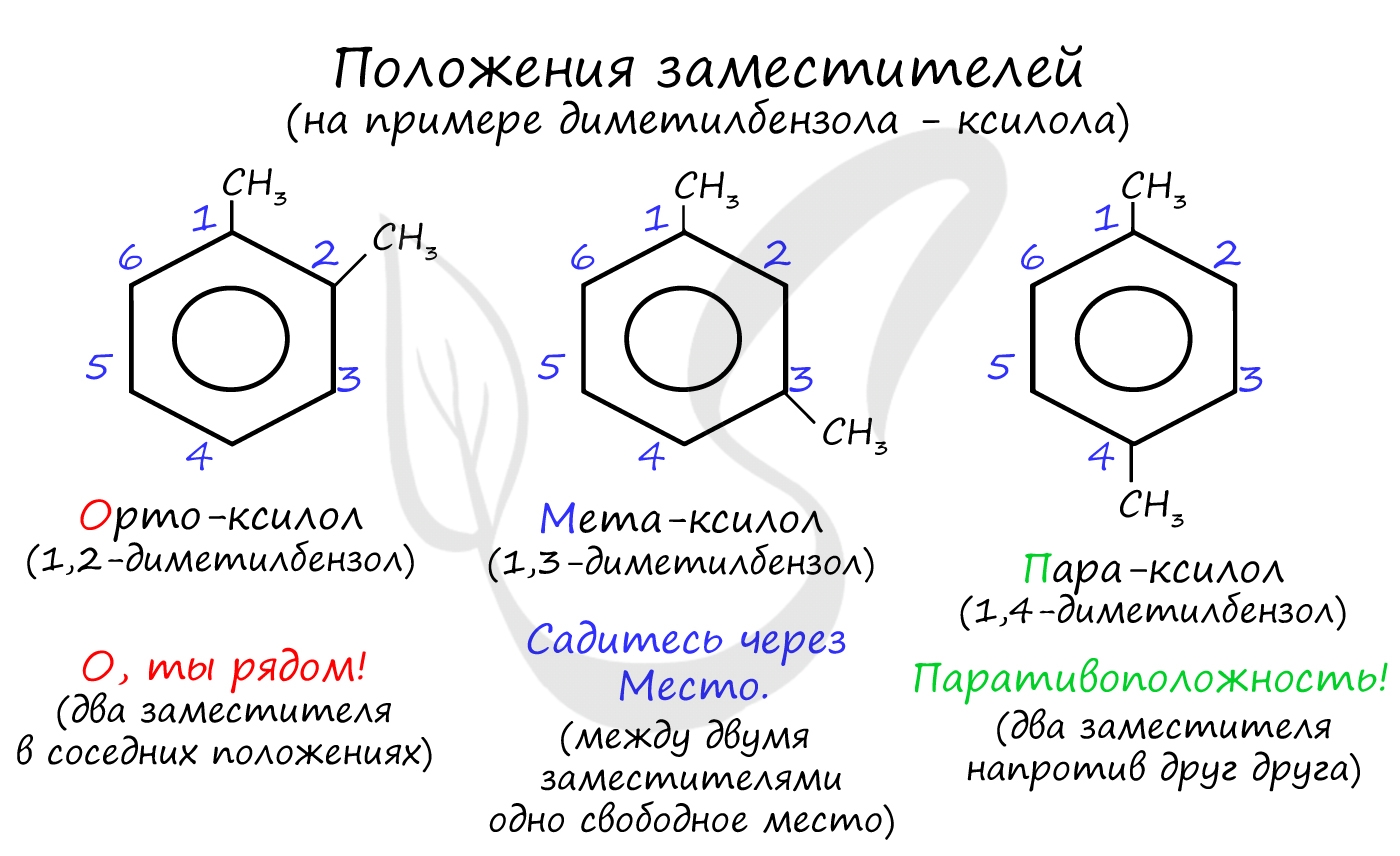
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ;)
Получение аренов
-
Реакция Зелинского (тримеризация ацетилена)
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород - бензол.
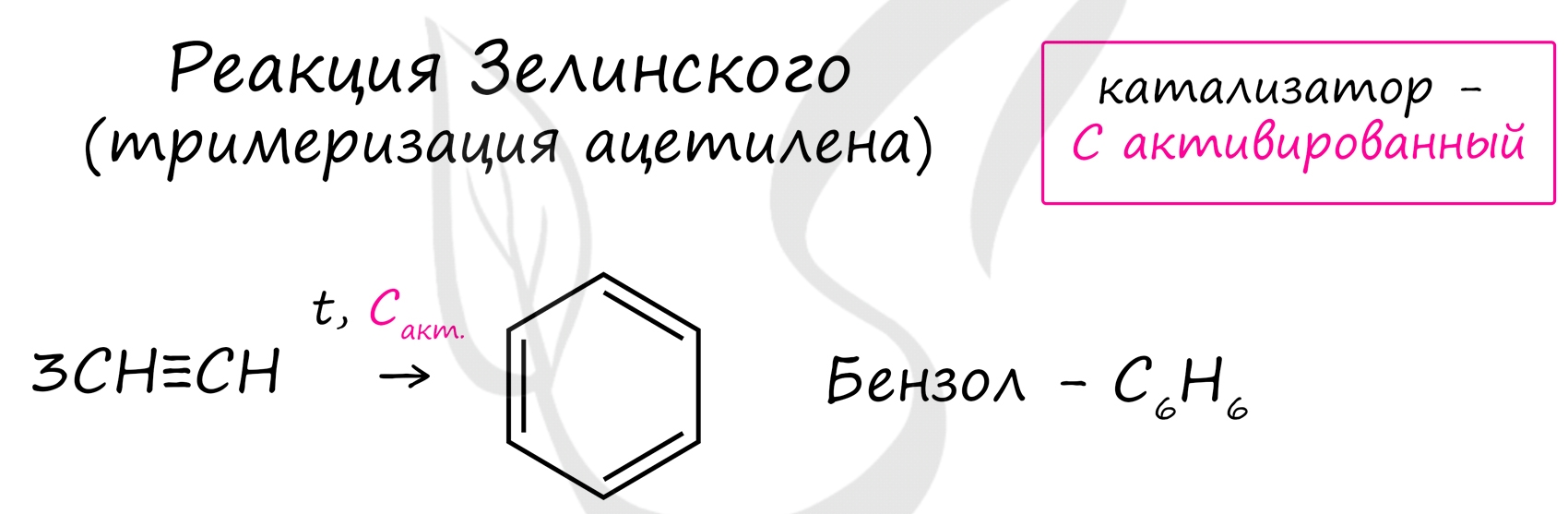
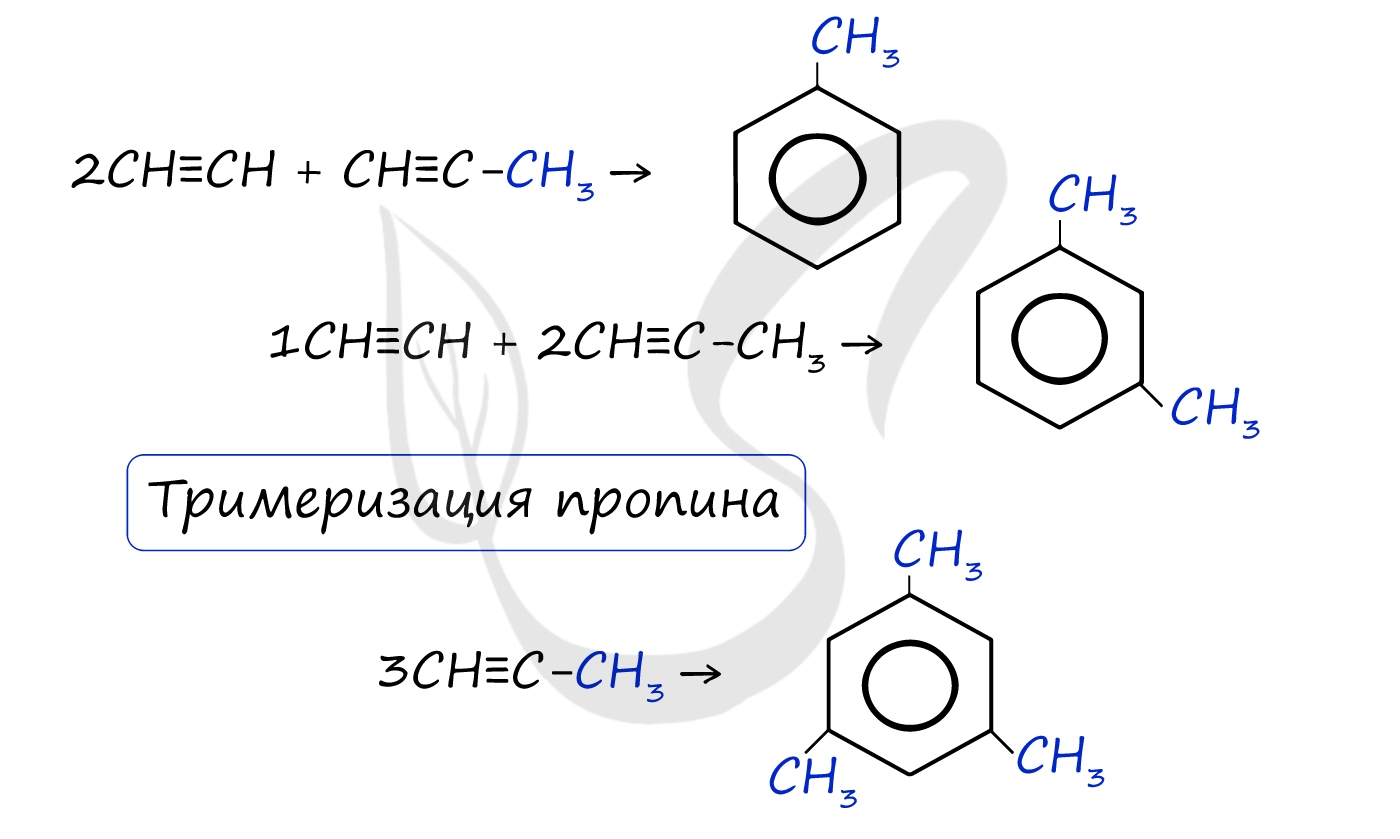
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
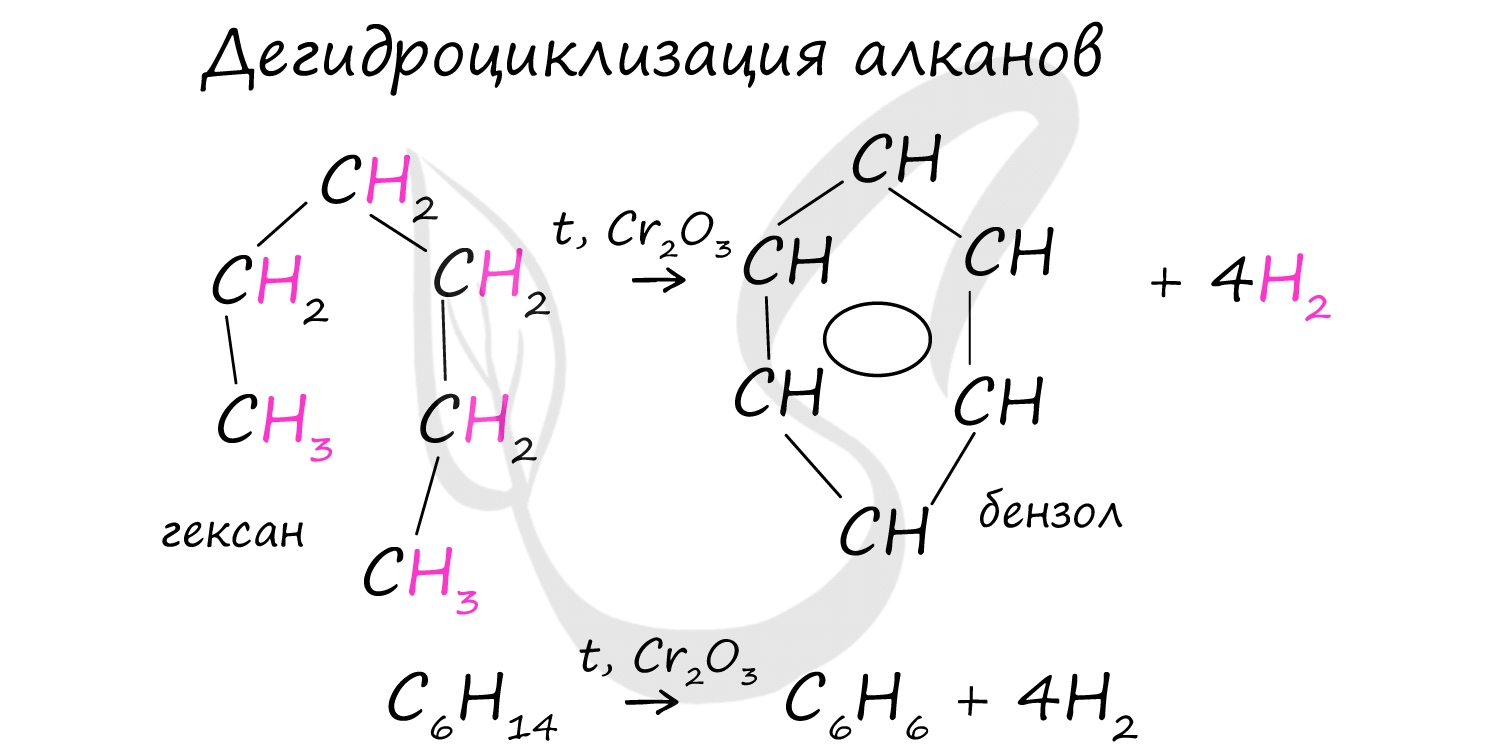
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора - Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.
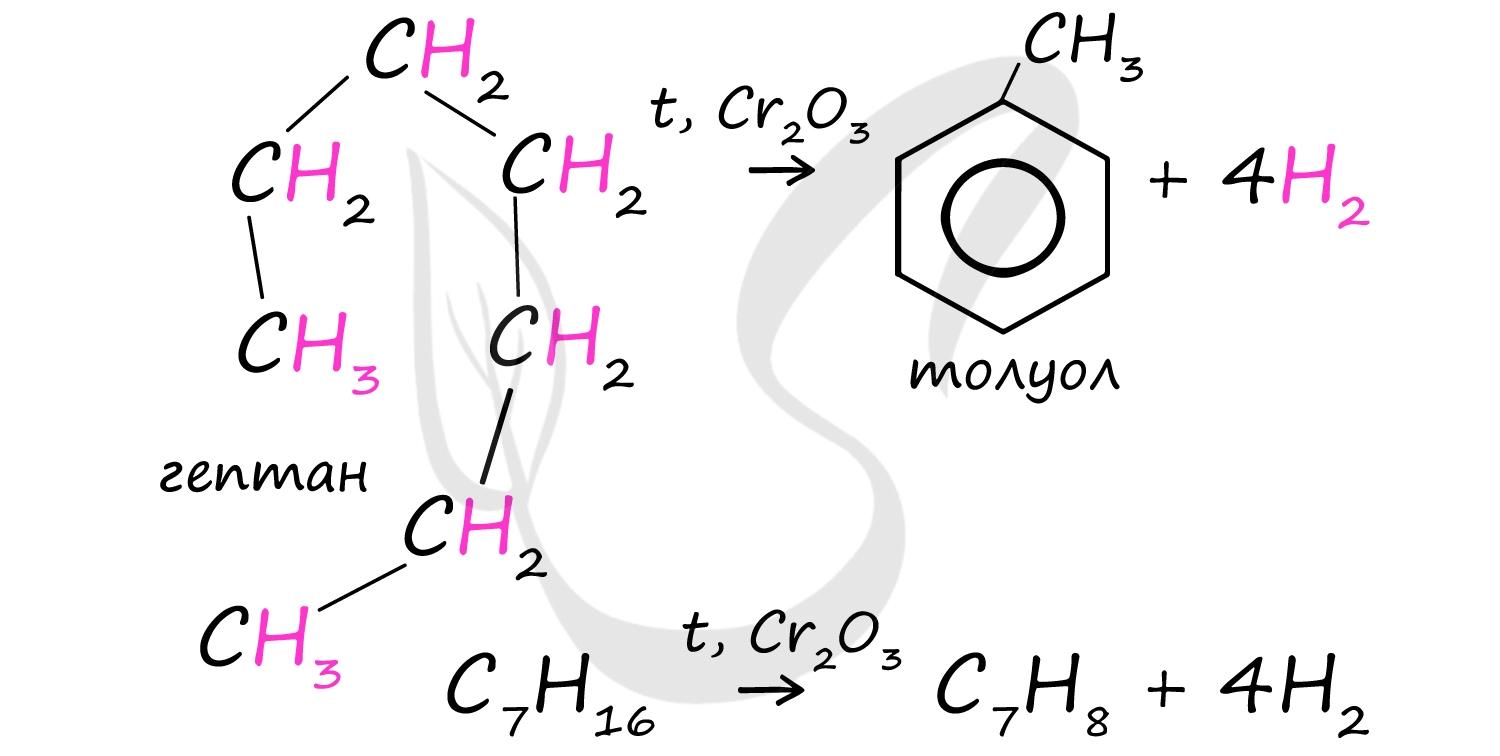
При дегидроциклизации гептана получается толуол.
В результате дегидрирования уже "готовых" циклов - циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана.
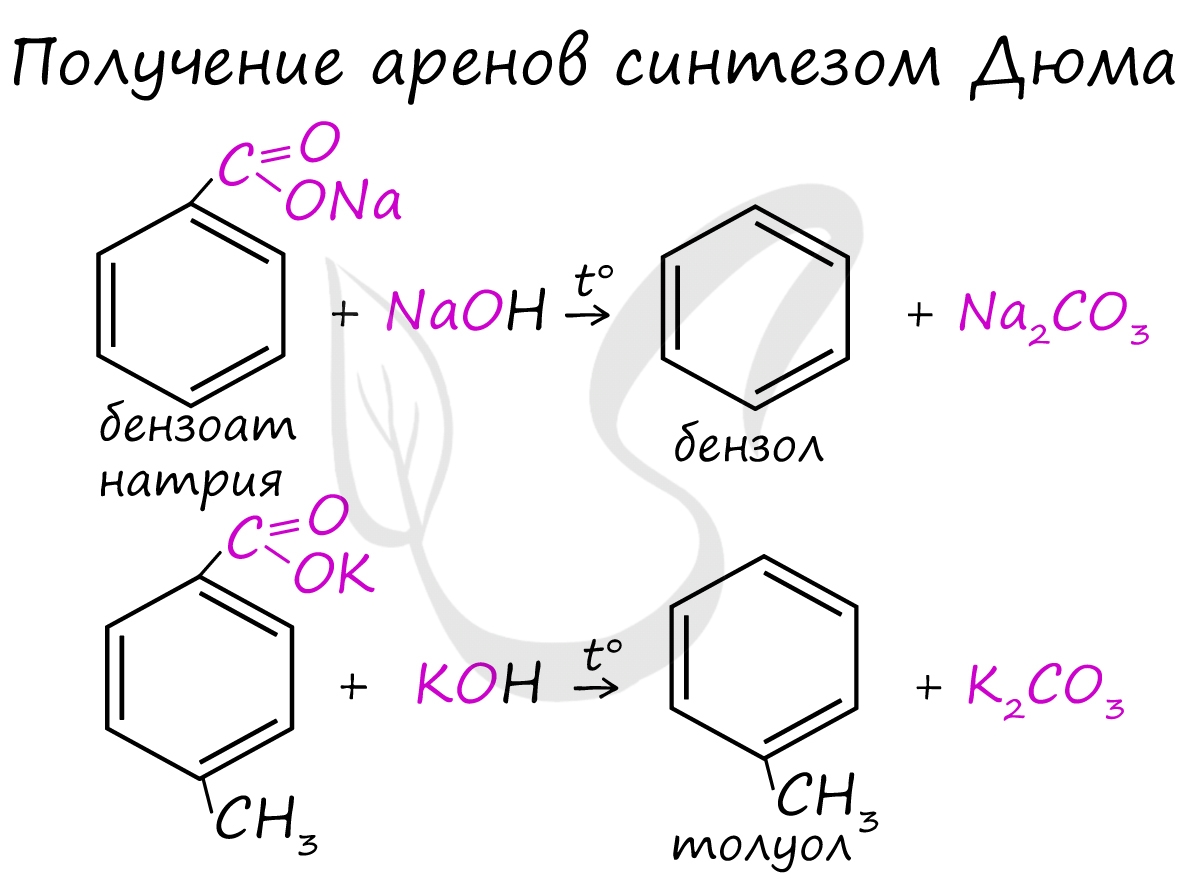
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов.
Химические свойства аренов
Арены - ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан.
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол.
Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении).
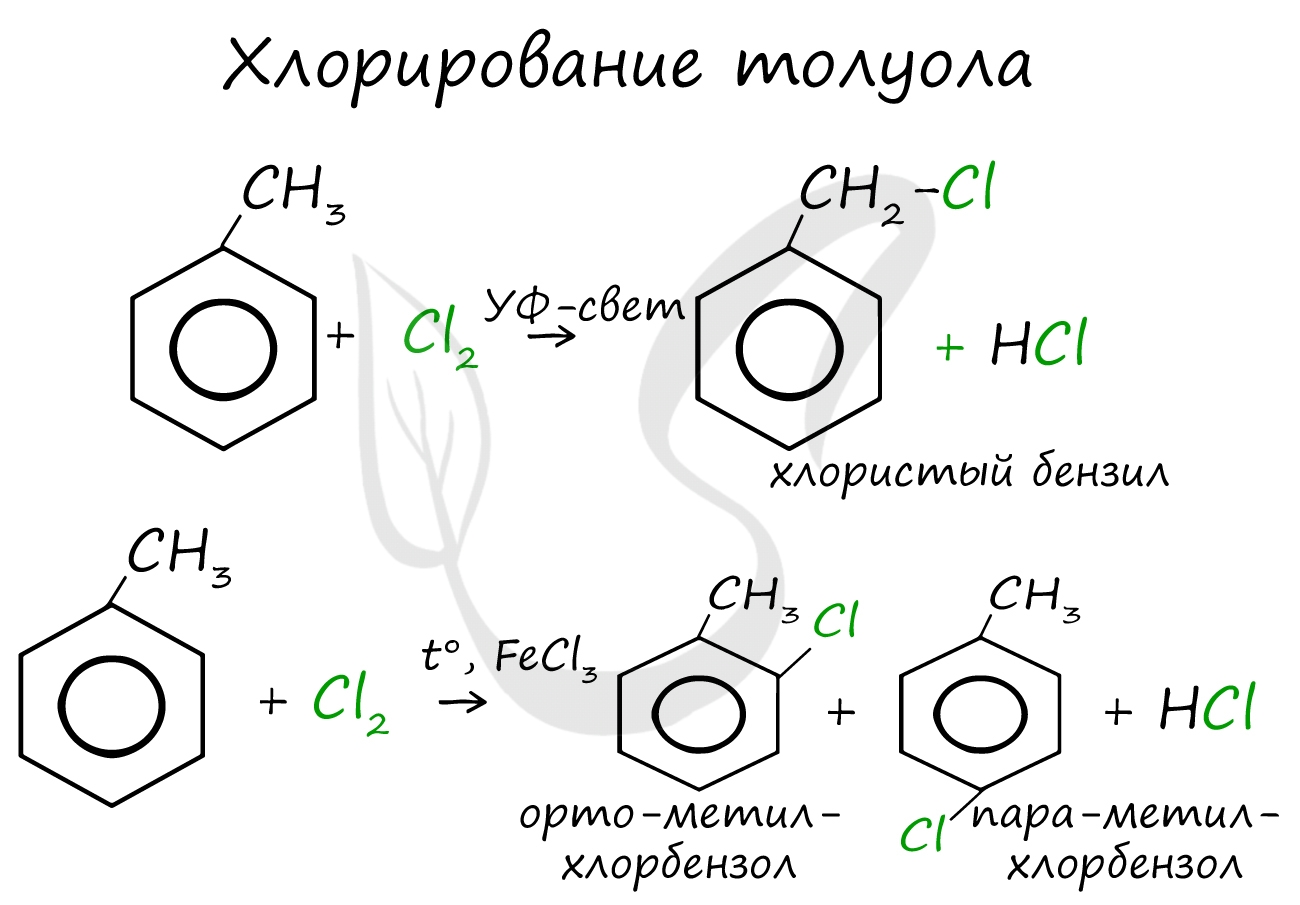
Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты).
К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR.
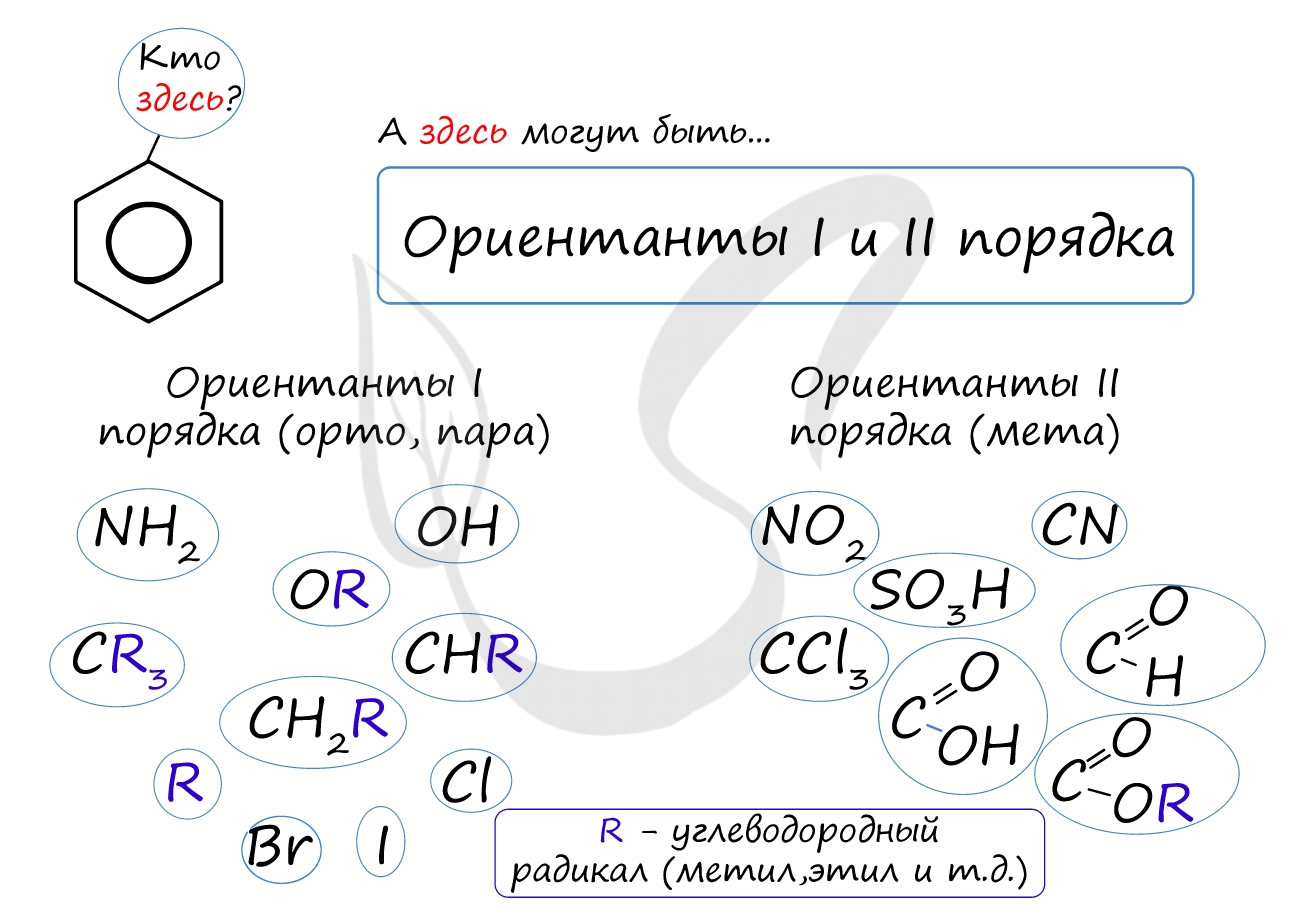
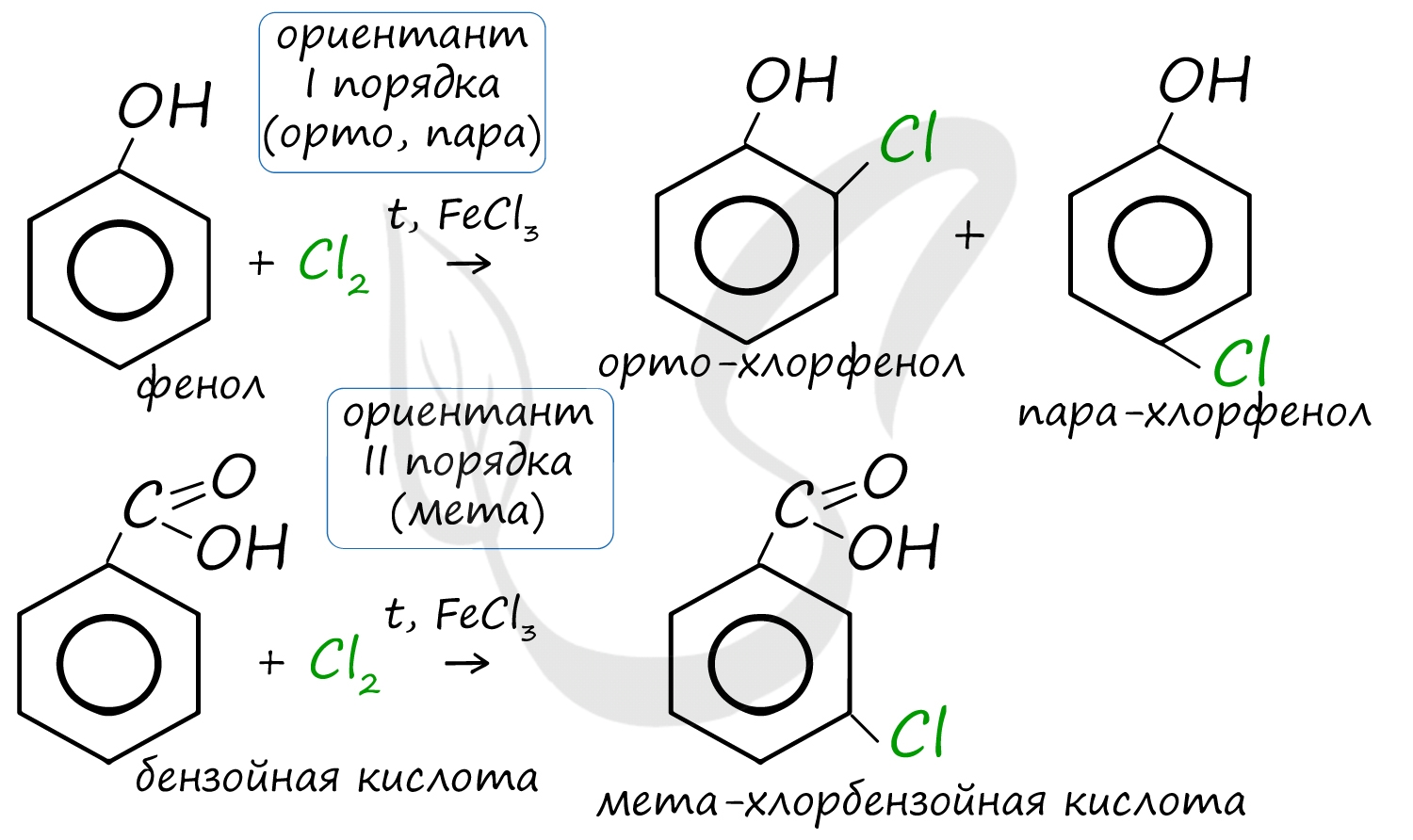
Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
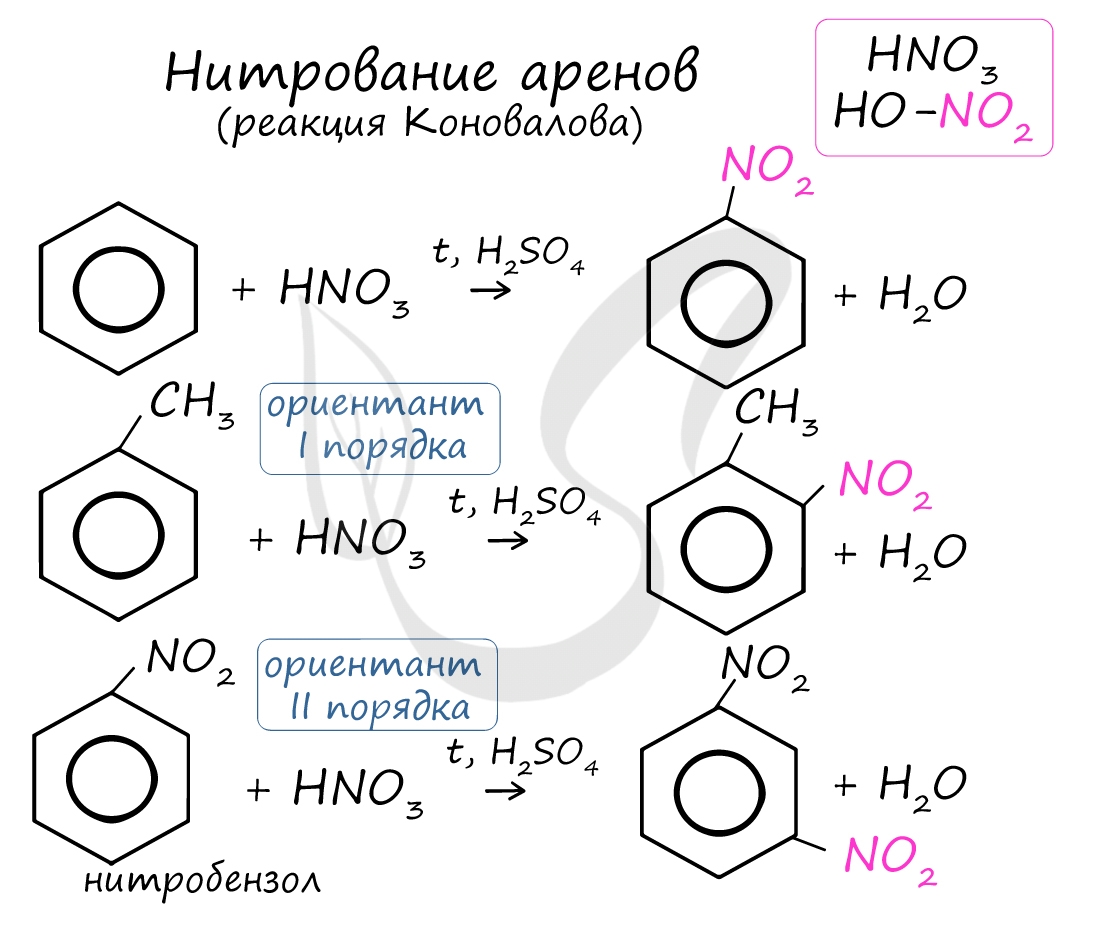
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
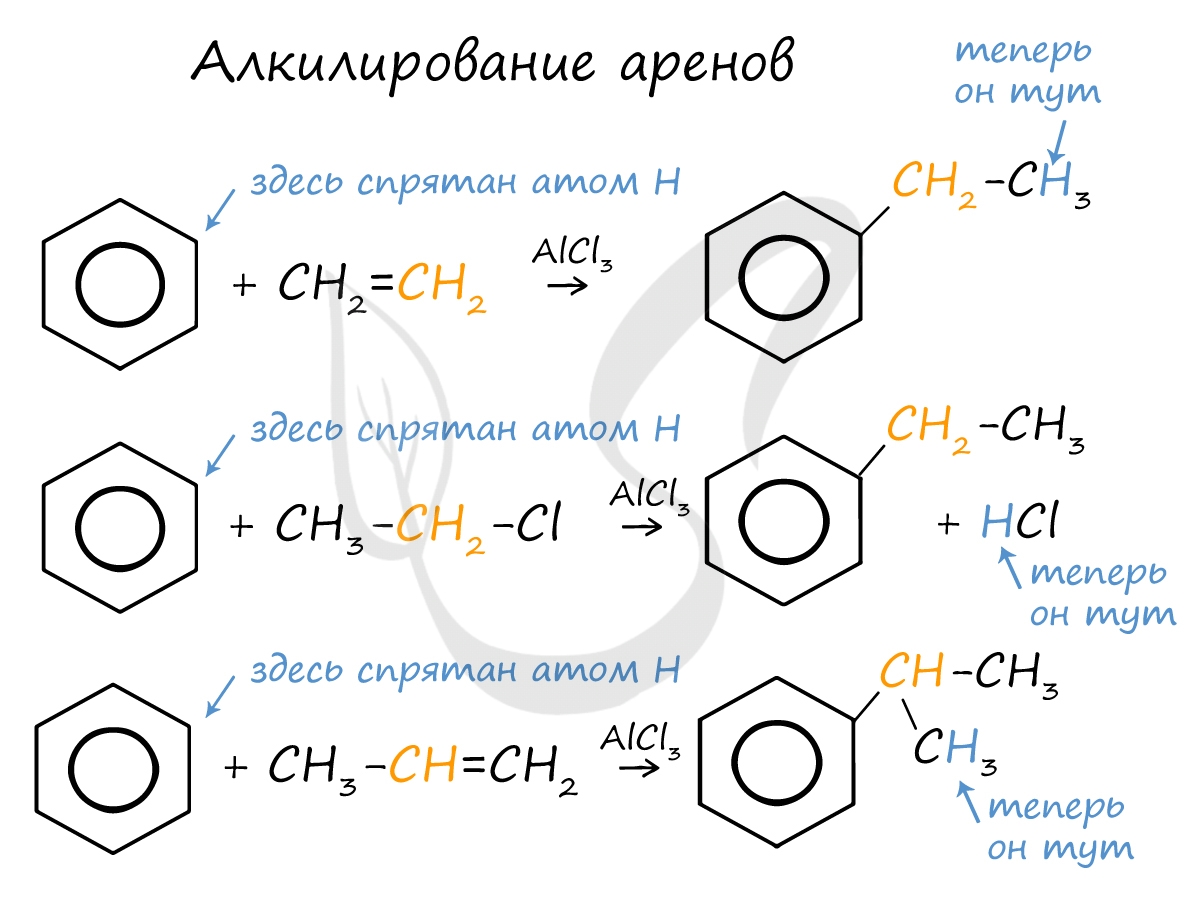
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В подобных реакциях используют катализатор AlCl3.
В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
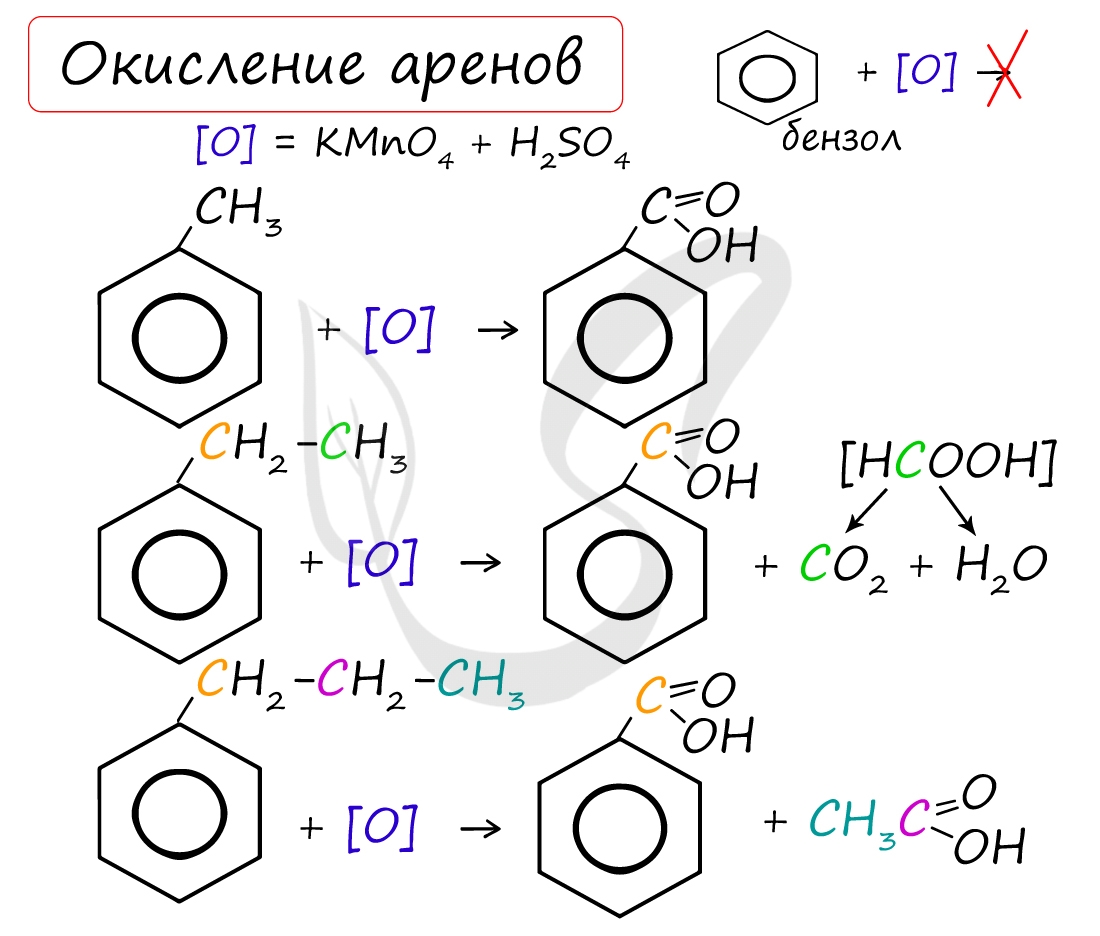
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды.
При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
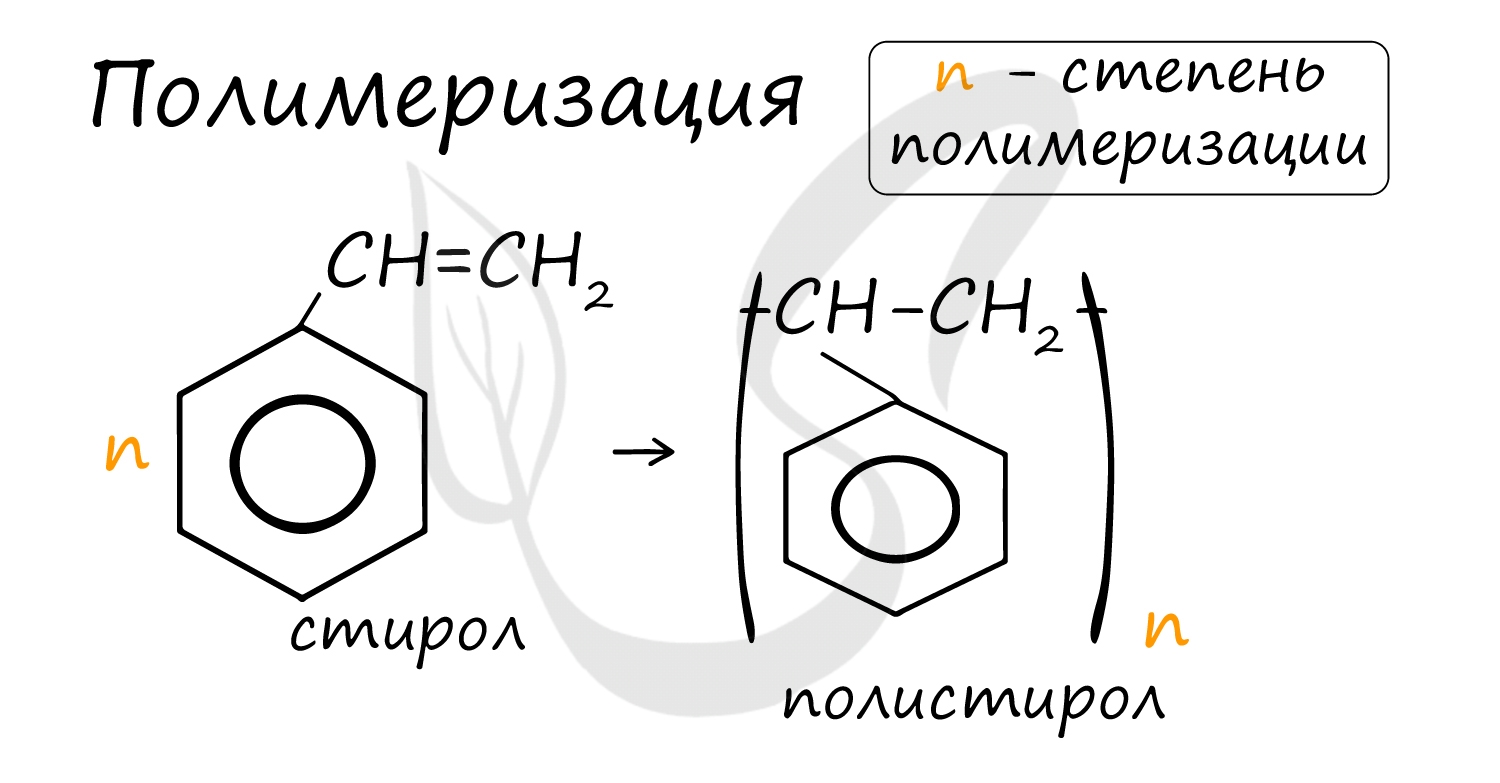
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи

Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое -электронное облако с делокализованной плотностью. Сочетание прочных -связей и -облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.

При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.

Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой . Гомологическая разность выражается через звено углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:

Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:


Арильные (содержащие бензольное ядро) радикалы носят следующие названия:

Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов

Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом .
Строение углеродного скелета

В зависимости от количества, состава и строения алкильных заместителей для соединений состава характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.



При наименовании алкилбензолов соблюдаются следующие правила:



Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:


Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:

В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:

Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:

При этом галоген атакует ближайший к кольцу углеродный атом.
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:


Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:

Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:



Водород может замещаться ацильным остатком галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.

Из всех соединений гомологического ряда хлор присоединяется только к бензолу:

При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:


В кислой среде происходит образование бензойной кислоты:

Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:

Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:

Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:


Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
Читайте также:

