Физические свойства белков кратко
Обновлено: 05.07.2024
Цель урока: сформировать понятие о белке, его структуре, физических и химических свойствах.
I. Организационный момент
II. Актуализация знаний
Два ученика работают у доски.
Задание 1. Напишите формулы 2-аминопропановой кислоты (аланина) и 3-метил-2-аминобутановой кислоты (валина). Какие еще названия для этих кислот вы можете предложить?
Задание 2. Напишите формулу 2-аминоэтановой кислоты. Какие еще названия этой кислоты вам известны? Составьте дипептид из двух остатков этой кислоты. Укажите место пептидной связи.
Фронтальная беседа.
– Какие две функциональные группы входят в состав аминокислот?
– Что представляют собой аминокислоты с точки зрения кислотно-основных свойств? За счет каких функциональных групп реализуются эти свойства?
– Дайте понятие пептидной связи.
– Могут ли аминокислоты образовывать водородные связи? За счет каких групп атомов?
– Какие вещества называются полимерами? Приведите примеры известных вам полимеров.
III. Постановка познавательной задачи
Учащиеся, работавшие у доски, отчитываются о выполненном задании.
На доске изображен дипептид, состоящий из двух остатков глицина, и приведены формулы двух аминокислот: аланина и валина.
Может ли образоваться дипептид из разных по составу аминокислот? (Слайд 1.) Для того чтобы ответить на этот вопрос, обратите внимание на место пептидной связи в дипептиде.
Ответ. В образовании пептидной связи принимают участие аминогруппа одной аминокислоты и карбоксильная группа другой аминокислоты; боковые радикалы аминокислот не участвуют в образовании дипептида.
Возможно ли дальнейшее присоединение аминокислот к этому веществу? Ответ обоснуйте.
Ответ. Присоединение возможно, т.к. у молекулы дипептида имеются свободные карбоксильная группа (С-конец) и аминогруппа (N-конец). Цепь может расти с обеих сторон (слайд 2).
Сколько вариантов соединения вы можете предложить?
Ответ. Два. Когда аминокислота глицин стоит на первом месте и когда аминокислота глицин стоит на втором месте (слайд 3).
В клетках и тканях организмов обнаружено свыше 170 различных аминокислот, и из них 20 -аминокислот входят в состав важнейших биологических веществ, называемых белками. Попробуйте дать определение белка.
Ответ. Белки – это линейные биологические полимеры, состоящие из -аминокислот.
Запишите это определение в своих рабочих листках.
Перед вами две полипептидные цепочки. Какой из пептидов может входить в состав белка и почему? (Слайд 4.)
Ответ. Первый, потому что он образован -аминокислотами.
За счет каких связей образуется первичная структура белка?
Ответ. Первичная структура образуется за счет пептидных связей.
Запишите это в таблицу в рабочем листке.
Но белок гораздо более сложная макромолекула, чем линейная полипептидная цепочка. Помимо первичной структуры белка необходимо рассматривать вторичную, третичную, а в некоторых случаях и четвертичную структуры. В образовании вторичной структуры белка огромную роль играют водородные связи. Водородные связи образуются электроотрицательными атомами (кислородом, азотом и др.), с одним из которых связан атом водорода, причем все три атома находятся на одной прямой.
Существуют два типа вторичной структуры (-спираль и -структура), но в основе каждого из них лежат водородные связи (слайд 5). Запишите это в рабочие листки.
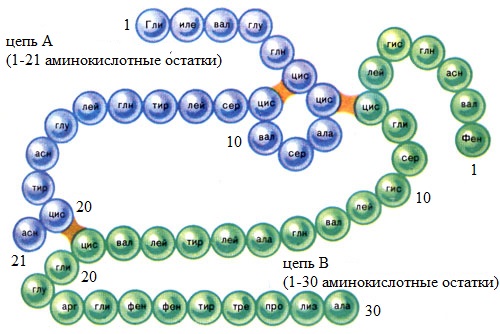
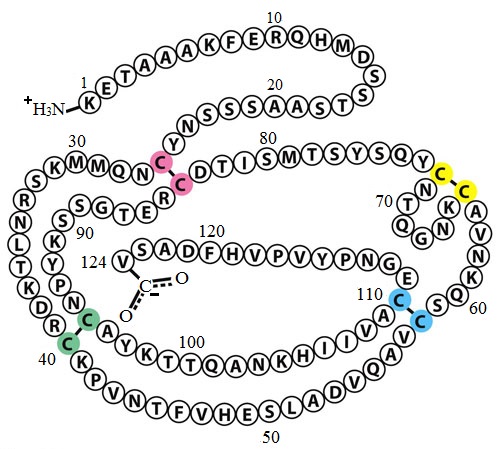
Третичная структура белка – это способ расположения -спиралей и -структур в пространстве. Она осуществляется за счет ковалентных связей между атомами серы различных аминокислот (дисульфидные мостики S–S) и гидрофильно-гидрофобных (гидро – вода; филос – любовь; фобос – ненависть) взаимодействий (слайд 6). Запишите это в рабочие листки.
Некоторые белки образуют четвертичную структуру, осуществляемую также за счет водородных связей, гидрофильно-гидрофобных взаимодействий и электростатических сил притяжения. Некоторые белки, имеющие четвертичную структуру, состоят из иона металла и белковой части, образованной несколькими белковыми цепями (разными или одинаковыми по первичной структуре) (слайд 7). Запишите в рабочие листки.
Белки осуществляют свои функции правильно только при наличии соответствующей третичной (и четвертичной, если таковая имеется) структур.
Физические свойства белков
Белки – высокомолекулярные соединения, т.е. это вещества с высокой молекулярной массой. Молекулярная масса белков составляет от 5 тыс. до миллионов а.е.м. (инсулин – 6500 Да; белок вируса гриппа – 32 млн Да).
Растворимость белков в воде зависит от их функций. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал для тканей сухожилий, мускульных и покровных. Такие белки в воде нерастворимы.
Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см 2 выдерживает вес в 5 т, а на женской косе из 200 тыс. волосинок можно поднять груженый КамАЗ весом 20 т.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности. Поэтому глобулярные белки растворимы в воде либо в растворах солей, кислот или оснований. Из-за большого размера молекул образуются растворы, называемые коллоидными. (Демонстрация растворения альбумина в воде.)
Химические свойства белков
Белки участвуют в не совсем обычных химических реакциях, т.к. они являются полимерными молекулами. Посмотрите в свои рабочие карточки и ответьте на следующие вопросы.
Какая связь является более прочной: пептидная или водородная?
Ответ. Пептидная, т.к. эта связь относится к ковалентной химической связи.
Какие структуры белков будут разрушаться быстрее и легче?
Ответ. Четвертичная (если таковая имеется), третичная и вторичная. Первичная структура будет сохраняться дольше других, т.к. она образована более прочными связями.
Денатурация – это разрушение белка до первичной структуры, т.е. пептидные связи сохраняются (слайд 8).
Демонстрация опыта. В 5 небольших пробирок налить по 4 мл раствора альбумина. Первую пробирку нагреть в течение 6–10 с (до помутнения). Во вторую пробирку добавить 2 мл 3М HCl. В третью – 2 мл 3М NaOH. В четвертую – 5 капель 0,1 М AgNO3. В пятую – 5 капель 0,1 М NaNO3.
Будут ли белки после денатурации проявлять свои специфические свойства?
Ответ. Большинство белков при денатурации утрачивают активность, т.к. белки проявляют свои специфические свойства только при наличии третичной и четвертичной структур.
Как вы полагаете, можно ли разрушить первичную структуру белка?
Ответ. Можно. Это происходит в организме при переваривании белковой пищи.
Одно из самых важных свойств белков – способность к гидролизу. При гидролизе белка происходит разрушение первичной структуры.
Какие вещества образуются при полном гидролизе белка?
Какое значение для нашего организма имеет гидролиз белков и где он происходит?
Ответ. Получение аминокислот для нужд организма в результате процессов пищеварения начинается в желудке, заканчивается в двенадцатиперстной кишке.
Цветные реакции – качественные реакции на белки:
а) биуретовая реакция (демонстрация опыта);
б) ксантопротеиновая реакция (демонстрация опыта).
Заполните рабочие листки (обратите внимание на условия протекания этих реакций, это понадобится для проведения опытов на следующем уроке).
Рабочий листок
Белки ____________________________________________________________________
__________________________________________________________________________
Типы структур белка
Название структуры
Схема строения
Тип химической связи
Физические свойства
Химические свойства
Денатурация – это разрушение белка до … структуры под действием … , а также под действием растворов различных веществ (… , … , солей) и радиации.
Гидролиз – это разрушение … структуры белка под действием … , а также водных растворов кислот или щелочей.
Качественные реакции
Белок + ____________ = ____________
Белок + ____________ = ____________
IV. Домашнее задание
Физические свойства белков так же разнообразны, как и функции, которые они выполняют.
Белки — кристаллические вещества белого цвета, в растворе – бесцветные вещества, если они не несут какой-нибудь хромофорной (окрашенной) группы, как, например, гемоглобин.
Кристаллические твердые белки – это запасные соединения.
По растворимости в воде белки бывают:
Глобулярные — растворяются в воде, образуют коллоидные растворы (белок молока – казеин, белок яйца – альбумин);
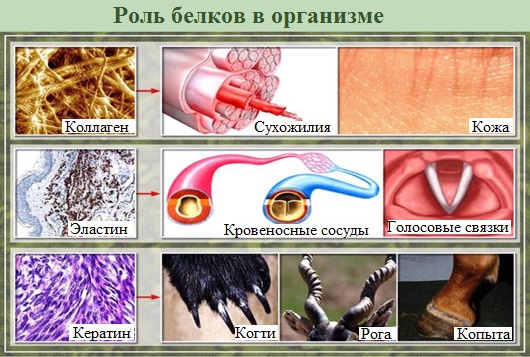
Фибриллярные — в воде не растворяются (кератин – волосы, ногти, перья; коллаген – мускулы, сухожилия; фиброин шелка).
Растворы фибриллярных белков обладают большой вязкостью. Примером может служить коллаген — белок соединительной ткани.
Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками. Фибриллярные белки – это материал тканей сухожилий, мускульных и покровных тканей.
Белки не имеют температуры плавления и кипения, так как большинство из них при нагревании сворачиваются. При высокой температуре все белки сгорают.
Некоторые белки могут быть выделены в виде кристаллов (белок куриного яйца, гемоглобин крови).
Число аминокислотных остатков, входящих в молекулы отдельных белков, весьма различно: в инсулине их 51, в миоглобине – 153.
Поэтому и молекулярная масса белков колеблется в очень широких пределах – от 10 000 до десятков миллионов.
Например, гормон инсулин имеет молекулярную массу 5733, фермент рибонуклеаза – 13700, альбумин человека — 68500, белок крови гемоглобин – 64500, фибриноген крови – 400.000, белки вирусов – 50.000.000.

На основе определения молекулярной массы и элементарного анализа установлена эмпирическая формула белковой молекулы – гемоглобина крови (С738Н1166О208N203S2Fe)4.
Белки входят в состав всех живых организмов и выполняют разнообразные биологические функции.
Первый белок, с которым мы знакомимся в своей жизни, это белок куриного яйца – альбумин, он хорошо растворяется в воде, при нагревании
свертывается, а при долгом хранении в тепле разрушается — яйцо протухает.
Волосы, ногти, когти, шерсть, перья, копыта, наружный слой кожи — все они почти целиком состоят из белка кератина. Кератин не растворяется в воде, не свертывается, не разрушается в земле: рога древних животных сохраняются в ней так же хорошо, как и кости.
Белок пепсин, содержащийся в желудочном соке, способен разрушать другие белки в процессе пищеварения.
Белок интерферон применяется при лечении насморка и гриппа, т.к. убивает вызывающие эти болезни вирусы.
А белок змеиного яда способен убить человека.
Осаждение белков (обратимое высаливание)
Белки способны осаждаться из растворов под действием таких веществ, как этиловый спирт, ацетон, соли Na + , К + , NH4 + и др.
Свойства белков при таком осаждении не меняются, поэтому при добавлении воды белки снова могут переходить в раствор.


Рубрики: Белки
Прежде чем рассказать о важнейших физических и химических свойствах белка, нужно знать из чего он состоит, какая у него структура. Белки - это важный природный биополимер, фундаментом для него служат аминокислоты.

Что такое аминокислоты
Это органические соединения, в состав которых входят карбоксильная и аминная группы. Благодаря первой группе у них есть углерод, кислород и водород, а другой - азот и водород. Самыми важными считаются альфа-аминокислоты, потому что они нужны для образования белков.
Существуют незаменимые аминокислоты, которые называются протеиногенные. Вот они и отвечают за появление белков. Их имеется всего 20, а белковых соединений они могут образовывать бесчисленное множество. При этом ни один из них не будет полностью идентичным другому. Это возможно благодаря комбинациям элементов, которые есть в этих аминокислотах.
Их синтез не происходит в организме. Поэтому туда они попадают вместе с продуктами питания. Если человек получает их в недостаточном количестве, то возможно нарушение нормального функционирования различных систем. Белки образуются благодаря реакции поликонденсации.

Белки и их структура
Прежде чем перейти к физическим свойствам белков, стоит дать более точное определение этому органическому соединению. Белки - это одни из наиболее значимых биоорганических соединений, которые образуются благодаря аминокислотам и принимают участие во многих процессах, происходящих в организме.
Структура этих соединений зависит от того, в каком порядке чередуются остатки аминокислот. В результате этого она бывает следующая:
- первичная (линейная);
- вторичная (спиралевидная);
- третичная (глобулярная).

Их классификация
Из-за огромного разнообразия белковых соединений и различной степени сложности их состава и разной структуры, для удобства существуют классификации, которые опираются на эти признаки.
По своему составу они бывают следующими:
- простые;
- сложные, которые подразделяются в свою очередь на:
- соединение белка и углеводов;
- соединение белков и жиров;
- соединение белковых молекул и нуклеиновых кислот.
Небольшая характеристика белковых соединений
Прежде чем перейти к физическим и химическим свойствам белков, будет полезно дать им небольшую характеристику. Конечно, их свойства имеют важное значение для нормального функционирования живого организма. По своему изначальному состоянию это твердые вещества, которые либо растворяются в различных жидкостях, либо нет.
Если говорить кратко о физических свойствах белков, то они обуславливают многие важнейшие биологические процессы в организме. Например, такие как транспортировка веществ, строительная функция и др. Физические свойства белков зависят от того, являются они растворимыми или нет. Вот как раз об этих особенностях и будет написано дальше.
Физические свойства белков
Выше уже написано об их агрегатном состоянии и растворимости. Поэтому переходим к следующим свойствам:
- У них имеется большая молекулярная масса, которая зависит от определенных условий среды.
- Их растворимость имеет большой диапазон, вследствие чего становится возможным электрофорез - метод, с помощью которого выделяются белки из смесей.
Химические свойства белковых соединений
- Денатурация. Свертывание белка под воздействием высоких температур, сильных кислот или щелочей. При денатурации сохраняется только первичная структура, а все биологические свойства белков теряются.
- Гидролиз. В результате его образуются простые белки и аминокислоты, потому что происходит разрушение первичной структуры. Он является основой процесса пищеварения.
- Качественные реакции на определение белка. Их всего две, а третья нужна для того, чтобы обнаружить серу в данных соединениях.
- Биуретовая реакция. На белки воздействуют осадком гидроксида меди. В итоге происходит окрашивание в фиолетовый цвет.
- Ксантопротеиновая реакция. Воздействие осуществляется при помощи концентрированной азотной кислоты. В результате этой реакции получается белый осадок, который при нагревании становится желтым. А если добавить водный аммиачный раствор, то появляется оранжевый цвет.
- Определение серы в белках. Когда происходит горение белков, то начинает ощущаться запах "жженого рога". Это явление объясняется тем, что в них содержится сера.

Итак, это были все физические и химические свойства белков. Но, конечно, не только из-за них они считаются важнейшими компонентами живого организма. Они обусловливают важнейшие биологические функции.
Биологические свойства белков
Нами были рассмотрены физические свойства белков в химии. Но стоит также обязательно рассказать о том, какое влияние они оказывают на организм и почему без них он не будет полноценно функционировать. Ниже перечислены функции белков:
- ферментативная. Большинство реакций в организме протекает с участием ферментов, которые имеют белковое происхождение;
- транспортная. Данные элементы осуществляют доставку других важных молекул в ткани и органы. Одним из самых значимых транспортных белков является гемоглобин;
- структурная. Белки являются главным строительным материалом для многих тканей (мышечной, покровной, опорной);
- защитная. Антитела и антитоксины представляют собой особый вид белковых соединений, которые составляют основу иммунитета;
- сигнальная. Рецепторы, которые отвечают за работу органов чувств, тоже имеют в своей структуре белки;
- запасающая. Данную функцию выполняют особые белки, которые могут быть строительным материалом и являться источниками дополнительной энергии во время развития новых организмов.
Белки способны превращаться в жиры и углеводы. А вот они не смогут стать белками. Поэтому недостаток именно этих соединений особенно опасен для живого организма. Выделяемая при усвоении белков энергия невелика и уступает в этом отношении жирам и углеводам. Однако именно они являются источником незаменимых аминокислот в организме.

Как понять, что в организме не хватает белка? У человека ухудшается самочувствие, наступает быстрая истощаемость и утомляемость. Прекрасными источниками белка являются различные сорта пшеницы, мясные и рыбные продукты, молочные, яйца и некоторые виды зернобобовых культур.
Важно знать не только физические свойства белков, но и химические, а также то, какое значение они имеют для организма с биологической точки зрения. Белковые соединения уникальны тем, что являются источниками незаменимых аминокислот, которые нужны для нормального функционирования человеческого организма.
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
локальное упорядочивание фрагмента полипептидной цепи в спирали
пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити)
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α -аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Читайте также:

