Физические свойства азота кратко
Обновлено: 05.07.2024
Азот — является элементом, расположенным в главной подгруппе V группы (или в 15 группе в современной форме периодической системы химических элементов Д.И. Менделеева) и во втором периоде.
Азот относят к пниктогенам, он представляет собой один из самых распространенных элементов на нашей планете.
В основном состоянии азот обладает следующей электронной конфигурацией:
Внешний энергетический уровень атома азота содержит 3 неспаренных электрона и одну электронную пару в основном энергетическом состоянии. Таким образом, атом азота имеет способность формировать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. В результате максимальное значение валентности азота в соединениях составляет IV, для азота также характерна валентность III. Степени окисления атома азота соответствуют интервалу от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Азот в природном мире можно обнаружить в виде простого вещества газа N 2 . Молекула N 2 неполярная. По этой причине в воде азот практически не растворяется. В молекуле азота атомы соединены тройной связью, в связи с тем, что каждый атом в молекуле обладает тремя неспаренными электронами. Одна из трех связей является σ -связью (сигма-связью), и две — π - связями.
Схема образования молекулы азота:
Структурно-графическая формула молекулы азота имеет вид: N ≡ N
Схема перекрывания электронных облаков при образовании молекулы азота:
Простое вещество N 2 — двухатомный газ, без цвета, вкуса и запаха. Вещество обладает химической инертностью, вступает в химические реакции с комплексными соединениями переходных металлов.
Азот N 2 является ключевым компонентом воздуха: составляет 78% от общего объема атмосферного воздуха. В промышленности азот получают путем разделения (фракционирования) воздуха, свыше ¾ от массы производимого в промышленности азота используют для получения аммиака. Простое вещество N 2 применяют в качестве инертной среды для реализации разнообразных технологических процессов. Жидкий азот играет роль хладагента.
Азот представляет собой один из ключевых биогенных элементов, который входит в компонентный состав белков и нуклеиновых кислот. В земной коре азот встречатеся преимущественно в виде нитратов — солей азотной кислоты.
Степени окисления азота в соединениях
В соединениях атомы азота способны проявлять самые разные степени окисления. Соответствующие характеристики элемента в соединениях представлены в таблице:
Химические и физические свойства азота
Физические свойства азота:
- молярная масса 14 , 00643 г / м о л ь ;
- в нормальных условиях газ, не имеет цвета и запаха;
- плотность в нормальных условиях составляет 1 , 2506 к г / м 3 ;
- температура плавления 63 , 29 K ( − 209 , 86 ° C ) ;
- температура кипения 77 , 4 K ( − 195 , 75 ° C ) ;
- удельная теплота плавления 0 , 720 к Д ж / м о л ь ;
- удельная теплота испарения 5 , 57 к Д ж / м о л ь ;
- молярная теплоемкость 29 , 125 Д ж / ( K · м о л ь ) ;
- молярный объем 17 , 3 с м 3 / м о л ь ;
- вещество плохо растворяется в воде (2,3 мл/100 г при 0 °C, 1,5 мл/100 г при 20 °C, 1,1 мл/100 г при 40 °C, 0,5 мл/100 г при 80 °C);
- в жидком состоянии вещество не обладает окраской, является подвижным, как вода;
- жидкий азот характеризуется плотностью 808 к г / м 3 , контактируя с воздухом, он поглощает кислород;
- переход азота в твердое агрегатное состояние происходит при −209,86 °C;
- твердое вещество представляет собой снегоподобную массу или крупные белоснежные кристаллы;
- твердый азот поглощает из воздуха кислород, что сопровождается плавлением вещества и образованием раствора кислорода в азоте.
В нормальных условиях азот является веществом с малой химической активностью.
Азот может выступать в качестве окислителя и реагировать с простыми веществами элементов с более низкой электроотрицательностью (в первую очередь, металлов). Азот проявляет свойства восстановителя в реакциях с простыми веществами элементов, обладающих более высокой электроотрицательностью (неметаллы). По этим причинам вещество вступает в реакцию с металлами и неметаллами.
В обычных условиях молекулярный азот и кислород не взаимодействуют. Реакция с кислородом возможна при высокой температуре в 2000°C, в условиях электрической дуги (в природе данный процесс протекает во время грозы). Данная реакция является эндотермической, то есть сопровождается поглощением тепла:
Сильный нагрев до температуры в 2000°C или действие электрического разряда приводят к взаимодействию азота с серой, фосфором, мышьяком, углеродом. Реакция сопровождается образованием бинарных соединений:
В процессе взаимодействия азота и водорода в условиях высокого давления и высокой температуры при наличии катализатора образуется аммиак. Данный процесс является экзотермическим, то есть сопровождается выделением теплоты:
Химическая реакция азота с активными металлами приводит к образованию бинарных соединений в виде нитридов. Процесс протекает в случае с литием при комнатной температуре, а с кальцием, натрием и магнием — при нагревании. Например, взаимодействие азота и лития, которое сопровождается образованием нитрида лития:
Со сложными веществами азот практически не вступает в химические реакции. Это объясняется очень низкой реакционной способностью вещества. Взаимодействие можно наблюдать лишь при жестких условиях с активными веществами, к примеру, сильными восстановителями.
Окисление азотом гидрида лития:
Круговорот азота в природе
Азот в природе состоит из двух стабильных изотопов:
Искусственным путем удалось получить четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Данные вещества представляют собой достаточно короткоживущие изотопы. Наиболее стабильным считают изотоп с периодом полураспада 10 мин:
Спин ядер стабильных изотопов азота:
Азот является одним из наиболее распространенных элементов на нашей планете. За пределами Земли простое вещество обнаружено в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, в межзвездном пространстве. Атмосферы таких планет-спутников как Титан, Тритон, а также карликовой планеты Плутон по большей части состоят из азота. Вещество является четвертым по распространенности элементом Солнечной системы, уступая место водороду, гелию и кислороду.
Азот в форме двухатомных молекул N 2 представляет собой основной компонент атмосферы нашей планеты, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объему), то есть около 3 , 87 ⋅ 10 1 5 тонн. Концентрация азота в коре Земли, по разным данным, составляет ( 0 , 7 — 1 , 5 ) ⋅ 10 1 5 тонн (в гумусе —около 6 ⋅ 10 1 0 тонн), а в мантии — 1 , 3 ⋅ 10 1 6 тонн. Данное соотношение масс позволяет выдвинуть теорию, что главным источником азота является верхняя часть мантии, откуда он поступает в другие оболочки планеты в процессе вулканического извержения. Масса азота, растворенного в гидросфере, примерно равна 2 ⋅ 10 1 3 тонн. В виде соединений азота в гидросфере содержится около 7 ⋅ 10 1 1 тонн.
Азот представляет собой химический элемент, который важен для жизни животных и растительных организмов. Вещество является компонентом:
- белков (16—18 % по массе);
- аминокислот;
- нуклеиновых кислот;
- нуклеопротеидов;
- хлорофилла;
- гемоглобина.
Химия гидридов азота в условиях давления около 800 ГПа (примерно 8 миллионов атмосфер) отличается большим разнообразием по сравнению с химией углеводородов при нормальных условиях. В связи с этим, была сформирована гипотеза о том, что азот может играть роль основы пока неоткрытой жизни на таких планетах, как Уран и Нептун.
Атмосферный азот фиксируются в природном мире по двум ключевым направлениям:
Первый путь состоит в большей степени во взаимодействии азота и кислорода. В связи с тем, что азот обладает высокой химической инертностью, чтобы запустить реакцию окисления необходимо большое количество энергии, то есть высокая температура. Данные условия создаются во время разрядов молний, когда температура достигает 2500 градусов и выше. В этом случае образуются разнообразные оксиды азота. Есть вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Превалирующая часть молекулярного азота (около 1 , 4 ⋅ 10 8 тонн/год) фиксируется биотическим путем. Длительное время в биологии существовало мнение, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов, которые широко распространены на поверхности нашей планеты:
- бактерии Azotobacter и Clostridium;
- клубеньковые бактерии бобовых растений Rhizobium;
- цианобактерии Anabaena, Nostoc.
В настоящее время ученые выяснили, что такую способность имеют многие другие организмы, обитающие в воде и почве, к примеру, актиномицеты в клубеньках ольхи и других деревьев (всего 160 видов). Данные организмы способны превращать молекулярный азот в соединения аммония ( ( N H 4 ) + ) . Рассматриваемый процесс протекает при существенных энергетических затратах. С целью фиксации 1 грамма атмосферного азота бактерии в клубеньках бобовых тратят около 167,5 кДж, то есть окисляют приблизительно 10 грамм глюкозы. Таким образом, можно наблюдать взаимную пользу от симбиоза растений и азотфиксирующих бактерий:
Азот в форме аммиака и соединений аммония, которые получают при биогенной азотфиксации, в достаточно короткое время окисляется до нитратов и нитритов. Данный процесс называют нитрификацией. Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов обладают хорошей растворимостью. Это объясняет их попадание в мировой океан в процессе смывания водой (этот поток оценивается в 2 , 5 — 8 ⋅ 10 7 тонн/год).
Азот в тканях растительных и животных организмов после того, как они погибают, проходит через аммонификацию, то есть разложение содержащих азот сложных соединений, что сопровождается выделением аммиака и ионов аммония, и денитрификацию, то есть выделение атомарного азота с его оксидами. Рассматриваемые явления происходят, благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
При отсутствии деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии в результате вулканического извержения, а часть прочно фиксируется в почвах и глинистых минералах. Так же регулярно происходит утечка азота из верхних слоев атмосферы в межпланетное пространство.
Способы получения азота и его применение
Существуют разные способы получения азота. К примеру, в лабораторных условиях вещество синтезируют в процессе химической реакции между растворами хлорида аммония и нитрита натрия. Продуктом реакции обмена является нитрит аммония, который достаточно просто разлагается, что приводит к образованию азота и воды. Колбу заполняют раствором хлорида аммония, а капельную воронку — раствором нитрита натрия. В процессе добавления нитрита натрия в колбу начинает выделяться азот, который собирают с помощью цилиндра. Затем можно посмотреть, сколько газа получено. Горящая лучинка в атмосфере азота гаснет, так проверяют наличие азота в сосуде.
Суммарное уравнение процесса можно записать в кратком виде:
Другим способом получения азота является горение аммиака:
Более чистое вещество можно получить при разложении азидов щелочных металлов. В качестве примера можно привести процесс разложения азида натрия:
Следующим лабораторным способом получения азота является восстановление оксида меди (II) аммиаком при температуре около 700 °C:
В промышленной сфере азот получают из воздуха. Эффективность промышленного производства зависит от наличия дешевого и доступного сырья определенного класса. Воздух в данном случае представлен в неограниченном количестве и является бесплатным. Азот из воздуха выделяют по нескольким технологиям:
- адсорбционная;
- мембранная;
- криогенная.
Адсорбционный метод синтеза азота заключается в разделении воздуха на компоненты с помощью связывания твердым веществом, называемым адсорбентом, отдельных компонентов газовой смеси. Принцип работы мембранных систем заключается в создании разницы скоростей проникновения компонентов газа через вещество мембраны. В качестве движущей силы разделения газов выступает разница парциальных давлений на различных сторонах мембраны. Криогенные установки функционируют по методу разделения газовых смесей за счет разности температур кипения компонентов воздуха и различии составов, которые находятся в равновесии жидких и паровых смесей.
Азот используют для выпуска минеральных удобрений, синтеза аммиака, получения инертной атмосферы в лампах, применяют в медицине. Жидкий азот обеспечивает глубокое охлаждение и вымораживание. Полученный с помощью азота аммиак применяют в производстве азотной кислоты, азотсодержащих солей, мочевины и соды, им заправляют холодильное оборудование. Жидкий аммиак и его растворы используют в качестве жидких удобрений, а также в сфере медицины.
С помощью оксида одновалентного азота N 2 O создают аэрозоли и анестезирующие средства при наркозах. Жидкий диоксид азота N О 2 играет роль неводного растворителя и окислителя в двигателях космических кораблей. Нитрит натрия нашел широкое применение в органическом синтезе. Данное вещество используют в качестве добавки к колбасным изделиям, которая придает им цвет натурального мяса. Азотная кислота необходима для производства минеральных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон. Концентрированную азотную кислоту используют в ракетной технике, как окислитель топлива для сгорания в двигателях.

В этой статье мы рассмотрим характеристики азота в химии, узнаем, какие степени окисления может иметь азот и поговорим о важнейших соединениях, в состав которых входит этот химический элемент.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s 2 2s 2 2p 3 , в сокращенном виде — [He]2s 2 2p 3 . На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.

Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.

Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
азот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2O
разложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.

Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:

Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
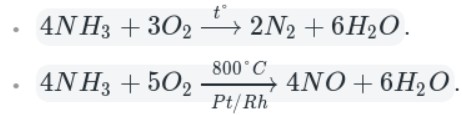
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
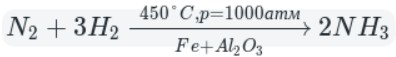
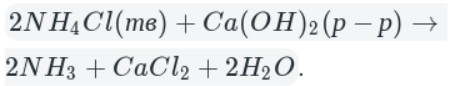
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.

Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O
Окисление оксида азота (II)
2NO + O2 = 2NO2
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:

Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:

Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:

Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.

Азот – химический элемент V группы периодической системы Менделеева, имеющий атомный номер 7 и атомную массу 14,00674. Какими же свойствами обладает этот элемент?
Физические свойства азота
Азот – двухатомный газ без запаха, цвета и вкуса. Температура кипения азота при атмосферном давлении составляет -195,8 градусов, температура плавления – -209,9 градусов. Растворимость в воде при 20 градусах весьма мала – 15,4 мл/л.
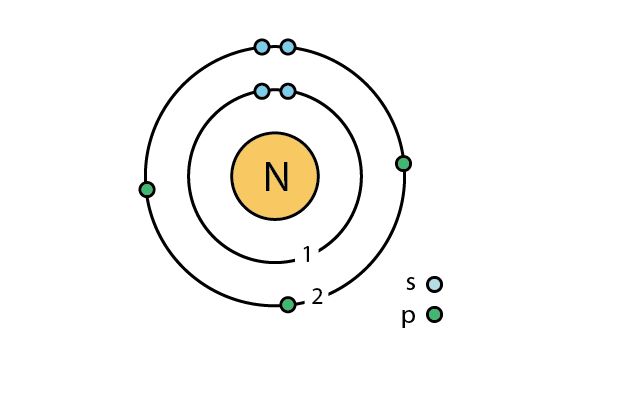
Рис. 1. Атом азота.
Атмосферный азот состоит из двух изотопов: 14N (99.64%) и 15N (0.36%). Известны также радиоактивные изотопы азота 13N и 16N.
Химические свойства азота
В молекуле азота химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x,y,z.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называются q-связью.
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры соединяющихся атомов, называются п-связью. В молекуле азота имеется одна q-связь и две п-связи.
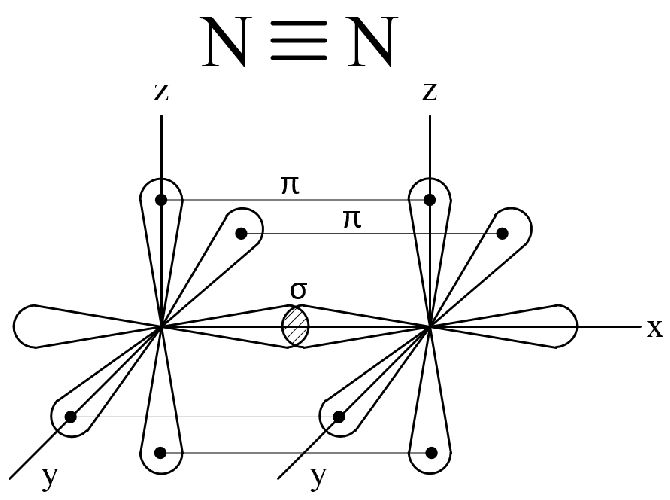
Рис. 2. Связи в молекуле азота.
Молекулярный азот – химически малоактивное вещество, это объясняется тройной связью между атомами азота и ее малой длиной
При нормальных условиях азот может реагировать только с литием:
При высоких температурах связи между атомами ослабляются и азот становится более реакционноспособным. При нагревании он может взаимодействовать с другими металлами, например с магнием, кальцием, алюминием с образованием нитридов:
Пропуская азот через раскаленный кокс, получают соединение азота с углеродом – дициан.
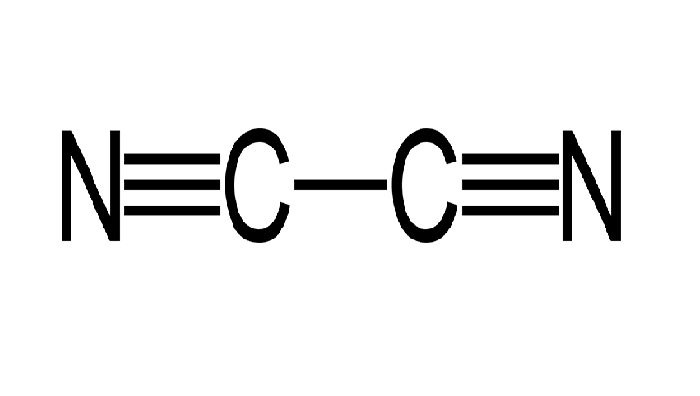
Рис. 3. Формула дициан.
С оксидом алюминия и углеродом азот при высокой температуре также образует нитрид алюминия:
а с содой и углем – цианид натрия:
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла:
При температуре электрической дуги (3000-4000 градусов) азот реагирует с кислородом:
При высокой температуре карбид кальция CaC2 поглощает азот с образования цианамида кальция:
Эту реакцию использовали в одном из первых методов промышленного связывания азота воздуха.
В присутствии катализатора при высокой температуре и давлении азот способен реагировать с водородом:
Что мы узнали?
Азот – химический элемент, способный проявлять валентность III и IV. Так же в статье рассмотрены физические и химические свойства азота, и дается характеристика этого элемента и реакции, в которые этот элемент способен вступать при нормальных условиях и под действием катализаторов.

Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л H2O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li 3 N. При нагревании (то есть активации молекул N 2 ) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
Особо чистый азот получают термическим разложением азида натрия:
2NaN 3 → 2Na + 3N 2 (при t o )
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
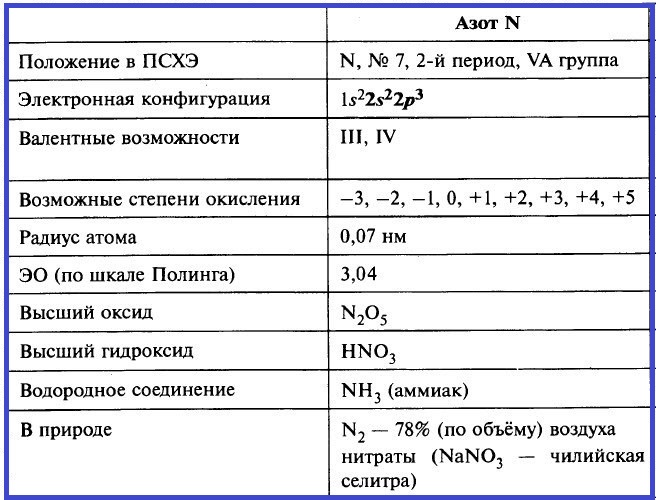
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.

Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА

Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА

В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N –3 ), а окислителем – азот в составе нитрит-иона (N +3 ).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.
Читайте также:

