Физические свойства алкадиенов кратко
Обновлено: 28.06.2024

Алкадиены, диены или диеновые углеводороды – класс линейный ненасыщенных углеводородов, содержащих в молекуле две двойные связи. Химические и физические свойства алкадиенов обусловлены наличием кратных связей и существенно отличаются от свойств предельных углеводородов.
Гомологи
Представители гомологического ряда:
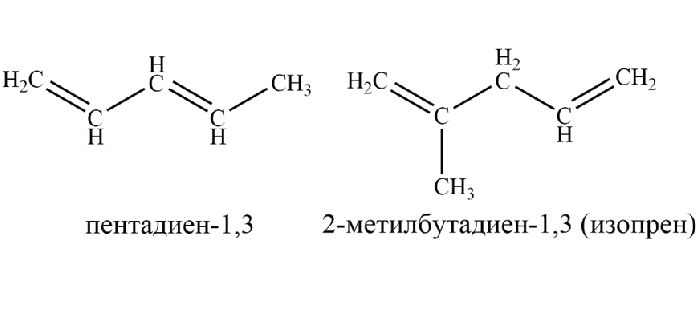
Рис. 1. Структурные формулы диенов.
Алкадиены получают из нефтепродуктов, галогеналканов, спиртов с помощью дегидрирования.
Диенам, начиная с пентадиена, свойственна изомерия:
Алкадиены классифицируют, исходя из структурной изомерии по положению кратных связей. В зависимости от расположения двойной связи в молекуле относительно друг друга выделяют три вида диенов:
- кумулированные – три соседних атома углерода связаны двойными связями (характерно для бутадиена и выше): СН2=С=СН-СН3 – бутадиен-1,2;
- сопряжённые – атомы углерода с двойными связями разделены одинарной связью: CH2=CH-CH=CH2 – бутадиен-1,3;
- изолированные – атомы углерода с двойными связями разделены несколькими одинарными связями (характерно для пентадиена и выше): CH2=CH-CH2-CH=CH2 – пентадиен-1,4.
Отсчёт атомов углерода в молекуле изомера начинается с разветвлённого края или с того края, к которому ближе всего расположены двойные связи. При зеркальном расположении разветвлений и двойных связей выбирается любой край для начала отсчёта. Положение заместителей указывается в начале названия, двойных связей – в конце.
Свойства
Общие физические свойства алкадиенов аналогичны алкенам:
Плотность, температуры плавления, кипения увеличиваются вместе с увеличением молекулярной массы. Структурные изомеры имеют более низкие температуры плавления и кипения в сравнении с линейными молекулами.
Благодаря двойным связям диены могут вступать в реакции присоединения. Радикалы присоединяются к местам разрыва связей. В зависимости от положения двойных связей образуются разные вещества при одинаковых реакциях.
В таблице описаны химические свойства алкадиенов.
Реакция
Описание
Уравнение
Реакция в присутствии никеля
При присоединении брома или хлора образуются тетрагалогеноалканы. В зависимости от положения двойных связей образуются 1,2- и 1,4-соединения. Их соотношение зависит от условий протекания реакции
Аналогично галогенированию. Реакция протекает спиртовой или водной среде в присутствии хлорида лития
Что мы узнали?
Диены или алкадиены – ненасыщенные углеводороды с двумя двойными связями. Гомологический ряд образует пропадиен. Начиная с пентадиена, гомологам свойственна структурная и пространственная изомерия. Структурная изомерия происходит по положению заместителя или по положению двойной связи. В зависимости от количества атомов углерода алкадиены могут быть газами (С3-С4), жидкостями (С5-С17), твёрдыми веществами (от С18). Диены участвуют в реакциях присоединения: гидрировании, галогенировании, гидрогалогенировании, полимеризации.
Алкадиены – непредельные углеводороды, в состав которых входят две двойные связи. Общая формула алкадиенов – CnH2n-2.
Если двойные связи находятся в углеродной цепи между двумя или боле атомов углерода, то такие связи называются изолированными. Химические свойства таких диенов не отличаются от алкенов, только в реакцию вступают 2 связи, а не одна.
Если же двойные связь разделены только одной σ - связью, то это – сопряженная связь:

Если же диен выглядит так: С=С=С, то такая связь является кумулированной, а диен называется – алленом.
Строение алкадиенов.
π-электронные облака двойных связей перекрываются между собой, образуя единое π-облако. В сопряженной системе электроны делокализованы по всем атомам углерода:

Чем длиннее молекула, тем она более устойчива.
Изомерия алкадиенов.
Для диенов характерна изомерия углеродного скелета, изомерия положения двойных связей и пространственная изомерия.
Физические свойства алкадиенов.
Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. А изопрен – жидкость.
Получение диенов.
1. Дегидрирование алканов:


2. Реакция Лебедева (одновременное дегидрирование и дегидратация):

Химические свойства алкадиенов.
Химические свойства алкадиенов обусловлены наличием двойных связей. Реакция присоединения может протекать в 2х направлениях: 1,4 и 1,2 – присоединение. Например,


Способность алкадиенов к полимеризации:

Для получения изопренового каучука используют реакцию при воздействии металлоорганических катализаторов:

Применение алкадиенов.
Основная сфера использования диенов и их производных – это производство каучука.
Химические и физические свойства алкадиенов, а также способы их получения аналогичны со свойствами алкенов. Однако для алкадиенов существует ряд отличительных свойств и способов получения.
Физические свойства алкадиенов
Низшие члены гомологического ряда представляют собой газообразные вещества с низкими температурами кипения и плавления. С увеличением молекулярной массы наблюдается тенденция к увеличению этих показателей и переход к жидкому состоянию. Алкадиены нерастворимы в воде, хорошо растворимы в большинстве органических растворителях (эфире, бензоле, спирте).

Химические свойства алкадиенов
Алкадиены вступают в химические реакции, характерные для алкенов (реакции присоединения, изормеризации, полимеризации, окисления).
Реакции присоединения
К алленам и алкадиенам с изолированными двойными связями присоединение молекул происходят по обеим двойным связям:

В алкадиенах с сопряженной двойной связью присоединение молекул происходит как по месту одной двойной связи (1,2-присоединение), так и к крайним атомам сопряженной системы (1,4-присоединение). При этом происходит перемещении двойной связи. В результате образуется смесь продуктов 1,2- и 1,4-присоединения:
- Диеновый синтез (реакция Дильса – Альдера). Сопряженные алкадиены присоединяют диенофилы (соединения с ненасыщенными С-С связями) по 1,4-положениям. В результате реакции образуются циклические соединения:

Следующая реакция является качественной на соединения, имеющие сопряженные двойные связи:

Реакции окисления
- Окисление раствором перманганата калия (KMnO4) является качественной реакцией на непредельные углеводороды. По обесцвечиванию малинового раствора KMnO4 судят о присутствии в исследуемом соединении кратных С-С связей:
- В нейтральной среде (водный раствор KMnO4):


- Озонолиз (окисление озоном) протекает с участием обеих двойных связей:

Реакции полимеризации алкадиенов
На основе реакций полимеризации получают синтетические каучуки. Натуральный каучук –это 1,4-цис-полиизопрен. Такой полимер можно получить, используя катализатор Циглера-Натта (Al(C2H5)3∙TiCl4).
Транс-изомер изопрена – это гуттаперча:


При сополимеризации 1,3-бутадиена со стиролом получают бутадиен-стирольный каучук, который широко применяется в производстве шин:
Бутадиен-нитрильный каучук получают путем сополимеризации 1,3-бутадиена и акрилонитрила :

Получение алкадиенов
Дегидрирование алканов протекает через стадию образования алкенов, которые при последующем отщеплении водорода превращаются в адкадиены.
- Дегидратация гликолей в присутствии фосфорной кислоты в качестве катализатора при температуре ~260–275 о С и давлении 7,0 МПа, последующая дегидратация при температуре 270–280 о С и давлении 0,1 МПа (катализатор — NaН2РО4, нанесенный на кокс или графит):

- Дегидрогалогенирование дигалогеналканов в присутствии водоотнимающего агента – серной кислоты:

Применение алкадиенов
Основное применение алкадиены нашли в производстве синтетических каучуков, основная часть которых используется для получения резины, материала бензопроводов и др. Подробно о видах каучуков и областях их применения читайте в разделе Каучук — виды, получение и применение.
Наибольшее практическое значение имеют углеводороды с сопряженными двойными связями: дивинил или бутадиен-1,3 и изопрен или 2-метилбутадиен-1,3. Их используют для производства синтетических каучуков.
Бутадиен-1,3 – легко сжижающийся газ с неприятным запахом. T°пл.= -108,9°C, T°кип.= -4,5°C. Растворяется в эфире, бензоле, не растворяется в воде.
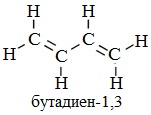
2-Метилбутадиен-1,3 – летучая жидкость. T°пл.= -146°C, T°кип.= 34,1°C. Растворяется в большинстве углеводородных растворителях, эфире, спирте, не растворяется в воде.
Читайте также:

