Ферменты катализ кратко химия
Обновлено: 05.07.2024
ускорение биохим. реакций при участии белковых макромолекул, называемых ферментами (энзимами). Ф.к. — разновидность катализа, хотя термин "ферментация" (брожение) известен с давних времен, когда еще не было понятия хим. катализа.
Первое исследование Ф. к. как хим. процесса было выполнено К. Кирхгофом, который в 1814 продемонстрировал фер-ментативную конверсию крахмала в растворимые углеводы.
Заметный вклад в представление о природе Ф. к. внесли работы И. Берцелиуса и Э. Мичерлиха, которые включили ферментативные реакции в категорию хим. каталитич. процессов. В кон. 19 в. Э. Фишер высказал гипотезу о специфичности ферментативных реакций и тесном стерич. соответствии между субстратом и активным центром фермента. Основы кинетики ферментативных реакций были заложены в работах Л. Михаэ-лиса (1913).
В 20 в. происходит интенсивное изучение хим. основ Ф. к., получение ферментов в кристаллич. состоянии, изучение структуры белковых молекул и их активных центров, исследование большого числа конкретных ферментативных реакций и ферментов.
В простейшем случае уравнение реакции с участием фермента имеет вид:
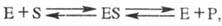
где E — фермент, S — субстрат, ES — фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт реакции.
Превращение субстрата в продукт происходит в комплексе Михаэлиса. Часто субстрат образует ковалентные связи с функциональными группами активного центра, в т. ч. и с группами кофермента (см. коферменты). Большое значение в механизмах ферментативных реакций имеет основной и кислотный катализ, реализуемый благодаря наличию имидазольных групп остатков гистидина и карбоксильных групп дикарбоновых аминокислот.
Важнейшие особенности Ф. к. — эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость хим. превращения субстрата по сравнению с неферментативной реакцией в 10 9 –10 12 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен (см. комплементарность) переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активац. барьер реакции.
Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или неск. близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т. ч. благодаря образованию изоферментов, которые катализируют идентичные реакции, но отличаются строением и каталитич. свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последоват. превращений вещества (см. регуляторы ферментов).
Ферментативные реакции чувствительны к внеш. условиям, в частности к ионной силе раствора и pH среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для хим. реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Максимум кривой соответствует оптимальной температуре Tопт, значение которой для большинства ферментов лежит в пределах 40–50 °C. Для некоторых ферментов, особенно ферментов термофильных микроорганизмов, Tопт 80–90 °C. Подробнее о кинетике ферментативных реакций см. ферментативных реакций кинетика.
Осн. направления совр. исследований Ф.к. — выяснение механизма, обусловливающего высокие скорости процессов, высокую селективность (специфичность действия ферментов), изучение механизмов контроля и регуляции активности ферментов. Оказалось, в частности, что реакции Ф. к. включают большое число стадий с участием лабильных промежут. соед., времена жизни которых изменяются в нано- и миллисекундном диапазонах. На активных центрах ферментов протекают быстрые (нелимитирующие) стадии, в результате чего понижается энергетич. барьер для наиб. трудной, лимитирующей стадии.
Установлен механизм регулирования ферментативной активности путем действия ингибитора (или активатора) на специфичный центр белковой молекулы с опосредованной передачей воздействия на активный центр фермента через белок. Обнаружены эффекты кооперативного взаимод. неск. молекул субстрата на белковой матрице. Найден способ "жесткого" выведения фермента из процесса посредством индуцированной субстратом необратимой инактивации.
Ф. к. — основа мн. современных хим. технологий, в частности крупномасштабных процессов получения глюкозы и фруктозы, антибиотиков, аминокислот, витаминов и регуляторов, а также тонкого орг. синтеза. Разработаны методы, позволяющие проводить ферментативные реакции в органических растворителях, обращенных мицеллах (см. мицеллообразование). С Ф.к. связаны перспективы развития иммуноферментного и биолюминесцентного анализа, применения биосенсоров. Созданы методы, позволившие придать каталитич. активность антителам, обнаружена каталитич. активность у рибонуклеи-новой кислоты (абзимы, рибозимы соотв.).
Лит.: Б е ρ е з и н И. В., Исследования в области ферментативного катализа и инженерной этимологии, М., 1990. См. также лит. к ст. Биотехнология^ Генетическая инженерия, Ферментативных реакций кинетика, Ферменты.
Катализ – это реакция, ускоренная с помощью специального соединения – катализатора. Он применяется во многих природных и промышленных реакциях.
В 1835 г. шведский ученый Йёнс Якоб Берцелиус предположил, что некоторые вещества могут влиять на скорость реакций. Их он назвал катализаторами. Химик считал, что они могут уменьшать прочность связей и ускорять реакции.
Что такое катализ?

Каждому катализатору свойственна избирательность, т. е. способность влиять не на все реакции. Эта особенность позволяет использовать катализ в практических целях.
По данным современных исследований катализатор формирует комплекс с реагентами, который укрепляется с помощью химических связей. Позже он распадается на продукт и катализатор.
Некоторые вещества в нормальных условиях не реагируют между собой. Например, молекулы водорода и оксида углерода не вступают во взаимодействие, т. к. атомы водорода прочно сцепляются друг с другом. Катализатор помогает молекулам-реагентам сблизиться и сформировать новые химические связи. Затем комплекс, содержащий катализатор, перегруппировывается.
Катализатором, или ферментом (в случае биохимической реакции), называется вещество, помогающее протеканию химической реакции, но не изменяющееся в ходе нее.
Скорость протекания химической реакции можно значительно увеличить, если добавить вещество, которое участвует в этой реакции, но при этом само не расходуется. Чтобы лучше это понять, представим себе работу брокера по операциям с недвижимостью. Брокер находит и собирает вместе людей, желающих продать какое-либо имущество, и людей, желающих его купить, таким образом способствуя его продаже и передаче другому владельцу. При этом сам брокер в ходе сделки ничего реально не покупает и не продает. Так же и катализатор, или фермент, способствует протеканию реакции между двумя веществами, но к концу реакции остается в первоначальном виде.
Подалуй, самый известный катализатор находится у нас в машине, в каталитическом нейтрализаторе отработавших газов. Он представляет собой мелкоячеистую металлическую сетку, сделанную из палладия и платины, через которую пропускаются выхлопы из автомобильного двигателя. Эти металлы катализируют ряд химических взаимодействий. Во-первых, они абсорбируют окись углерода (CO), окись азота (NO) и кислород, причем каждая молекула NO распадается на составляющие ее атомы. CO соединяется с атомом кислорода, образуя диоксид углерода, а атомы азота соединяются, и получаются молекулы азота. В то же время избыток кислорода дает возможность углеводородам, не до конца сгоревшим в автомобильных цилиндрах, полностью окислиться до диоксида углерода и воды. Вот так выхлопные газы, которые содержат окись углерода (смертельный яд) и вещества, приводящие к кислотным дождям, а также несгоревшие фрагменты исходных молекул бензина, превращаются в относительно безвредную смесь диоксида углерода, азота и воды.
Чтобы понять действие ферментов, необходимо знать, что для взаимодействия сложных органических молекул недостаточно их простого контакта. Чтобы реакция протекала, определенные атомы в сближающихся молекулах должны быть правильно сориентированы друг относительно друга (так же как ключ определенным образом должен быть вставлен в замок), только тогда смогут образоваться химические связи. То есть для химических процессов, протекающих в биологических системах (см. Биологические молекулы), чрезвычайно важную роль играет пространственная геометрия.
В биохимии крайне мала вероятность того, что две сложные молекулы, предоставленные сами себе, случайно окажутся друг относительно друга в правильной ориентации, необходимой для взаимодействия. Чтобы такая реакция протекала с ощутимой скоростью, нужна помощь молекул определенного типа — ферментов. Фермент притягивает к себе две другие молекулы и удерживает их в правильном положении, чтобы взаимодействие состоялось. Как только реакция произошла, фермент освобождается и повторяет те же действия с другим набором молекул. Все ферменты в биологических системах представляют собой белки, которые могут принимать разнообразные сложные формы. Как и все белки, они закодированы в ДНК и в качестве ферментов управляют скоростью протекания химических реакций.
Флогистон 02.12.2005 08:21 Ответить
Если это сайт для ученых, а не для школьников, то и определения должны
быть не списаны из школьных учебников!
Например, первая строчка "Катализатором, или ферментом (в случае биохимической реакции), называется вещество, помогающее протеканию химической реакции, но не изменяющееся в ходе нее."
Но почему же не так: "Катализатором называется вещество, способствующее увеличению скорости химической реакции путем снижения энергии активационного барьера, и тем самым обеспечивающее более быстрое достижение состояния термодинамического равновесия. Как правило, катализатор не претерпевает химических превращений в ходе химической реакции. Ферменты или биокатализаторы - это вещества белковой природы, катализирующие биохимические реакции. В отличи от небелковых катализаторов ферменты (энзимы) крайне реакционно-специфические катализаторы, т.е. фермент способен катализировать лишь очень небольшое число реакций, часто только одну.
algen Флогистон 02.12.2005 11:23 Ответить
Но все же не стоит путать научность с наукообразием. Вовсе не в том цель, чтобы каждое объяснение было фундаментальным. Обычно гораздо важнее, чтобы оно было понятным.
Флогистон algen 02.12.2005 12:14 Ответить
Спасибо за информацию! Полезу в соответствующий раздел.
Но по поводу "Обычно гораздо важнее, чтобы оно было понятным" позвольте не согласиться - гораздо важнее, что бы объяснение было правильным и не грешило двусмысленностью.
algen Флогистон 02.12.2005 13:01 Ответить
Какова ценность точного объяснения, если оно осталось непонятым? Человеческое понимание устроено так, что сразу воспринять предельно точные формулировки трудно. Поэтому сначала обычно дается некая неточная, но наводящая на правильные представления мысль. Потом, по мере того, как у человека накапливается опыт, а практика показывает недостаточность упрощенного объяснения, появляется нужда в уточнении. Главное, что читатель в этот момент готов к восприятию более точного понятия, он правильно поймет и оценит все тонкости формулировки. А если дать такое объяснение раньше времени, то возникнет ощущение сумбура и человек ничего не поймет и не запомнит.
Флогистон algen 02.12.2005 13:41 Ответить
Я преподаватель ВУЗа с немалым стажем, точная формулировка с последующим объяснением - это лучшее, что может дать учитель ученику. А Ваш подход - он повсеместно реализован в наших школах. И детишек потом приходится переучивать, предлагая забыть "..некая неточная, но наводящая на правильные представления мысль..", поскольку неподготовленый человек никогда не будет заниматься обдумыванием и додумыванием самостоятельно, и запоминать сразу точное и, главное, правильное определение. В итоге имеет место колоссальный разрыв между школой и ВУЗом, из-за которого вчерашние отличники превращаются в неуспевающих студентов. Специфика любого научного знания - это чистая, незамутненная мысль, и к этому нужно готовить сразу, а не потом.
И с чего это Вы взяли, что "Человеческое понимание устроено так, что сразу воспринять предельно точные формулировки трудно"? То что есть естественники и гуманитарии - это давно известно, но Ваш сайт не на школьников-гуманитариев ориентирован я надеюсь :)
alexsmail Флогистон 16.09.2006 18:51 Ответить
Как выпускник гимназии с углубленным изучением математики, физики и английского, а также как выпускнив ВУЗа (за рубежом) по математике и компьютерным наукам позвольте с вами не согласиться. Когда слышишь первый раз определение хочется услышать именно "..некая неточная, но наводящая на правильные представления мысль..". Затем можно привести несколько примеров, показывающие недостатки данного определния и дать правильное, точно определение. С лекции студент должен уйти именно с неточным определением и чётким предствалением, какие у него есть изъяны. Затем, дома или перед сессией, студент выучит точное определение.
В школе же нужно говорить правильные вещи. Например, говорить, что "квадратное уравнение с отрицательной дискриминантой не имеет решения" не верно. Нужно говорить "квадратное уравнение с отрицательной дискриминантой не имеет решения в действительных числах". И не важно, что дать вразумительный ответ школьнику, почему эта оговорка важна, сложно, я бы сказал не возможно, ведь он других чисел не знает, поэтому даже дача абсолютно точного определения действительного числа не поможет. Если этого не делать, то школьник, столкнувший с комплексными, числами испытает шок, он будет считать, что его обманывали.
В ферментативной реакции можно выделить следующие этапы:

1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S).
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий.
3. Превращение переходного комплекса в комплекс фермент-продукт (E-P).
4. Отделение конечных продуктов от фермента.
Механизмы катализа
1. Кислотно-основной катализ – в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций.
2. Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Типы ферментативных реакций
1. Тип "пинг-понг" – фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование.
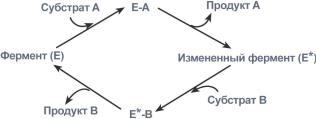
Ферментативная реакция по типу "пинг-понг"
2. Тип последовательных реакций – к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.
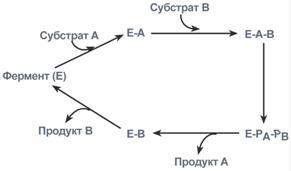
Ферментативная реакция по типу "последовательных реакций"
3. Тип случайных взаимодействий – субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются.
Читайте также:

