Ферментативный характер реакций обмена веществ кратко
Обновлено: 02.07.2024
Метаболизм является основой всей жизнедеятельности организмов, а обмен веществ неотделим от катализа ферментов. Ферменты — это каталитически активные организмы, продуцируемые живыми клетками. По сути, подавляющее большинство ферментов — это белки, некоторые — РНК, то есть рибонуклеиновая кислота, носитель генетической информации.
Белки с ферментативной активностью подразделяются на простые белки и связывающие белки. Простые белковые ферменты состоят из аминокислот и не содержат других веществ (таких как пепсин). Белковые ферменты состоят из простых белков и кофакторов, таких как лактатдегидрогеназа, трансаминаза и так далее. Простая белковая часть, из которой состоит фермент, называется ферментным белком или основным ферментом, а простетическая часть называется коферментами. Связывающий фермент обычно представляет собой комбинацию первичного фермента и кофермента и становится целым ферментом, который функционирует как фермент.
Роль ферментов в организме
В организме содержится множество ферментов, которые контролируют многие метаболические процессы: метаболизм, питание и преобразование биоэнергии. Большинство реакций, тесно связанных с жизненными процессами, являются реакциями, катализируемыми ферментами.
Роль ферментов в катализе
Самая важная роль фермента — катализ. Он позволяет упорядоченно осуществлять сложный метаболизм веществ в клетках, адаптируя метаболизм веществ к нормальным физиологическим функциям. Если дефицит или активность фермента ослаблены из-за генетических дефектов или по другим причинам, каталитическая реакция фермента может быть ненормальной, что приведет к нарушению метаболизма вещества или даже к заболеванию.
Каталитический механизм фермента в основном включает кислотно-основной катализ и ковалентный катализ. Кислотно-основной катализ относится к каталитическому действию переноса протона для ускорения реакции. Ковалентный катализ означает, что субстрат или часть субстрата образует ковалентную связь с катализатором и затем переносится на второй субстрат. Многие реакции переноса группы, катализируемые ферментами, осуществляются путем ковалентного катализа.
В организме человека имеется большое количество ферментов, которые сложны по структуре и разнообразны. Например, когда люди жуют рис и приготовленные на пару булочки, то чем дольше они жуют, тем слаще вкус. Это обьясняется следующим образом: крахмал в рисе гидролизуется до мальтозы под действием амилазы слюны, секретируемой ротовой полостью.
Следовательно, люди, которые больше жуют во время еды, могут хорошо смешивать пищу и слюну, что полезно для пищеварения. Кроме того, белок, который человеческое тело принимает из пищи, должен быть гидролизован до аминокислот с помощью различных протеолитических ферментов в пищевой промышленности, таких как пепсин, а затем конкретные аминокислоты выбираются другими ферментами для восстановления необходимых белков в определенном порядке. Здесь происходит множество сложных химических реакций.
Как ферменты снижают энергию активации реакции?
Каталитический механизм фермента заключается в снижении энергии активации реакции. Химическая реакция может быть проведена, потому что часть молекул субстрата была активирована, чтобы стать активированными молекулами, и чем больше активированных молекул, тем выше скорость реакции. Комплекс фермент-субстрат реагирует с образованием продукта, высвобождая фермент, который связывается с другой молекулой субстрата и увеличивает скорость химической реакции за счет уменьшения активации реакции.
Ферменты могут ускорить химическую реакцию, но не могут изменить точку равновесия химической реакции. Это означает, что фермент способствует прямой реакции и обратной реакции в той же пропорции, поэтому роль фермента заключается в сокращении времени, необходимого для достижения равновесия.
ЕГЭ 1. Метаболизм — совокупность химических реакций в клетке: расщепления (энергетический обмен) и синтеза (пластический обмен). Зависимость жизни клетки от непрерывного поступления веществ из внешней среды в клетку и выделения продуктов обмена из клетки во внешнюю среду. Обмен веществ — основной признак жизни.
2. Функции клеточного обмена веществ: 1) обеспечение клетки строительным материалом, необходимым для образования клеточных структур; 2) снабжение клетки энергией, которая используется на процессы жизнедеятельности (синтез веществ, их транспорт и др.).
3. Энергетический обмен — окисление органических веществ (углеводов, жиров, белков) и синтез богатых энергией молекул АТФ за счет освобождаемой энергии.
4. Пластический обмен — синтез молекул белков из аминокислот, полисахаридов из моносахаридов, жиров из глицерина и жирных кислот, нуклеиновых кислот из нуклеотидов, использование на эти реакции энергии, освобождаемой в процессе энергетического обмена.
5. Ферментативный характер реакций обмена. Ферменты — биологические катализаторы, ускоряющие реакции обмена в клетке. Ферменты — в основном белки, у некоторых из них есть небелковая часть (например, витамины). Молекулы ферментов значительно превышают размеры молекул вещества, на которые они действуют. Активный центр фермента, его соответствие структуре молекулы вещества, на которое он действует.
6. Разнообразие ферментов, их локализация в определенном порядке на мембранах клетки и в цитоплазме. Подобная локализация обеспечивает последовательность реакций.
7. Высокая активность и специфичность действия ферментов: ускорение в сотни и тысячи раз каждым ферментом одной или группы сходных реакций. Условия действия ферментов: определенная температура, реакция среды (рН), концентрация солей. Изменение условий среды, например рН, — причина нарушения структуры фермента, снижения его активности, прекращения действия.
Рената Арменаковна Петросова
Обмен веществ и энергии
в клетках организма
Предлагаемое пособие представляет собой достаточно подробное и полное изложение одной из наиболее сложных тем курса общей биологии — обмена веществ на клеточном уровне. Пособие написано в соответствии с программой углубленного курса общей биологии и программой для поступающих в вузы. Оно адресовано учащимся 10–11 классов, изучающим общую биологию, абитуриентам, поступающим на факультеты биологического и медицинского профиля, а также школьным учителям биологии.
Книга будет полезна тем учащимся, которые хотели бы разобраться в биохимических процессах, протекающих в клетке. Она не подменяет учебник, а дополняет его и систематизирует имеющиеся знания. С его помощью вы разберетесь в том, что осталось неясным после изучения темы по учебнику или объяснения учителя. В нем полно и в доступной форме описаны и объяснены сложные процессы обмена веществ, протекающие на клеточном уровне у автотрофных и гетеротрофных организмов. Это фотосинтез, энергетический обмен, реакции матричного синтеза (репликация ДНК, биосинтез РНК и белка). Понимание именно этих вопросов вызывает наибольшие трудности у старшеклассников. Поэтому параллельно с описанием каждого процесса предлагаются схемы и рисунки, которые значительно облегчают процесс усвоения сложного материала.
После каждой темы даны вопросы для самопроверки и задания различного уровня сложности. Любой ученик, ознакомившись с приведенным в пособии теоретическим материалом и ответив на предлагаемые вопросы, может считать, что он вполне освоил данную тему.
Пособие понадобится тем учащимся, которые хотели бы хорошо подготовиться к выпускным и вступительным экзаменам по биологии, единому государственному экзамену. Старшеклассники и абитуриенты смогут воспользоваться этим пособием для повышения уровня подготовки и систематизации учебного материала. Предлагаемые схемы легко запоминаются и позволяют уточнить и систематизировать сложный материал. Работа с пособием поможет приобрести прочные знания по наиболее сложным вопросам курса общей биологии.
Пособие интересно и учителям биологии, работающим в общеобразовательной и профильной биологической школе. Оно поможет восстановить в памяти сложные процессы обмена веществ, подготовиться к урокам. Приведенные в пособии вопросы и задания могут использоваться для контроля знаний учащихся.
Желаем всем успешной работы с предлагаемым учебным пособием и надеемся, что книга окажет помощь в овладении биологическими знаниями.
1. Обмен веществ и превращение энергии как основное свойство живого
Понятие об обмене веществ и превращении энергии
Одним из характерных признаков живого является обмен веществ и превращение энергии. Обмен веществ, или метаболизм (от греч. metabol — превращение), — это совокупность всех реакций синтеза и распада, протекающих в живых системах, связанная с выделением или поглощением энергии. Для существования организмов необходимы питательные вещества и энергия, которые они получают из внешней среды. В процессе питания и дыхания в организм поступают определенные вещества, которые в результате жизнедеятельности преобразуются, частично накапливаются, а частично выделяются в окружающую среду. Энергия и питательные вещества необходимы для осуществления всех процессов жизнедеятельности организма: роста, развития, движения, размножения и т. д. Основой этих процессов является обмен веществ и превращение энергии.
Живая система, которой является любой организм, находится в сложных взаимоотношениях с окружающей средой. Из окружающей среды он получает пищу, воду, кислород, свет, тепло. Из поступающих веществ и энергии организмы строят свое тело, образуя массу живого вещества планеты. В результате своей жизнедеятельности организмы сами воздействуют на окружающую среду и изменяют ее. Основой взаимосвязи живых систем и среды является обмен веществ и превращение энергии.
Для неживой природы также характерен обмен веществ. Например, при разрушении и выветривании горной породы происходит обмен веществ. Под действием воды, углекислого газа и других веществ крупные сложные породы разрушаются и превращаются в песок и глину. Химические вещества окисляются, например железо ржавеет. При их горении образуются газообразные продукты и вода, которые выделяются в атмосферу.
Основное отличие между обменом веществ в неживой и живой природе заключается в том, что обмен веществ в неживой природе приводит к уничтожению, разрушению вещества, породы. Живые же организмы, благодаря метаболизму, создают новые вещества, живут и воспроизводят себе подобных.
Обмен веществ и энергии состоит из двух взаимосвязанных и противоположных процессов — ассимиляции и диссимиляции. Ассимиляция, анаболизм, или пластический обмен, — это совокупность реакций синтеза высокомолекулярных органических веществ, сопровождающихся поглощением энергии за счет распада молекул АТФ. Диссимиляция, катаболизм, или энергетический обмен, — это совокупность реакций распада и окисления органических веществ, сопровождающихся выделением энергии и запасанием ее в синтезируемых молекулах АТФ. Эти процессы характерны для живых систем почти всех уровней организации, начиная от клетки и заканчивая биосферой (рис. 1).

Рис. 1. Общая схема обмена веществ и превращения энергии
Ассимиляция и диссимиляция — противоположные и взаимосвязанные процессы, составляющие единство обмена веществ. В живой природе это замкнутый процесс, так как химические элементы, из которых синтезируются органические вещества, переходят от одного организма к другому или выделяются в окружающую среду и вновь поступают в организмы. Происходит круговорот веществ и химических элементов.
Значение АТФ в обмене веществ
В отличие от круговорота веществ, круговорота энергии в живых системах не происходит. Организмам для жизнедеятельности постоянно необходима энергия. Единственным ее источником на Земле является солнце. Солнечная энергия аккумулируется растениями в процессе фотосинтеза, в результате чего она превращается в энергию химических связей молекул органических веществ.
Все остальные организмы используют готовые органические вещества. В процессе жизнедеятельности они расщепляют эти вещества, и энергия высвобождается. Она частично преобразуется, накапливается и в дальнейшем используется вновь в процессе пластического обмена на синтез органических веществ, специфичных для каждого организма. При этом клетка или организм постоянно теряет часть энергии, которая выделяется в виде тепла. Поэтому для существования жизни на Земле необходим постоянный приток энергии.
Одним из ключевых веществ, которое способно преобразовывать энергию солнечного света в энергию химических связей органических веществ, а далее вновь накапливать и передавать для синтеза новых веществ, является АТФ (рис. 2). В двух макроэргических связях ее молекул накапливается в 2,5 раза больше энергии, чем в обычных связях. Клетка использует эту запасенную энергию на различные процессы: биосинтез собственных органических веществ, движение, деление, передачу нервных импульсов и т. д. АТФ — основное вещество, которое обеспечивает функционирование клетки, запасает энергию в процессе энергетического обмена и выделяет в процессе пластического обмена. Ее синтез происходит на кристах митохондрий. Молекулы этого вещества легко и быстро способны доставлять энергию в любую часть клетки. АТФ является ключевым веществом обменных процессов и универсальным источником энергии в клетках, тканях и организмах.
ФЕРМЕНТЫ, органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. Вещества, оказывающие подобное действие, существуют и в неживой природе и называются катализаторами. Ферменты (от лат. fermentum – брожение, закваска) иногда называют энзимами (от греч. en – внутри, zyme – закваска). Все живые клетки содержат очень большой набор ферментов, от каталитической активности которых зависит функционирование клеток. Практически каждая из множества разнообразных реакций, протекающих в клетке, требует участия специфического фермента. Изучением химических свойств ферментов и катализируемых ими реакций занимается особая, очень важная область биохимии – энзимология.
Многие ферменты находятся в клетке в свободном состоянии, будучи просто растворены в цитоплазме; другие связаны со сложными высокоорганизованными структурами. Есть и ферменты, в норме находящиеся вне клетки; так, ферменты, катализирующие расщепление крахмала и белков, секретируются поджелудочной железой в кишечник. Секретируют ферменты и многие микроорганизмы.
Первые данные о ферментах были получены при изучении процессов брожения и пищеварения. Большой вклад в исследование брожения внес Л.Пастер, однако он полагал, что соответствующие реакции могут осуществлять только живые клетки. В начале 20 в. Э.Бухнер показал, что сбраживание сахарозы с образованием диоксида углерода и этилового спирта может катализироваться бесклеточным дрожжевым экстрактом. Это важное открытие послужило стимулом к выделению и изучению клеточных ферментов. В 1926 Дж.Самнер из Корнеллского университета (США) выделил уреазу; это был первый фермент, полученный в практически чистом виде. С тех пор обнаружено и выделено более 700 ферментов, но в живых организмах их существует гораздо больше. Идентификация, выделение и изучение свойств отдельных ферментов занимают центральное место в современной энзимологии.
Ферменты как белки.
Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть).
Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д.
Коферменты и субстраты.
Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами). Роль коферментов играют большинство витаминов и многие минеральные вещества; именно поэтому они должны поступать в организм с пищей. Витамины РР (никотиновая кислота, или ниацин) и рибофлавин, например, входят в состав коферментов, необходимых для функционирования дегидрогеназ. Цинк – кофермент карбоангидразы, фермента, катализирующего высвобождение из крови диоксида углерода, который удаляется из организма вместе с выдыхаемым воздухом. Железо и медь служат компонентами дыхательного фермента цитохромоксидазы.
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента. Этот процесс представляют следующим образом:
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Механизм действия ферментов.
Скорость ферментативной реакции зависит от концентрации субстрата [S] и количества присутствующего фермента. Эти величины определяют, сколько молекул фермента соединится с субстратом, и именно от содержания фермент-субстратного комплекса зависит скорость реакции, катализируемой данным ферментом. В большинстве ситуаций, представляющих интерес для биохимиков, концентрация фермента очень мала, а субстрат присутствует в избытке. Кроме того, биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса уравновешивается его превращением в продукт. В этих условиях зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
где KM – константа Михаэлиса, характеризующая активность фермента, V – максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [S] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [S] – наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
Ферментативные реакции и энергия.
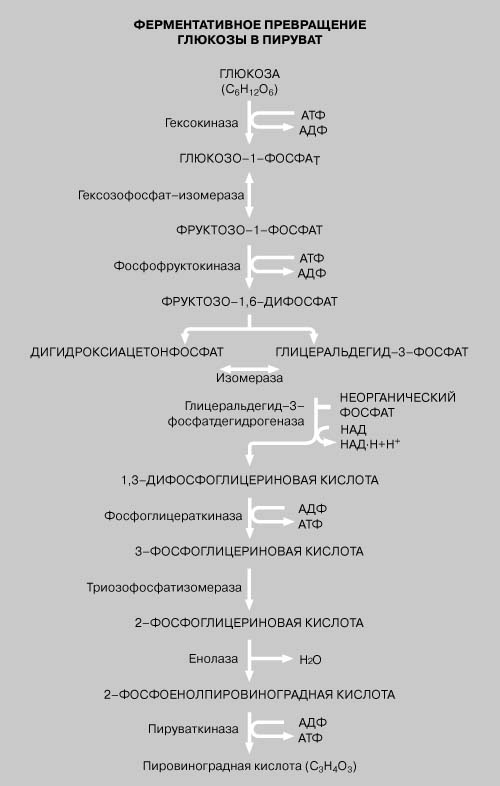
Высвобождение энергии при метаболизме питательных веществ, например при окислении шестиуглеродного сахара глюкозы с образованием диоксида углерода и воды, происходит в результате последовательных согласованных ферментативных реакций. В животных клетках в превращениях глюкозы в пировиноградную кислоту (пируват) или молочную кислоту (лактат) участвуют 10 разных ферментов. Этот процесс называется гликолизом. Первая реакция – фосфорилирование глюкозы – требует участия АТФ. На превращение каждой молекулы глюкозы в две молекулы пировиноградной кислоты расходуются две молекулы АТФ, но при этом на промежуточных этапах из аденозиндифосфата (АДФ) образуются 4 молекулы АТФ, так что весь процесс в целом дает 2 молекулы АТФ.
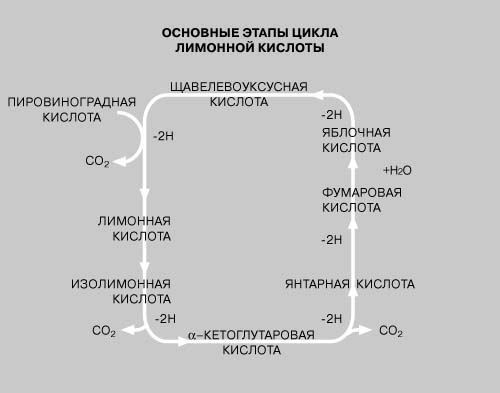
Далее пировиноградная кислота окисляется до диоксида углерода и воды при участии ферментов, ассоциированных с митохондриями. Эти превращения образуют цикл, называемый циклом трикарбоновых кислот, или циклом лимонной кислоты. См. также МЕТАБОЛИЗМ.
Окисление одного вещества всегда сопряжено с восстановлением другого: первое отдает атом водорода, а второе его присоединяет. Катализируют эти процессы дегидрогеназы, обеспечивающие перенос атомов водорода от субстратов к коферментам. В цикле трикарбоновых кислот одни специфические дегидрогеназы окисляют субстраты с образованием восстановленной формы кофермента (никотинамиддинуклеотида, обозначаемого НАД), а другие окисляют восстановленный кофермент (НАДЧН), восстанавливая другие дыхательные ферменты, в том числе цитохромы (железосодержащие гемопротеины), в которых атом железа попеременно то окисляется, то восстанавливается. В конечном итоге восстановленная форма цитохромоксидазы, одного из ключевых железосодержащих ферментов, окисляется кислородом, попадающим в наш организм с вдыхаемым воздухом. Когда происходит горение сахара (окисление кислородом воздуха), входящие в его состав атомы углерода непосредственно взаимодействуют с кислородом, образуя диоксид углерода. В отличие от горения, при окислении сахара в организме кислород окисляет собственно железо цитохромоксидазы, но в конечном итоге его окислительный потенциал используется для полного окисления сахаров в ходе многоступенчатого процесса, опосредуемого ферментами.
На отдельных этапах окисления энергия, заключенная в питательных веществах, высвобождается в основном маленькими порциями и может запасаться в фосфатных связях АТФ. В этом принимают участие замечательные ферменты, которые сопрягают окислительные реакции (дающие энергию) с реакциями образования АТФ (запасающими энергию). Этот процесс сопряжения известен как окислительное фосфорилирование. Не будь сопряженных ферментативных реакций, жизнь в известных нам формах была бы невозможна.
Ферменты выполняют и множество других функций. Они катализируют разнообразные реакции синтеза, включая образование тканевых белков, жиров и углеводов. Для синтеза всего огромного множества химических соединений, обнаруженных в сложных организмах, используются целые ферментные системы. Для этого нужна энергия, и во всех случаях ее источником служат фосфорилированные соединения, такие, как АТФ.
Ферменты и пищеварение.
Ферменты – необходимые участники процесса пищеварения. Только низкомолекулярные соединения могут проходить через стенку кишечника и попадать в кровоток, поэтому компоненты пищи должны быть предварительно расщеплены до небольших молекул. Это происходит в ходе ферментативного гидролиза (расщепления) белков до аминокислот, крахмала до сахаров, жиров до жирных кислот и глицерина. Гидролиз белков катализирует фермент пепсин, содержащийся в желудке. Ряд высокоэффективных пищеварительных ферментов секретирует в кишечник поджелудочная железа. Это трипсин и химотрипсин, гидролизующие белки; липаза, расщепляющая жиры; амилаза, катализирующая расщепление крахмала. Пепсин, трипсин и химотрипсин секретируются в неактивной форме, в виде т.н. зимогенов (проферментов), и переходят в активное состояние только в желудке и кишечнике. Это объясняет, почему указанные ферменты не разрушают клетки поджелудочной железы и желудка. Стенки желудка и кишечника защищает от пищеварительных ферментов и слой слизи. Некоторые важные пищеварительные ферменты секретируются клетками тонкого кишечника.
Большая часть энергии, запасенной в растительной пище, такой, как трава или сено, сосредоточена в целлюлозе, которую расщепляет фермент целлюлаза. В организме травоядных животных этот фермент не синтезируется, и жвачные, например крупный рогатый скот и овцы, могут питаться содержащей целлюлозу пищей только потому, что целлюлазу вырабатывают микроорганизмы, заселяющие первый отдел желудка – рубец. С помощью микроорганизмов происходит переваривание пищи и у термитов.
Ферменты находят применение в пищевой, фармацевтической, химической и текстильной промышленности. В качестве примера можно привести растительный фермент, получаемый из папайи и используемый для размягчения мяса. Ферменты добавляют также в стиральные порошки.
Ферменты в медицине и сельском хозяйстве.
Осознание ключевой роли ферментов во всех клеточных процессах привело к широкому их применению в медицине и сельском хозяйстве. Нормальное функционирование любого растительного и животного организма зависит от эффективной работы ферментов. В основе действия многих токсичных веществ (ядов) лежит их способность ингибировать ферменты; таким же эффектом обладает и ряд лекарственных препаратов. Нередко действие лекарственного препарата или токсичного вещества можно проследить по его избирательному влиянию на работу определенного фермента в организме в целом или в той или иной ткани. Например, мощные фосфорорганические инсектициды и нервно-паралитические газы, разработанные в военных целях, оказывают свой губительный эффект, блокируя работу ферментов – в первую очередь холинэстеразы, играющей важную роль в передаче нервного импульса.
Чтобы лучше понять механизм действия лекарственных препаратов на ферментные системы, полезно рассмотреть, как работают некоторые ингибиторы ферментов. Многие ингибиторы связываются с активным центром фермента – тем самым, с которым взаимодействует субстрат. У таких ингибиторов наиболее важные структурные особенности близки к структурным особенностям субстрата, и если в реакционной среде присутствуют и субстрат и ингибитор, между ними наблюдается конкуренция за связывание с ферментом; при этом чем больше концентрация субстрата, тем успешнее он конкурирует с ингибитором. Ингибиторы другого типа индуцируют в молекуле фермента конформационные изменения, в которые вовлекаются важные в функциональном отношении химические группы. Изучение механизма действия ингибиторов помогает химикам создавать новые лекарственные препараты.
| НЕКОТОРЫЕ ФЕРМЕНТЫ И КАТАЛИЗИРУЕМЫЕ ИМИ РЕАКЦИИ | |||
| Тип химической реакции | Фермент | Источник | Катализируемая реакция 1) |
| Гидролиз | Трипсин | Тонкий кишечник | Белки + H2O ® Разные полипептиды |
| Гидролиз | b-Амилаза | Пшеница, ячмень, батат и т.д. | Крахмал + H2O ® Гидролизат крахмала + Мальтоза |
| Гидролиз | Тромбин | Кровь | Фибриноген + H2O ® Фибрин + 2 Полипептида |
| Гидролиз | Липазы | Кишечник, семена с большимсодержанием жиров,микроорганизмы | Жиры + H2O ® Жирные кислоты + Глицерин |
| Гидролиз | Щелочная фосфатаза | Почти все клетки | Органические фосфаты + H2O ® Дефосфорилированный продукт + Неорганический фосфат |
| Гидролиз | Уреаза | Некоторые растительные клетки и микроорганизмы | Мочевина + H2O ® Аммиак + Диоксид углерода |
| Фосфоролиз | Фосфорилаза | Ткани животных и растений,содержащие полисахариды | Полисахарид (крахмал или гликоген из n молекул глюкозы) + Неорганический фосфат Глюкозо-1-фосфат +Полисахарид (n–1 глюкозных единиц) |
| Декарбоксилирование | Декарбоксилаза | Дрожжи, некоторые растенияи микроорганизмы | Пировиноградная кислота ® Ацетальдегид + Диоксид углерода |
| Конденсация | Альдолаза | Все животные клетки; многиерастения и микроорганизмы | 2 Триозофосфат Гексозодифосфат |
| Конденсация | Оксалоацетат-трансаце-тилаза | То же | Щавелевоуксусная кислота + Ацетил-кофермент А Лимонная кислота + Кофермент А |
| Изомеризация | Фосфогексозоизомераза | То же | Глюкозо-6-фосфат Фруктозо-6-фосфат |
| Гидратация | Фумараза | То же | Фумаровая кислота + H2O Яблочная кислота |
| Гидратация | Карбоангидраза | Разные ткани животных; зеленые листья | Диоксид углерода + H2O Угольная кислота |
| Фосфорилирование | Пируваткиназа | Почти все (или все) клетки | АТФ + Пировиноградная кислота Фосфоенолпировиноградная кислота + АДФ |
| Перенос фосфатной группы | Фосфоглюкомутаза | Все животные клетки; многиерастения и микроорганизмы | Глюкозо-1-фосфат Глюкозо-6- фосфат |
| Переаминирование | Трансаминаза | Большинство клеток | Аспарагиновая кислота + Пировино-градная кислота Щавелевоуксусная кислота + Аланин |
| Синтез, сопряженный сгидролизом АТФ | Глутаминсинтетаза | То же | Глутаминовая кислота + Аммиак + АТФ Глутамин + АДФ + Неорганический фосфат |
| Окисление-восстановление | Цитохромоксидаза | Все животные клетки, многиерастения и микроорганизмы | O2 + Восстановленный цитохром c ® Окисленный цитохром c + H2O |
| Окисление-восстановление | Оксидаза аскорбиновойкислоты | Многие растительные клетки | Аскорбиновая кислота + O2 ® Дегидроаскорбиновая кислота + Пероксид водорода |
| Окисление-восстановление | Цитохром c редуктаза | Все животные клетки; многиерастения и микроорганизмы | НАД·Н (восстановленный кофермент) + Окисленный цитохром c ® Восстановленный цитохром c + НАД (окисленный кофермент) |
| Окисление-восстановление | Лактатдегидрогеназа | Большинство животных кле-ток; некоторые растенияи микроорганизмы | Молочная кислота + НАД (окисленный кофермент) Пировиноградная кислота + НАД·Н (восстановленный кофермент) |
| 1) Одинарная стрелка означает, что реакция идет фактически в одну сторону, а двойные стрелки – что реакция обратима. | |||
Фёршт Э. Структура и механизм действия ферментов. М., 1980
Страйер Л. Биохимия, т. 1 (с. 104–131), т. 2 (с. 23–94). М., 1984–1985
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохомия человека, т. 1. М., 1993
Читайте также:

