Фазовый переход пар жидкость кратко
Обновлено: 05.07.2024
Лёд, вода и водяной пар — примеры трёх агрегатных состояний вещества: твёрдого, жидкого и газообразного. В каком именно агрегатном состоянии находится данное вещество — зависит от его температуры и других внешних условий, в которых оно находится.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества тела. Нас будут интересовать следующие фазовые переходы.
• Плавление (твёрдое тело жидкость) и кристаллизация (жидкость твёрдое тело).
• Парообразование (жидкость пар) и конденсация (пар жидкость).
Плавление и кристаллизация
Большинство твёрдых тел являются кристаллическими, т.е. имеют кристаллическую решётку — строго определённое, периодически повторяющееся в пространстве расположение своих частиц.
Частицы (атомы или молекулы) кристаллического твёрдого тела совершают тепловые колебания вблизи фиксированных положений равновесия — узлов кристаллической решётки.

Рис. 1. Кристаллическая решётка
Плавлением называется превращение кристаллического твёрдого тела в жидкость. Расплавить можно любое тело — для этого нужно нагреть его до температуры плавления, которая зависит лишь от вещества тела, но не от его формы или размеров. Температуру плавления данного вещества можно определить из таблиц.
Наоборот, если охлаждать жидкость, то рано или поздно она перейдёт в твёрдое состояние. Превращение жидкости в кристаллическое твёрдое тело называется кристаллизацией или отвердеванием. Таким образом, плавление и кристаллизация являются взаимно обратными процессами.
Температура, при которой жикость кристаллизуется, называется температурой кристаллизации. Оказывается, что температура кристаллизации равна температуре плавления: при данной температуре могут протекать оба процесса. Так, при лёд плавится, а вода кристаллизуется; что именно происходит в каждом конкретном случае — зависит от внешних условий (например, подводится ли тепло к веществу или отводится от него).
Как происходят плавление и кристаллизация? Каков их механизм? Для уяснения сути этих процессов рассмотрим графики зависимости температуры тела от времени при его нагревании и охлаждении — так называемые графики плавления и кристаллизации.
График плавления
Начнём с графика плавления (рис. 2 ). Пусть в начальный момент времени (точка на графике) тело является кристаллическим и имеет некоторую температуру .

Рис. 2. График плавления
Затем к телу начинает подводиться тепло (скажем, тело поместили в плавильную печь), и температура тела повышается до величины — температуры плавления данного вещества. Это участок графика.
На участке тело получает количество теплоты
где — удельная теплоёмкость вещества твёрдого тела, — масса тела.
При достижении температуры плавления (в точке ) ситуация качественно меняется. Несмотря на то, что тепло продолжает подводиться, температура тела остаётся неизменной. На участке происходит плавление тела — его постепенный переход из твёрдого состояния в жидкое. Внутри участка мы имеем смесь твёрдого вещества и жидкости, и чем ближе к точке , тем меньше остаётся твёрдого вещества и тем больше появляется жидкости. Наконец, в точке от исходного твёрдого тела не осталось ничего: оно полностью превратилось в жидкость.
Участок соответствует дальнейшему нагреванию жидкости (или, как говорят, расплава). На этом участке жидкость поглощает количество теплоты
где — удельная теплоёмкость жидкости.
Но нас сейчас больше всего интересует — участок фазового перехода. Почему не меняется температура смеси на этом участке? Тепло-то подводится!
Вернёмся назад, к началу процесса нагревания. Повышение температуры твёрдого тела на участке есть результат возрастания интенсивности колебаний его частиц в узлах кристаллической решётки: подводимое тепло идёт на увеличение кинетической энергии частиц тела (на самом деле некоторая часть подводимого тепла расходуется на совершение работы по увеличению средних расстояний между частицами — как мы знаем, тела при нагревании расширяются. Однако эта часть столь мала, что её можно не принимать во внимание.).
С этого момента всё подводимое тепло идёт на совершение работы по разрыву связей, удерживающих частицы в узлах кристаллической решётки, т.е. на увеличение потенциальной энергии частиц. Кинетическая энергия частиц при этом остаётся прежней, так что температура тела не меняется. В точке кристаллическая структура исчезает полностью, разрушать больше нечего, и подводимое тепло снова идёт на увеличение кинетической энергии частиц — на нагревание расплава.
Удельная теплота плавления
Итак, для превращения твёрдого тела в жидкость мало довести его до температуры плавления. Необходимо дополнительно (уже при температуре плавления) сообщить телу некоторое количество теплоты для полного разрушения кристаллической решётки (т.е. для прохождения участка ).
Это количество теплоты идёт на увеличение потенциальной энергии взаимодействия частиц. Следовательно, внутренняя энергия расплава в точке больше внутренней энергии твёрдого тела в точке на величину .
Опыт показывает, что величина прямо пропорциональна массе тела:
Коэффициент пропорциональности не зависит от формы и размеров тела и является характеристикой вещества. Он называется удельной теплотой плавления вещества. Удельную теплоту плавления данного вещества можно найти в таблицах.
Удельная теплота плавления численно равна количеству теплоты, необходимому для превращения в жидкость одного килограмма данного кристаллического вещества, доведённого до температуры плавления.
Так, удельная теплота плавления льда равна кДж/кг, свинца — кДж/кг. Мы видим, что для разрушения кристаллической решётки льда требуется почти в раз больше энергии! Лёд относится к веществам с большой удельной теплотой плавления и поэтому весной тает не сразу (природа приняла свои меры: обладай лёд такой же удельной теплотой плавления, как и свинец, вся масса льда и снега таяла бы с первыми оттепелями, затопляя всё вокруг).
График кристаллизации
Теперь перейдём к рассмотрению кристаллизации — процесса, обратного плавлению. Начинаем с точки предыдущего рисунка. Предположим, что в точке нагревание расплава прекратилось (печку выключили и расплав выставили на воздух). Дальнейшее изменение температуры расплава представлено на рис. (3) .

Рис. 3. График кристаллизации
Жидкость остывает (участок ), пока её температура не достигнет температуры кристаллизации, которая совпадает с температурой плавления .
С этого момента температура расплава меняться перестаёт, хотя тепло по-прежнему уходит от него в окружающую среду. На участке происходит кристаллизация расплава — его постепенный переход в твёрдое состояние. Внутри участка мы снова имеем смесь твёрдой и жидкой фаз, и чем ближе к точке , тем больше становится твёрдого вещества и тем меньше — жидкости.Наконец,вточке жидкостинеостаётсявовсе—онаполностьюкристаллизовалась.
Следующий участок соответствует дальнейшему остыванию твёрдого тела, возникшего в результате кристаллизации.
Нас опять-таки интересует участок фазового перехода : почему температура остаётся неизменной, несмотря на уход тепла?
Снова вернёмся в точку . После прекращения подачи тепла температура расплава понижается, так как его частицы постепенно теряют кинетическую энергию в результате соударений с молекулами окружающей среды и излучения электромагнитных волн.
Одновременно начнётся встречный процесс выделения энергии: когда частицы занимают свои места в узлах кристаллической решётки, их потенциальная энергия резко уменьшается, за счёт чего увеличивается их кинетическая энергия — кристаллизующаяся жидкость является источником тепла (часто у проруби можно увидеть сидящих птиц. Они там греются!). Выделяющееся в ходе кристаллизации тепло в точности компенсирует потерю тепла в окружающую среду, и потому температура на участке не меняется.
Как показывает опыт, при кристаллизации на участке выделяется ровно то же самое количество теплоты , которое было поглощено при плавлении на участке .
Парообразование и конденсация
Парообразование — это переход жидкости в газообразное состояние (в пар). Существует два способа парообразования: испарение и кипение.
Разные жидкости испаряются с разными скоростями: чем больше силы притяжения молекул друг к другу — тем меньшее число молекул в единицу времени окажутся в состоянии их преодолеть и вылететь наружу, и тем меньше скорость испарения. Быстро испаряются эфир, ацетон, спирт (их иногда называют летучими жидкостями), медленнее — вода, намного медленнее воды испаряются масло и ртуть.
Скорость испарения растёт с повышением температуры (в жару бельё высохнет скорее), поскольку увеличивается средняя кинетическая энергия молекул жидкости, и тем самым возрастает число быстрых молекул, способных покинуть её пределы.
Скорость испарения зависит от площади поверхности жидкости: чем больше площадь, тем большее число молекул получают доступ к поверхности, и испарение идёт быстрее (вот почему при развешивании белья его тщательно расправляют).
Одновременно с испарением наблюдается и обратный процесс: молекулы пара, совершая беспорядочное движение над поверхностью жидкости, частично возвращаются обратно в жидкость. Превращение пара в жидкость называется конденсацией.
Конденсация замедляет испарение жидкости. Так, в сухом воздухе бельё высохнет быстрее, чем во влажном. Быстрее оно высохнет и на ветру: пар сносится ветром, и испарение идёт более интенсивно
В некоторых ситуациях скорость конденсации может оказаться равной скорости испарения. Тогда оба процесса компенсируют друг друга и наступает динамическое равновесие: из плотно закупоренной бутылки жидкость не улетучивается годами, а над поверхностью жидкости в этом случае находится насыщенный пар.
Конденсацию водяного пара в атмосфере мы постоянно наблюдаем в виде облаков, дождей и выпадающей по утрам росы; именно испарение и конденсация обеспечивают круговорот воды в природе, поддерживая жизнь на Земле.
Поскольку испарение — это уход из жидкости самых быстрых молекул, в процессе испарения средняя кинетическая энергия молекул жидкости уменьшается, т.е. жидкость остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости (особенно при ветре), когда выходишь из воды: вода, испаряясь по всей поверхности тела, уносит тепло, ветер же ускоряет процесс испарения (nеперь понятно, зачем мы дуем на горячий чай. Кстати сказать, ещё лучше при этом втягивать воздух в себя, поскольку на поверхность чая тогда приходит сухой окружающий воздух, а не влажный воздух из наших лёгких ;-)).
Ту же прохладу можно почувствовать, если провести по руке кусочком ваты, смоченным в летучем растворителе (скажем, в ацетоне или жидкости для снятия лака). В сорокаградусную жару благодаря усиленному испарению влаги через поры нашего тела мы сохраняем свою температуру на уровне нормальной; не будь этого терморегулирующего механизма, в такую жару мы бы попросту погибли.
Наоборот, в процессе конденсации жидкость нагревается: молекулы пара при возвращении в жидкость разгоняются силами притяжения со стороны находящихся поблизости молекул жидкости, в результате чего средняя кинетическая энергия молекул жидкости увеличивается (сравните это явление с выделением энергии при кристаллизации расплава!).
Кипение
Кипение — это парообразование, происходящее по всему объёму жидкости.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. При нагревании жидкости этот воздух расширяется, пузырьки воздуха постепенно увеличиваются в размерах и становятся видимы невооружённым глазом (в кастрюле с водой они осаждают дно и стенки). Внутри воздушных пузырьков находится насыщенный пар, давление которого, как вы помните, быстро растёт с повышением температуры.
Чем крупнее становятся пузырьки, тем большая действует на них архимедова сила, и определённого момента начинается отрыв и всплытие пузырьков. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости; пар в них конденсируется, и пузырьки сжимаются опять. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар — шум сменяется бульканьем, жидкость кипит.
В отличие от испарения, происходящего при любой температуре, жидкость начинает кипеть только при достижении температуры кипения — именно той температуры, при которой пузырьки воздуха оказываются в состоянии всплыть и добраться до поверхности. При температуре кипения давление насыщенного пара становится равно внешнему давлению на жидкость (в частности, атмосферному давлению). Соответственно, чем больше внешнее давление, тем при более высокой температуре начнётся кипение.
При нормальном атмосферном давлении ( атм или Па) температура кипения воды равна . Поэтому давление насыщенного водяного пара при температуре равно Па. Этот факт необходимо знать для решения задач — часто он считается известным по умолчанию.
На вершине Эльбруса атмосферное давление равно атм, и вода там закипит при температуре . А под давлением атм вода начнёт кипеть только при .
Температура кипения (при нормальном атмосферном давлении) является строго определённой для данной жидкости величиной (температуры кипения, приводимые в таблицах учебников и справочников — это температуры кипения химически чистых жидкостей. Наличие в жидкости примесей может изменять температуру кипения. Скажем, водопроводная вода содержит растворённый хлор и некоторые соли, поэтому её температура кипения при нормальном атмосферном давлении может несколько отличаться от ). Так, спирт кипит при , эфир — при , ртуть — при . Обратите внимание: чем более летучей является жидкость, тем ниже её температура кипения. В таблице температур кипения мы видим также, что кислород кипит при . Значит, при обычных температурах кислород — это газ!
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится — процесс кипения требует непрерывного подвода тепла. Вместе с тем, температура воды в чайнике после закипания перестаёт меняться, всё время оставаясь равной . Куда же при этом девается подводимое тепло?
Ситуация аналогична процессу плавления: тепло идёт на увеличение потенциальной энергии молекул. В данном случае — на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалёку друг от друга, и жидкость будет переходить в газообразное состояние.
График кипения
Рассмотрим графическое представление процесса нагревания жидкости — так называемый график кипения (рис. 4 ).

Рис. 4. График кипения
Участок предшествует началу кипения. На участке жидкость кипит, её масса уменьшается. В точке жидкость выкипает полностью.
Чтобы пройти участок , т.е. чтобы жидкость, доведённую до температуры кипения, полностью превратить в пар, к ней нужно подвести некоторое количество теплоты . Опыт показывает, что данное количество теплоты прямо пропорционально массе жидкости:
Коэффициент пропорциональности называется удельной теплотой парообразования жидкости (при температуре кипения). Удельная теплота парообразования численно равна количеству теплоты, которое нужно подвести к 1 кг жидкости, взятой при температуре кипения, чтобы полностью превратить её в пар.
Так, при удельная теплота парообразования воды равна кДж/кг. Интересно сравнить её с удельной теплотой плавления льда ( кДж/кг) — удельная теплота парообразования почти в семь раз больше! Это и не удивительно: ведь для плавления льда нужно лишь разрушить упорядоченное расположение молекул воды в узлах кристаллической решётки; при этом расстояния между молекулами остаются примерно теми же. А вот для превращения воды в пар нужно совершить куда большую работу по разрыву всех связей между молекулами и удалению молекул на значительные расстояния друг от друга.
График конденсации
Процесс конденсации пара и последующего остывания жидкости выглядит на графике симметрично процессу нагревания и кипения. Вот соответствующий график конденсации для случая стоградусного водяного пара, наиболее часто встречающегося в задачах (рис. 5 ).

Рис. 5. График конденсации
В точке имеем водяной пар при . На участке идёт конденсация; внутри этого участка — смесь пара и воды при . В точке пара больше нет, имеется лишь вода при . Участок — остывание этой воды.
Опыт показывает, что при конденсации пара массы (т. е. при прохождении участка ) выделяется ровно то же самое количество теплоты , которое было потрачено на превращение в пар жидкости массы при данной температуре.
Давайте ради интереса сравним следующие количества теплоты:
• , которое выделяется при конденсации г водяного пара;
• , которое выделяется при остывании получившейся стоградусной воды до температуры, скажем, .
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Если создать определенные условия, можно превратить любой реальный газ (например, азот, водород, кислород) в жидкость. Для этого необходимо понижение температуры ниже некоторого минимума, называемого критической температурой. Она обозначается T к р . Так, для азота значение этого параметра равно 126 К , для воды – 647 , 3 К , для кислорода – 154 , 3 К . При поддержании комнатной температуры вода может сохранять как газообразное, так и жидкое состояние, а азот и кислород – только газообразное.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.

Рисунок 3 . 4 . 1 . Модель испарения и конденсации.
Динамическое равновесие
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
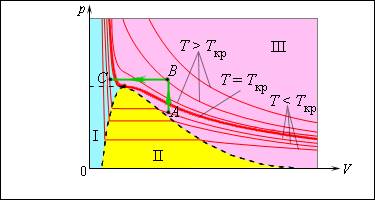
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Возьмем насыщенный пар и будем сжимать его изотермически при T T к р . Его давление будет постепенно возрастать, пока не сравняется с давлением насыщенного пара. Постепенно на дне сосуда появится жидкость, и между ней и ее насыщенным паром возникнет динамическое равновесие. По мере уменьшения объема будет происходить конденсация все большей части пара при неизменном давлении (на изотерме это состояние соответствует горизонтальному участку). После того, как весь пар перейдет в жидкое состояние, давление начнет резко увеличиваться при дальнейшем уменьшении объема, поскольку жидкость сжимается слабо.
Необязательно проходить двухфазную область, чтобы совершить переход от газа к жидкости. Процесс можно провести и в обход критической точки. На изображении такой вариант показан при помощи ломаной линии A B C .

Рисунок 3 . 4 . 3 . Модель изотермы реального газа.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Если атмосферное давление нормальное, то для кипения воды нужна температура 100 ° С . При ней давление насыщенных водяных паров будет равно 1 а т м . Если мы будем кипятить воду в горах, то из-за уменьшения атмосферного давления температура кипения снизится до 70 ° С .
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.

Рисунок 3 . 4 . 4 . Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область I I – жидкость, область I I I – газообразное вещество.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Многие вещества достигают тройной точки при давлении меньше 1 а т м ≈ 10 5 П а . Они плавятся при нагревании в атмосферном давлении. Так, у воды тройная точка имеет координаты T т р = 273 , 16 К , p т р = 6 , 02 · 10 2 П а . Именно на ней основана абсолютная температурная шкала Кельвина.
У некоторых веществ достижение тройной точки происходит и при давлении выше 1 а т м .
Например, для углекислоты нужно давление в 5 , 11 а т м и температура T т р = 216 , 5 К . Если давление равно атмосферному, то для поддержания ее в твердом состоянии нужна низкая температура, а переход в жидкое состояние становится невозможен. Углекислота в равновесии со своим паром при атмосферном давлении называется сухим льдом. Это вещество не способно плавиться, а может только испаряться (сублимировать).
Получим теперь термодинамические условия фазового перехода и фазового равновесия жидкости и пара. Пусть имеем две фазы вещества: жидкое (1) и газообразное (2). Термодинамический потенциал Гиббса такой двухфазной системы будет , где – число частиц в i-ой фазе (i = 1,2), а μi – термодинамический потенциал Гиббса, приходящийся на одну частицу i-ой фазы; эта величина характеризует внутренние свойства фазы и представляет собой ее химический потенциал.
Если две фазы не находятся в равновесии друг с другом, то число частиц в обеих фазах будет изменяться. При изменении числа частиц в первой фазе на , а во второй на термодинамический потенциал системы изменится на . Но так как то и тогда Поскольку система не находится в равновесии, то ее термодинамический потенциал будет уменьшаться: Отсюда следует, что если то а т.е. число частиц в первой фазе возрастает, а во второй уменьшается. Это означает, что переход вещества происходит из второй фазы в первую, т.е. имеет место процесс конденсации. Процесс будет продолжаться до тех пор пока все вещество не окажется в фазе 1, т.е. пока пар полностью не сконденсируется. В этом случае термодинамический потенциал достигнет минимального значения . Отсюда следует, что при термодинамически устойчивой будет фаза 1 (жидкость), так как небольшое уменьшение числа частиц в первой фазе и увеличение их во второй вызовет поток частиц из второй фазы в первую. Если имеет место неравенство то а . Переход вещества будет происходить из фазы 1 в фазу 2 – парообразование. Термодинамический потенциал достигнет своего минимального значения когда все вещество перейдет в парообразное состояние; термодинамически устойчивой будет фаза 2 (пар).
Поскольку химический потенциал, как и термодинамический потенциал Гиббса, является функцией температуры Т и давления р, то выполнение того или иного неравенства потенциалов фаз определяется значениями температуры и давления: при одних значениях Т и р меньшим окажется химический потенциал жидкости, а при других – пара. Это означает, что при одних значениях температуры и давления устойчивой будет жидкая фаза, а при других – газообразная. Если температура и давление таковы, что то выполняется условие минимума термодинамического потенциала – двухфазная система (жидкость + пар) будет находиться в равновесии. В этом случае – переход вещества из одной фазы в другую не происходит. Имеет место равновесие фаз между собой. Таким образом, условием равновесия двух фаз является равенство их химических потенциалов:

(7.5)
При этом температуры и давления фаз также равны друг другу:
где .Т и р – температура и давление фазового равновесия и перехода.
Учитывая определение химического потенциала, перепишем равенство (7.5) в виде

где u, s, v – удельная (в расчете на одну молекулу) внутренняя энергия, энтропия и объем фаз соответственно. Откуда
∆u + p∆v = T∆s.
Согласно первому закону термодинамики, левая часть этого равенства есть удельная теплота фазового перехода q. Следовательно,

Отсюда видно, что если энтропия конечной фазы больше энтропии начальной фазы, т.е. s2 > s1, то q > 0 – фазовый переход (парообразование) происходит с поглощением теплоты; если же, наоборот, s2
Поскольку химический потенциал, как и термодинамический потенциал Гиббса, является функцией температуры Т и давления р, то выполнение того или иного неравенства потенциалов фаз определяется значениями температуры и давления: при одних значениях Т и р меньшим окажется химический потенциал жидкости, а при других – пара. Это означает, что при одних значениях температуры и давления устойчивой будет жидкая фаза, а при других – газообразная. Если температура и давление таковы, что то выполняется условие минимума термодинамического потенциала – двухфазная система (жидкость + пар) будет находиться в равновесии. В этом случае – переход вещества из одной фазы в другую не происходит. Имеет место равновесие фаз между собой. Таким образом, условием равновесия двух фаз является равенство их химических потенциалов:

(7.5)
При этом температуры и давления фаз также равны друг другу:
где .Т и р – температура и давление фазового равновесия и перехода.
Учитывая определение химического потенциала, перепишем равенство (7.5) в виде

где u, s, v – удельная (в расчете на одну молекулу) внутренняя энергия, энтропия и объем фаз соответственно. Откуда
∆u + p∆v = T∆s.
Согласно первому закону термодинамики, левая часть этого равенства есть удельная теплота фазового перехода q. Следовательно,
Отсюда видно, что если энтропия конечной фазы больше энтропии начальной фазы, т.е. s2 > s1, то q > 0 – фазовый переход (парообразование) происходит с поглощением теплоты; если же, наоборот, s2

Оказывается, у насыщенного пара и бизнес-центра много общего, а чтобы вскипятить чайник при температуре меньше 100°C, нужно забраться на Эльбрус.
О чем эта статья:
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
На схеме — названия всех фазовых переходов:
Фазовые переходы — важная штука. Все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы в металлургии и микроэлектронике.
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
из глубины жидкости к поверхности, а затем в воздух;
только из жидкости к поверхности;
к поверхности из воды и газовой среды одновременно;
к площади поверхности только от воздуха.
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
при любой температуре
с поверхности жидкости
при определенной температуре
с поверхности жидкости
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный.
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м 2 × кг × с -2 × К -1 × моль -1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.
Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K
Читайте также:

