Факторы влияющие на протекание овр кратко
Обновлено: 05.07.2024
Окислительно — восстановительный потенциал является частным, узким случаем понятия электродного потенциала. Рассмотрим подробнее эти понятия.
В ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции переходит в теплоту.
Энергия любой ОВР, протекающей в растворе электролита, может быть превращена в электрическую энергию, если, например, окислительно-восстановительные процессы разделить пространственно, т.е. передача электронов восстановителем будет происходить через проводник электричества.
Это реализовано в гальванических элементах, где электрическая энергия получается из химической энергии окислительно-восстановительной реакции.
Элемент Даниэля-Якоби
Рассмотрим гальванический элемент Даниэля-Якоби, в котором левый сосуд наполнен раствором сульфата цинка ZnSO4, с опущенной в него цинковой пластинкой, а правый сосуд – раствором сульфата меди CuSO4, с опущенным в него медной пластинкой.

гальванический элемент Даниэля-Якоби
Взаимодействие между раствором и пластиной, которая выступает в качестве электрода, способствует тому, чтобы электрод приобрел электрический заряд.
Возникающая на границе металл-раствор электролита разность потенциалов, называется электродным потенциалом. Значение и знак (+ или -) электродного потенциала определяются природой раствора и находящегося в нем металла.
При погружении металлов в растворы их солей более активные из них (Zn, Fe и др.) заряжаются отрицательно, а менее активные (Cu, Ag, Au и др.) положительно.
Результатом соединения цинковой и медной пластинки проводником электричества, является возникновение в цепи электрического тока за счет перетекания электронов с цинковой к медной пластинке по проводнику.
При этом происходит уменьшение количества электронов в цинке, что компенсируется переходом Zn 2+ в раствор т.е. происходит растворение цинкового электрода — анода (процесс окисления).
Zn — 2e — = Zn 2+
В свою очередь, рост количества электронов в меди компенсируется разряжением ионов меди, содержащихся в растворе, что приводит к накоплению меди на медном электроде – катоде (процесс восстановления):
Cu 2+ + 2e — = Cu
Таким образом, в элементе Даниэля-Якоби происходит такая реакция:
Zn + Cu 2+ = Zn 2+ + Cu
Zn + CuSO4 = ZnSO4 + Cu
Количественно охарактеризовать окислительно-восстановительные процессы позволяют электродные потенциалы, измеренные относительно нормального водородного электрода (его потенциал принят равным нулю).
Чтобы определить стандартные электродные потенциалы используют элемент, одним из электродов которого является испытуемый металл (или неметалл), а другим является водородный электрод. По найденной разности потенциалов на полюсах элемента определяют нормальный потенциал исследуемого металла.
Окислительно-восстановительный потенциал
Значениями окислительно-восстановительного потенциала пользуются в случае необходимости определения направления протекания реакции в водных или других растворах.
2Fe 3+ + 2I — = 2Fe 2+ + I2
таким образом, чтобы йодид-ионы и ионы железа обменивались своими электронами через проводник.
В сосуды, содержащие растворы Fe 3+ и I — , поместим инертные (платиновые или угольные) электроды и замкнем внутреннюю и внешнюю цепь. В цепи возникает электрический ток.
Йодид-ионы отдают свои электроны, которые будут перетекать по проводнику к инертному электроду, погруженному в раствор соли Fe 3+ :
2I — — 2e — = I2
2Fe 3+ + 2e — = 2Fe 2+
Процессы окисления-восстановления происходят у поверхности инертных электродов. Потенциал, который возникает на границе инертный электрод – раствор и содержит как окисленную, так восстановленную форму вещества, называется равновесным окислительно-восстановительным потенциалом.
Факторы, влияющие на значение окислительно-восстановительного потенциала
Значение окислительно-восстановительного потенциала зависит от многих факторов, в том числе и таких как:
1) Природа вещества (окислителя и восстановителя)
2) Концентрация окисленной и восстановленной форм.
При температуре 25°С и давлении 1 атм. величину окислительно-восстановительного потенциала рассчитывают с помощью уравнения Нернста:
E – окислительно-восстановительный потенциал данной пары;
E°- стандартный потенциал (измеренный при Cок = Cвос);
R – газовая постоянная (R = 8,314 Дж);
T – абсолютная температура, К
n – количество отдаваемых или получаемых электронов в окислительно-восстановительном процессе;
F – постоянная Фарадея (F = 96484,56 Кл/моль);
Cок – концентрация (активность) окисленной формы;
Cвос– концентрация (активность) восстановленной формы.
Подставляя в уравнение известные данные и перейдя к десятичному логарифму, получим следующий вид уравнения:
При Cок > Cвос, E > E° и наоборот, если Cок 2- , CrO4 2- , MnO4 — ) при уменьшении pH раствора окислительно-восстановительный потенциал возрастает, т.е. потенциал растет с ростом H + . И наоборот, окислительно-восстановительный потенциал падает с уменьшением H + .
4) Температура
При увеличении температуры окислительно-восстановительный потенциал данной пары также растет.
Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников. Следует иметь ввиду, что рассматриваются только реакции в водных растворах при температуре ≈ 25°С.
Такие таблицы дают возможность сделать некоторые выводы:
Что можно определить по значению окислительно-восстановительного потенциала
- Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют предсказать какие свойства (окислительные или восстановительные) будут проявлять атомы, ионы или молекулы в химических реакциях, например
E°(F2/2F — ) = +2,87 В – сильнейший окислитель
E°(K + /K) = — 2,924 В – сильнейший восстановитель
Окислительно-восстановительная пара будет обладать тем большей восстановительной способностью, чем больше числовое значение ее отрицательного потенциала, а окислительная способность тем выше, чем больше положительный потенциал.
- Возможно определить какое из соединений одного элемента будет обладать наиболее сильным окислительными или восстановительными свойствами.
- Возможно предсказать направление ОВР. Известно, что работа гальванического элемента имеет место при условии, что разность потенциалов имеет положительное значение. Протекание ОВР в выбранном направлении также возможно, если разность потенциалов имеет положительное значение. ОВР протекает в сторону более слабых окислителей и восстановителей из более сильных, например, реакция
Sn 2+ + 2Fe 3+ = Sn 4+ + 2Fe 2+
практически протекает в прямом направлении, т.к.
E° (Sn 4+ /Sn 2+ ) = +0,15 В,
E° (Fe 3+ /Fe 2+ ) = +0,77 В,
т.е. E° (Sn 4+ /Sn 2+ ) 3+ /Fe 2+ ).
Cu + Fe 2+ = Cu 2+ + Fe
невозможна в прямом направлении и протекает только справа налево, т.к.
В процессе ОВР количество начальных веществ уменьшается, вследствие чего Е окислителя падает, а E восстановителя возрастает. При окончании реакции, т.е. при наступлении химического равновесия потенциалы обоих процессов выравниваются.
- Если при данных условиях возможно протекание нескольких ОВР, то в первую очередь будет протекать та реакция, у которой разность окислительно-восстановительных потенциалов наибольшая.
- Пользуясь справочными данными, можно определить ЭДС реакции.
Как определить электродвижущую силу (ЭДС) реакции?
Рассмотрим несколько примеров реакций и определим их ЭДС:
E° (Mg 2+ /Mg) = — 2,36 В
E° (Fe 2+ /Fe) = — 0,44 В
Чтобы определить ЭДС реакции, нужно найти разность потенциала окислителя и потенциала восстановителя
ЭДС = Е 0 ок — Е 0 восст
- ЭДС = — 0,44 — (- 2,36) = 1,92 В
- ЭДС = 0,00 — (- 2,36) = 2,36 В
- ЭДС = + 0,34 — (- 2,36) = 2,70 В
Все вышеуказанные реакции могут протекать в прямом направлении, т.к. их ЭДС > 0.
Связь константы равновесия и окислительно — восстановительного потенциала
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu 2+ = Zn 2+ + Cu
Применяя закон действующих масс, можно записать
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn 2+ и Cu/Cu 2+ , находим
В состоянии равновесия E 0 Zn/Zn2+ = E 0 Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2+ = +0,34 + (0,59/2)lgCCu2+, откуда получаем
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 10 37,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E1 0 -E2 0 )n/0,059, где
K — константа равновесия
E1 0 и E2 0 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E1 0 > E2 0 , то lgK > 0 и K > 1.
Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E1 0 — E2 0 ) достаточно велика, то она идет практически до конца.
Напротив, если E1 0 0 , то K будет очень мала.
Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E1 0 — E2 0 ) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
Как составить схему гальванического элемента?
Приведем рекомендации ИЮПАК, которыми следует руководствоваться, чтобы правильно записать схемы гальванических элементов и протекающие в них реакции:
- ЭДС элемента — величина положительная, т.к. в гальваническом элементе работа производится.
- Значение ЭДС гальванической цепи – это сумма скачков потенциалов на границах раздела всех фаз, но, учитывая, что на аноде происходит окисление, то из значения потенциала катода вычитают значение потенциала анода.
Таким образом, при составлении схемы гальванического элемента слева записывают электрод, на котором происходит процесс окисления (анод), а справа – электрод, на котором происходит процесс восстановления (катод).
- Граница раздела фаз обозначается одной чертой — |
- Электролитный мостик на границе двух проводников обозначается двумя чертами — ||
- Растворы, в которые погружен электролитный мостик записываются слева и справа от него (если необходимо, здесь же указывается концентрация растворов). Компоненты одной фазы, при этом записываются через запятую.
Например, составим схему гальванического элемента, в котором осуществляется следующая реакция:
Fe 0 + Cd 2+ = Fe 2+ + Cd 0
В гальваническом элементе анодом является железный электрод, а катодом – кадмиевый.
Анод Fe 0 |Fe 2+ || Cd 2+ |Cd 0 Катод
Типичные задачи на составление схем гальванического элемента и вычисление ЭДС реакции с решениями вы найдете здесь.
В зависимости от среды может изменяться характер протекания реакций между одними и теми же веществами.
Рассмотрим на примере реакции восстановления перманганата калия сульфитом натрия в различных средах.
--- H + → Mn +2 бесцветный раствор
--- OH - → Mn +6 O4 2- зеленый раствор
1) В кислой среде происходит обесцвечивание фиолетового раствора KMnO4 в результате образования иона Mn +2 :
S +4 - 2e → S +6 | 5 восстановитель, окисляется
2) В нейтральной среде выпадает бурый осадок Mn +4 O2:
S +4 - 2e → S +6 | 3 восстановитель, окисляется
3) В щелочной среде образуется зеленый раствор, в результате образования манганат-иона Mn +6 O4 2- .
S +4 - 2e → S +6 | 1 восстановитель, окисляется
Методы уравнивания ОВР
1.Метод электронного баланса (рассмотрен выше).
2.Метод полуреакций (или ионно- электронный метод).
При составлении уравнений методом полуреакций придерживаются следующего порядка:
1) Составляем схему реакции с указанием исходных веществ и продуктов определяют степени окисления, находят окислитель и восстановитель.
2) Выписать ионы реально участвующие в процессе.
3) Составить схемы полуреакций окисления и восстановления с указанием реально существующих в условиях реакций ионов или молекул. При этом необходимо учитывать количество кислорода в исходных веществах и продуктах реакции.
Удобно пользоваться следующей схемой 1:
Баланс атомов кислорода в ОВР, протекающих в различных средах.
Баланс атомов кислорода в исходных веществах
Пояснение к схеме:
1. Если исходный ион содержит больше атомов О, чем продукт реакции, то избыток атомов О в кислой среде связывается ионами Н + с образованием воды. В нейтральной и щелочной среде кислород реагирует с молекулами воды с образованием гидроксид иона.
2. Если исходный ион содержит меньше атомов О, чем продукт реакции, то недостаток атомов О компенсируется в кислых и нейтральных средах молекулами воды, а в щелочной среде гидроксид - ионами
4) Уравнять число атомов каждого элемента в левой и правой частях полуреакций.
5) Уравнять суммарное число зарядов в обеих частях каждой полуреакции, для этого прибавить к левой части полуреакции необходимое число электронов.
6) Подобрать коэффициенты для полуреакции так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
7) Сложить левые и правые части уравнения полуреакций с учетом найденных коэффициентов и расставить коэффициенты в исходное уравнение реакции.
Пример 1:
Рассмотрим реакцию, протекающую в кислой среде:
В данной реакции повышается степень окисления серы от +4 до +6 (сера окисляется, в реакции является восстановителем) и понижается степень окисления хлора от +5 до -1 (хлор восстанавливается, является окислителем).
ОВР могут протекать в различных средах:
1.В кислой среде (избыток Н + ).
2.В щелочной среде (избыток OH - ).
3.В нейтральной среде.
В зависимости от среды может изменяться характер протекания реакций между одними и теми же веществами.
Рассмотрим на примере реакции восстановления перманганата калия сульфитом натрия в различных средах.
--- H + → Mn +2 бесцветный раствор
--- OH - → Mn +6 O4 2- зеленый раствор
1) В кислой среде происходит обесцвечивание фиолетового раствора KMnO4 в результате образования иона Mn +2 :

S +4 - 2e → S +6 | 5 восстановитель, окисляется
2) В нейтральной среде выпадает бурый осадок Mn +4 O2:
S +4 - 2e → S +6 | 3 восстановитель, окисляется
3) В щелочной среде образуется зеленый раствор, в результате образования манганат-иона Mn +6 O4 2- .
S +4 - 2e → S +6 | 1 восстановитель, окисляется
Методы уравнивания ОВР
1.Метод электронного баланса (рассмотрен выше).
2.Метод полуреакций (или ионно- электронный метод).
При составлении уравнений методом полуреакций придерживаются следующего порядка:
1) Составляем схему реакции с указанием исходных веществ и продуктов определяют степени окисления, находят окислитель и восстановитель.
2) Выписать ионы реально участвующие в процессе.
3) Составить схемы полуреакций окисления и восстановления с указанием реально существующих в условиях реакций ионов или молекул. При этом необходимо учитывать количество кислорода в исходных веществах и продуктах реакции.
Удобно пользоваться следующей схемой 1:
Баланс атомов кислорода в ОВР, протекающих в различных средах.
Баланс атомов кислорода в исходных веществах
Пояснение к схеме:
1. Если исходный ион содержит больше атомов О, чем продукт реакции, то избыток атомов О в кислой среде связывается ионами Н + с образованием воды. В нейтральной и щелочной среде кислород реагирует с молекулами воды с образованием гидроксид иона.
2. Если исходный ион содержит меньше атомов О, чем продукт реакции, то недостаток атомов О компенсируется в кислых и нейтральных средах молекулами воды, а в щелочной среде гидроксид - ионами
4) Уравнять число атомов каждого элемента в левой и правой частях полуреакций.
5) Уравнять суммарное число зарядов в обеих частях каждой полуреакции, для этого прибавить к левой части полуреакции необходимое число электронов.
6) Подобрать коэффициенты для полуреакции так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
7) Сложить левые и правые части уравнения полуреакций с учетом найденных коэффициентов и расставить коэффициенты в исходное уравнение реакции.
Пример 1:
Рассмотрим реакцию, протекающую в кислой среде:
В данной реакции повышается степень окисления серы от +4 до +6 (сера окисляется, в реакции является восстановителем) и понижается степень окисления хлора от +5 до -1 (хлор восстанавливается, является окислителем).

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей


И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.

Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.

Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.

Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:

где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.

Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Наряду с кислотно-основным взаимодействием, в основе которого лежит обмен протоном (Н + ) между реагентами, в природе широко распространено окислительно-восстановительное взаимодействие, которое характеризуется перераспределением электронов между реагентами.
Окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними. В окислительно-восстановительных реакциях всегда происходят отдача и присоединение электронов.
Окислением называется процесс отдачи электронов атомом вещества, сопровождающийся повышением степени его окисления.
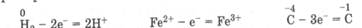 |
Например:
Восстановлением называется процесс присоединения электронов атомом вещества, сопровождающийся понижением степени его окисления.

В ходе окислительно-восстановительной реакции оба процесса протекают одновременно, причем общее число электронов, отданных при окислении, равно общему числу электронов, принятых при восстановлении.
Окислителем называется вещество, в состав которого входят атомы, присоединяющие электроны, т. е. окислитель - акцептор электронов.
Восстановителем называется вещество, в состав которого входят атомы, отдающие электроны, т. е. восстановитель - донор электронов. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряженный восстановитель:

Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряженный окислитель:

Любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений - окисления и восстановления:
 |
 |
Например:
Совокупность окислителя(восстановителя) с продуктом его превращения составляет сопряженную окислительно-восстановительную пару, а ее взаимопревращение является полуреакцией восстановления (окисления). В любой окислительно-восстановительной реакции принимают участие две сопряженные окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т. е. восстановлением, другая - с отдачей электронов, т. е. окислением.

ре-
для правильного обозначения сопряженной окислительно-восстановительной пары вначале следует записывать окисленную, а затем - восстановленную форму вещества.
Взаимодействие веществ в окислительно-восстановительных реакциях, как и в других химических реакциях, подчиняется закону эквивалентов.
Эквивалентом окислителя или восстановителя называется его частица (реальная или условная), которая, соответственно, присоединяет или отдает один электрон.
Молярная масса эквивалента 1/z М(Х) окислителя или восстановителя равна их молярной массе М(Х), умноженной на фактор их эквивалентности 1/z в данной реакции. Фактор эквивалентности окислителя или восстановителя равен 1/z где z - число электронов, принятых или отданных одной частицей (молекулой, атомом, ионом) окислителя или восстановителя. Поэтому молярная масса эквивалента окислителя или восстановителя вычисляется по уравнению:
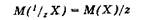
Факторы, влияющие на протекание окислительно-восстановительных реакций.Характер протекания окислительно-восстановительных реакций зависит от химической природы взаимодействующих веществ и от условий проведения реакции:

Как видно из анализа приведенных полуреакций, в окислительно-восстановительных реакциях, протекающих в водных растворах, часто принимают участие вода или ее ионы Н + и ОН - , которые не только способствуют передаче электронов от восстановителя к окислителю, но и связывают компоненты данных превращений. Особенно это важно для биохимических окислительно-восстановительных реакций, всегда протекающих в водных растворах.
Читайте также:

