Этиленгликоль физические свойства кратко
Обновлено: 05.07.2024
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу [1] .
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией "Carbide and Carbon Chemicals Co." К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксалана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора(толуолсульфоновой кислоты, насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
![Ethylene glycol protecting group.jpg]()
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [2] или комплекса диметилсульфат-ДМФА [3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- компонент в составе систем жидкостного охлаждения компьютеров
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
Концентрация % 30 35 40 45 50 55 60 Плотность, г/мл 1,050 1,058 1,067 1,074 1,082 1,090 1,098 Меры безопасности
См. также
Примечания
Ссылки
- Нефтехимия
- Гликоли
- Продукция основного органического синтеза
- Климатическое и холодильное оборудование
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Этиленгликоль" в других словарях:
этиленгликоль — этиленгликоль … Орфографический словарь-справочник
ЭТИЛЕНГЛИКОЛЬ — НОСН2СН2ОН, вязкая бесцветная жидкость, tкип 197,6 .С. Применяется в производстве полиэтилентерефталата, полиуретанов, взрывчатых и душистых веществ, как компонент антифризов … Большой Энциклопедический словарь
этиленгликоль — сущ., кол во синонимов: 1 • спирт (101) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этиленгликоль — – моноэтиленгликоль – НО–СН2 –СН2 –ОН – химическое вещество – двухатомный спирт, бесцветная, вязкая, сладковатая на вкус жидкость, с температурой кипения 197 град С, плотностью при 20 град С = 1,112 1,113 г/см3.– основа тосола и антифризов… … Автомобильный словарь
этиленгликоль — ЭГ 1, 2 этандиол Формулы: С2Н6О2 эмпирическая НО СН2 СН2 ОН структурная [ГОСТ 27244 93] Тематики волокна химические Обобщающие термины технология получения полиэфирных волокон Синонимы ЭГ … Справочник технического переводчика
Этиленгликоль — ЭТИЛЕНГЛИКОЛЬ, HOCH2CH2OH, вязкая бесцветная жидкость, tкип 197,6°C. Применяется в производстве полиэтилентерефталата, полиуретанов, взрывчатых и душистых веществ, как компонент антифризов. Токсичен. … Иллюстрированный энциклопедический словарь
ЭТИЛЕНГЛИКОЛЬ — (СН20Н)2 простейший двухатомный спирт, хорошо растворяется в воде, ядовит; получают из (см.). Широко применяется в смеси с водой как антифриз, в производстве пластмасс, искусственного волокна, для хим. синтезов (растворителей, взрывчатых веществ… … Большая политехническая энциклопедия
этиленгликоль — НОСН2СН2ОН, вязкая бесцветная жидкость, tкип 197,6°C. Применяется в производстве полиэтилентерефталата, полиуретанов, взрывчатых и душистых веществ, как компонент антифризов. * * * ЭТИЛЕНГЛИКОЛЬ ЭТИЛЕНГЛИКОЛЬ, НОСН2СН2ОН, вязкая бесцветная… … Энциклопедический словарь
этиленгликоль — etilenglikolis statusas T sritis chemija formulė HOCH₂CH₂OH atitikmenys: angl. ethylene glycol rus. этиленгликоль ryšiai: sinonimas – 1,2 etandiolis … Chemijos terminų aiškinamasis žodynas
Этиленгликоль — этандиол 1,2, HOCH2CH2OH, простейший гликоль (См. Гликоли), бесцветная вязкая жидкость со сладким вкусом; tпл 12,3°С, tkип 196°С, плотность 1,113 г/см3 (20°С); смешивается во всех соотношениях с водой, спиртом, ацетоном, плохо растворим в … Большая советская энциклопедия
Этиленгликоль ( этандиол, гликоль ) - это простейший двухатомный спирт, его химическая формула HO-CH2CH2-OH. Этиленгликоль широко применяется в качестве антифриза, также используется в органическом синтезе. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Этиленгликоль не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен .
Глицерин ( триоксипропан ) - это простейший представитель трехатомных спиртов, его химическая формула HOCH2CH(OH)-CH2OH (C3H8O3). Глицерин находит широкое применение в при изготовлении бумаги, косметики и мыла, а также в производстве кондитерских изделий и алкогольных напитков; применяется в технологических процессах, предотвращает замораживание рабочих жидкостей, способствует продлению срока службы деталей из эластомеров. Глицерин является бесцветной вязкой жидкостью, неограниченно растворимой в воде. Обладает сладким вкусом.
Теплофизические свойства этиленгликоля
При нормальных условиях вязкость этиленгликоля в ~19 раз больше вязкости воды. Теплофизические свойства водного раствора этиленгликоля зависят от его содержания в смеси.
При проведении инженерных расчётов проще использовать приближённые формулы для определения физических свойств этиленгликоля.
![Этиленгликоль]()
Этиленгликоль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Содержание
История открытий и производства
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
![Этиленгликоль]()
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
![Этиленгликоль]()
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
![Этиленгликоль]()
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
Концентрация % 30 35 40 45 50 55 60 Плотность, г/мл 1,050 1,058 1,067 1,074 1,082 1,090 1,098 Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
![Теплофизические свойства этиленгликоля - водный раствор]()
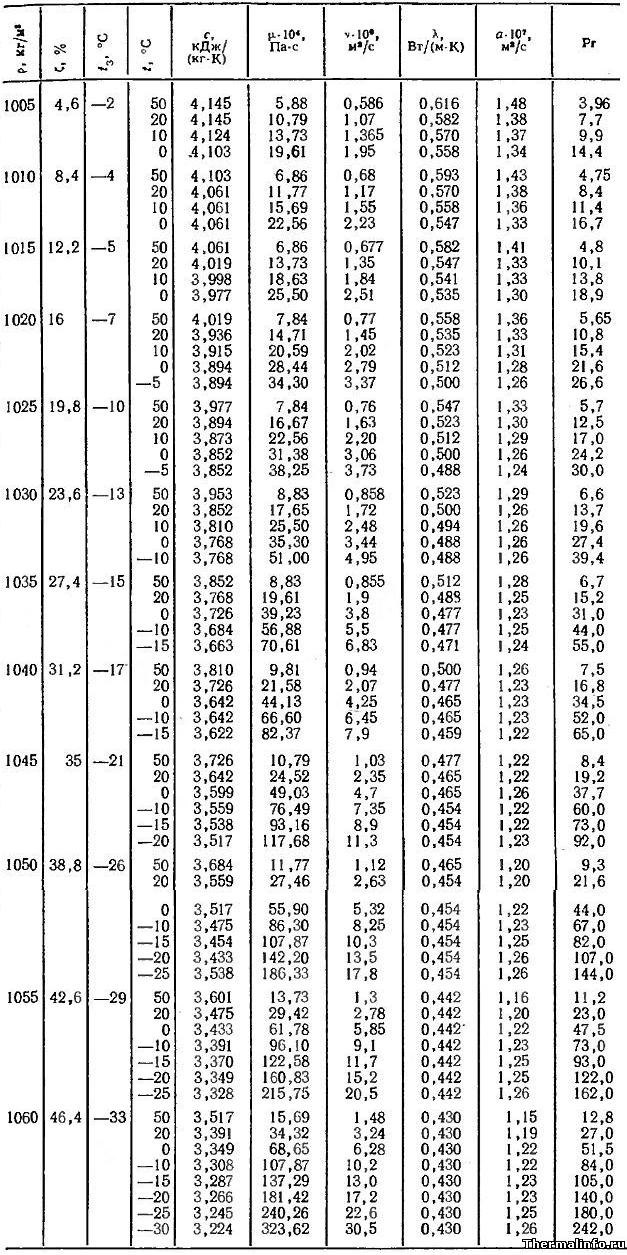
В таблице представлены следующие теплофизические и физические свойства этиленгликоля в виде водного раствора различной концентрации ζ: плотность ρ, температура замерзания tз, теплоемкость C, динамическая вязкость μ, кинематическая вязкость ν, теплопроводность λ, температуропроводность a, число Прандтля Pr этиленгликоля.
Физические свойства раствора этиленгликоля приведены в таблице в зависимости от температуры и его концентрации в растворе.
По данным таблицы видно, что с увеличением концентрации этиленгликоля в растворе его теплоемкость и теплопроводность уменьшаются, а температура замерзания раствора снижается при концентрации этиленгликоля до 66,3%. При дальнейшем увеличении концентрации этиленгликоля, температура замерзания раствора начинает повышаться.
В случаях применения раствора этиленгликоля в качестве антифриза в системе охлаждения автомобиля, снижение величин этих физических свойств этиленгликоля приведет к меньшему теплоотводу от двигателя. Таким образом, чем более концентрированный раствор этиленгликоля применяется в качестве охлаждающей жидкости, тем менее эффективно будет работать система охлаждения автомобиля в части отвода тепла от двигателя.
Физические свойства этиленгликоля даны в диапазоне температуры от минус 30 до 50°С и при концентрации этиленгликоля в растворе от 4,6 до 46,4 %.
![Физические свойства водного раствора этиленгликоля при различной температуре и концентрации - таблица 1]()
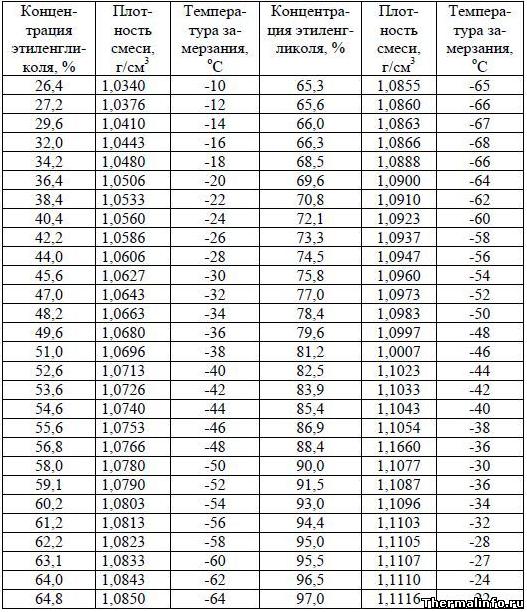
Плотность и температура замерзания раствора этиленгликоля
В таблице даны значения плотности и температуры замерзания смеси технического этиленгликоля и воды в зависимости от концентрации. Следует отметить, что с увеличением содержания этиленгликоля в растворе, увеличивается плотность раствора. Температура замерзания раствора этиленгликоля при увеличении его концентрации в растворе снижается (до содержания этиленгликоля 66,3%), а затем начинает расти.
Таким образом, раствор этиленгликоля обладает свойством не замерзать до температуры -68°С при концентрации этиленгликоля в растворе 66,3%. Такие свойства раствора этиленгликоля в воде позволяют применять его в качестве антифриза во множестве систем.
![Плотность и температура замерзания антифриза (смеси технического этиленгликоля и воды) - таблица 2]()
Источники:
Читайте также: