Белки природные полимеры кратко
Обновлено: 19.05.2024
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку белков вследствие расщепления пищи пищеварительными ферментами или собственных запасов белков. Соединение аминокислот происходит через общие для них группировки: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты, при соединении их выделяется молекула воды. Между соединившимися аминокислотами возникает связь, называемая пептидной, а образование нескольких аминокислот называется пептидом. Соединения из большого числа аминокислот называют полипептидом.
В каждой аминокислоте содержится:
- аминогруппа -NH2;
- карбоксильная группа -COOH;
- радикал (участки молекул, лежащие вне амино- и карбоксильной групп). Радикалами аминокислоты отличаются друг от друга.
Уровни организации белковой молекулы
Первичной, самой простой структурой является полипептидная цепь, т. е. нить аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными.
Следующий, более высокий уровень организации – это вторичная структура, когда белковая нить закручена в виде спирали.
Между группами -СООН, находящимися на одной стороне витка спирали, и группами -NН2 на другом витке образуются водородные связи.
Нить аминокислот далее свертывается, образуя клубок, или фибриллу, для каждого белка специфичную.
Таким образом, возникает сложная конфигурация, называемая третичной структурой.
Третичная структура поддерживается также небольшим числом ковалентных дисульфидных мостиков (-S-S- связей), возникающих между атомами серы серосодержащих аминокислот.
Благодаря соединению нескольких молекул белков между собой образуется четвертичная структура. Если пептидные цепи уложены в виде клубка, то такие белки называют глобулярными.
Если полипептидные цепи уложены в пучки нитей, они носят название фибриллярных белков.
Сложные белки, молекулы которых состоят из белка и связанного с ним окрашенного небелкового компонента
Сложные белки, представляющие собой соединения белков с углеводами
Фибриноген, содержащийся в плазме крови, относится к
Белки, слаборастворимые в воде
Основные белки хроматина
К простым белкам относятся
Белок овальбумин, входящий в состав яиц, относится к
Мономерами белка являются
Впервые белковую молекулу исследовал
Ученый, экспериментально доказавший наличие пептидной связи в белковой молекуле

БЕЛКИ — это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул.
Белок можно рассматривать как сложный полимер аминокислот.
Белки входят в состав всех живых организмов, но особо важную роль они играют в животных организмах, которые состоят из тех или иных форм белков (мышцы, покровные ткани, внутренние органы, хрящи, кровь).
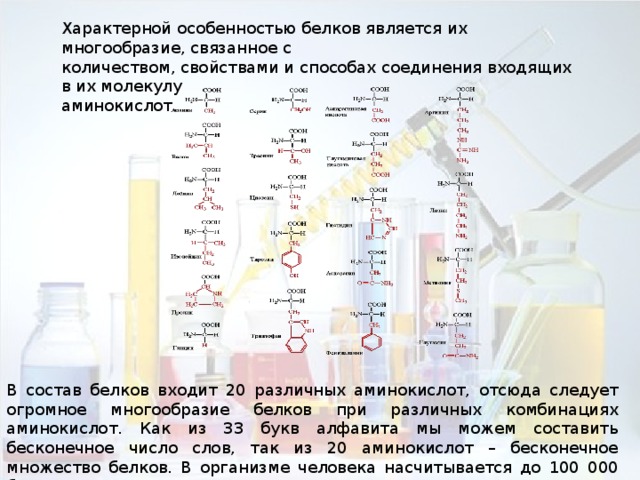
Характерной особенностью белков является их многообразие, связанное с
количеством, свойствами и способах соединения входящих в их молекулу
В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.

Растения синтезируют белки из углекислого газа СО2 и воды Н2О за счет фотосинтеза, усваивая остальные элементы белков (азот N, фосфор Р, серу S, железо Fe, магний Mg) из растворимых солей, находящихся в почве.
Животные организмы в основном получают готовые аминокислоты с пищей и на их
базе строят белки своей организма. Ряд аминокислот (заменимые аминокислоты)
могут синтезироваться непосредственно животными организмами.

Строение белков
Белки представляют собой нерегулярные полимеры, построенные из остатков аминокислот.
Остатки аминокислот в белках соединены амидной связью между амино- и карбоксильными группами. Связь между двумя аминокислотными остатками обычно называется пептидной связью, а полимеры, построенные из остатков аминокислот, соединенных пептидными связями, называют полипептидами.
Таким образом, белок представляет собой полипептид, содержащий сотни или
тысячи аминокислотных звеньев.
Белок как биологически значимая структура может представлять собой как один полипептид, так и несколько полипептидов, образующих в результате
нековалентных взаимодействий единый комплекс.

Немного из истории..
Историческая справка.
Первая гипотеза о строении молекулы белка была предложена в 70-х годах XIX в. Это была уреидная теория строения белка. В 1903 г. немецкий ученый Э.Г.Фишер предложил пептидную теорию, которая стала ключом к тайне строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO.
Идея о том, что белки – это полимерные образования, высказывалась еще в 1888 г. русским ученым А.Я.Данилевским. Согласно полипептидной теории белки имеют определенную структуру. В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков.
А. Я. Данилевский
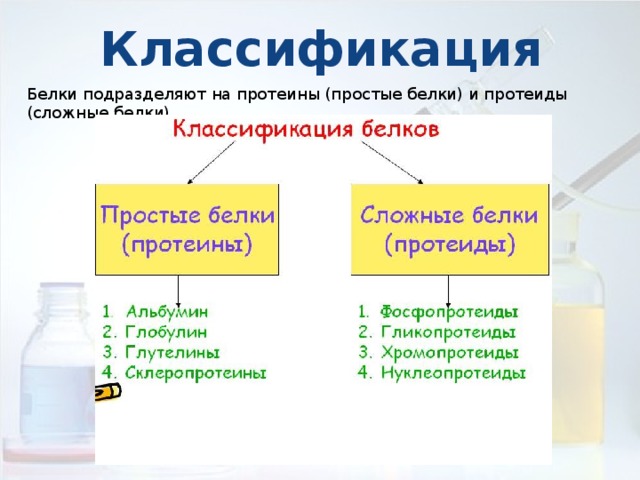
Классификация
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки)

Функции белков
Функции белков.
• защищают организм от микробов и вирусов, участвуя в выработке антител;
• регулируют энергобаланс, особенно при больших нагрузках или при дефиците в пище жиров и углеводов.
• обеспечивают рост, размножение и полноценное развитие организма, особенно нервной системы, регулируя раздражимость и реакции на внешние раздражители;
• входят в состав гормонов, мышц и других тканей;
• в связи с витаминами и микроэлементами являются биологическими катализаторами — ферментами;
• формируют способность высшей формы движения материи — мышление;

Элементный состав
Элементный состав белков
Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-
23% кислорода , 6-7% водорода , 0,3-2,5% серы .
В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
Содержание основных химических элементов в белках может различаться,
за исключением азота, концентрация которого характеризуется наибольшим
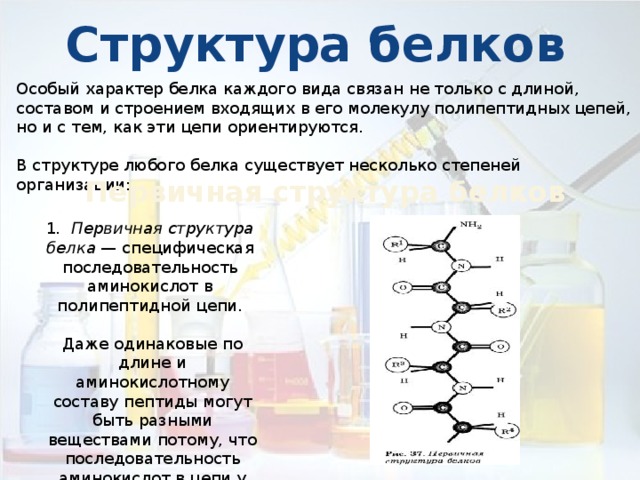
Структура белков
Особый характер белка каждого вида связан не только с длиной, составом и строением входящих в его молекулу полипептидных цепей, но и с тем, как эти цепи ориентируются.
В структуре любого белка существует несколько степеней организации:
Первичная структура белков
1 . Первичная структура белка — специфическая последовательность аминокислот в полипептидной цепи.
Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная.
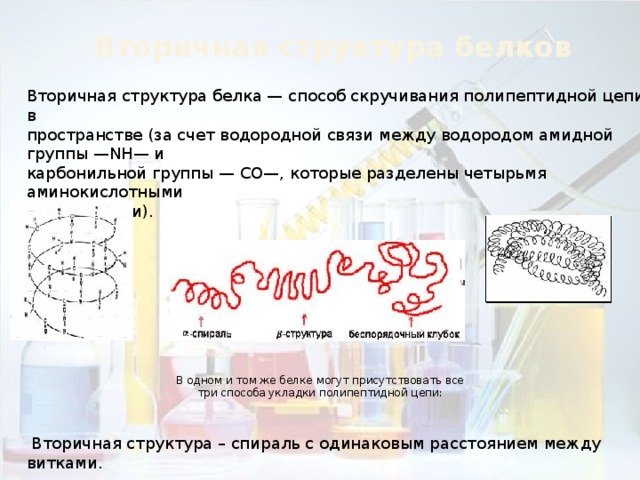
Вторичная структура белков
Вторичная структура белка — способ скручивания полипептидной цепи в
пространстве (за счет водородной связи между водородом амидной группы —NH— и
карбонильной группы — СО—, которые разделены четырьмя аминокислотными
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:
Вторичная структура – спираль с одинаковым расстоянием между витками.
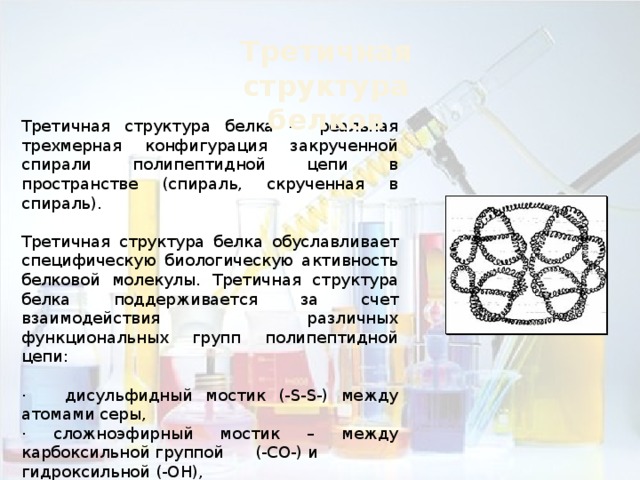
Третичная структура белков
Третичная структура белка — реальная трехмерная конфигурация закрученной спирали полипептидной цепи в пространстве (спираль, скрученная в спираль).
Третичная структура белка обуславливает специфическую биологическую активность белковой молекулы. Третичная структура белка поддерживается за счет взаимодействия различных функциональных групп полипептидной цепи:
· дисульфидный мостик (-S-S-) между атомами серы,
· сложноэфирный мостик – между карбоксильной группой (-СО-) и
· солевой мостик - между карбоксильной (-СО-) и аминогруппами (NH2).
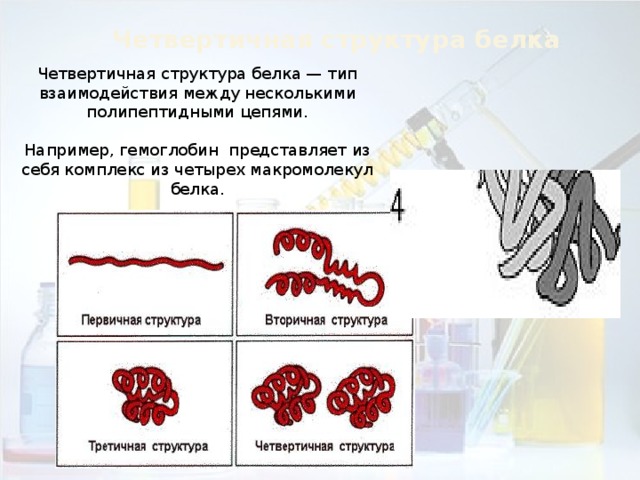
Четвертичная структура белка
Четвертичная структура белка — тип взаимодействия между несколькими
Например, гемоглобин представляет из себя комплекс из четырех макромолекул

Физические свойства
Белки имеют большую молекулярную массу ( 104—107),
многие белки растворимы в воде, но образуют, как правило, коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании
Белки способны к набуханию, характеризуются оптической активностью и подвижностью в электрическом поле, некоторые растворимы в воде. Белки имеют изоэлектрическую точку.

Химические свойства
Важнейшим свойством белков является их способность проявлять как
кислотные, так и основные свойства, то есть выступать в роли амфотерных

Свойство а мфотерности лежит в основе буферных свойств белков и их
участии в регуляции рН крови.

Химические свойства
2. Качественные реакции на белок:
биуретовая реакция: фиолетовое окрашивание при обработке солями меди в щелочной среде (дают все белки),
ксантопротеиновая реакция: желтое окрашивание при действии
концентрированной азотной кислоты, переходящее в оранжевое под действием
выпадение черного осадка (содержащего серу) при добавлении ацетата свинца
(II), гидроксида натрия и нагревании.
- Денатурация — разрушение вторичной и третичной структуры белка.
белка куриного яйца под воздействием высокой температуры
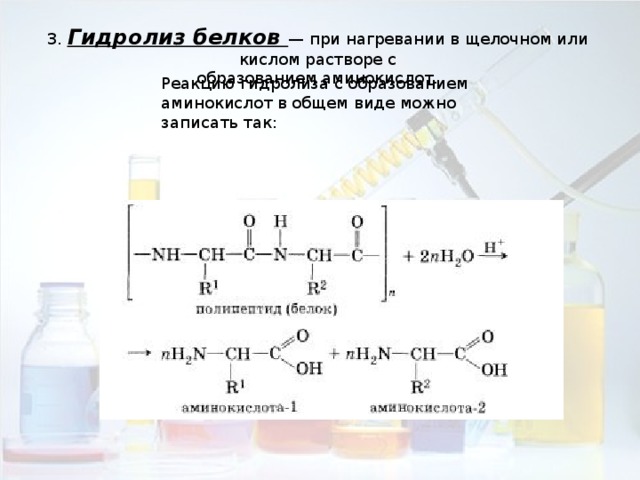
3. Гидролиз белков — при нагревании в щелочном или кислом растворе с
Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:

Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
Синтез белков
Выяснено, что синтез белков в организме осуществляется с участием других высокомолекулярных
В настоящее время человек уже глубоко познал механизм биосинтеза белка и приступил к искусственному получению важнейших
белков на основе тех же принципов, которые столь совершенно отработаны в
процессе развития органического мира.

В данной работе были рассмотрены химические и физические свойства белков, классификация белков, состав и строение белков, были рассмотрены разнообразные функции белков, а также их значение.
Доказано, что белки - обязательная составная часть всех живых клеток, играют исключительно важную роль в живой природе, являются главным, наиболее ценным и незаменимым компонентом питания. Это связанно с той огромной ролью, которую они играют в процессах развития и жизни человека. Белки являются основой структурных элементов и тканей, поддерживают обмен веществ и энергии, участвуют в процессах роста и размножения, обеспечивают механизмы движений, развитие иммунных реакций, необходимы для функционирования всех органов и систем организма.
Биологические полимеры белки состоят из набора аминокислот, которые в различных сочетаниях могут формировать различные виды химических соединений. Состав белков определяется генетическим кодом, который является одним из предметов тщательного изучения учеными во всем мире.
В настоящее время ученые выделяют три вида белков – фибриллярные белки образуют полимеры с высокорегулярной структурой, глобулярные белки представляют собой водорастворимые элементы, которые имеют сферическую форму, и мембранные белки представляют собой клеточную мембрану и часто выполняют функцию рецепторов. Белки – это биополимеры, состоящие из остатков α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). Белки входят в состав клеток и тканей всех живых организмов. В молекулы белков входит 20 остатков различных аминокислот.
Первичная структура белка – это последовательность аминокислотных звеньев в линейной полипептидной цепи.
Вторичная структура – это пространственная конфигурация белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт водородных связей между группами: CO и NH.
Третичная структура – это пространственная конфигурация, которую принимает закрученная в спираль полипептидная цепь.
Четвертичная структура – это полимерные образования из нескольких макромолекул белка.
Свойства белков весьма разнообразны, которые они выполняют. Одни белки растворяются в воде, образуя, как правило, коллоидные растворы (например, белок яйца); другие растворяются в разбавленных растворах солей; третьи нерастворимы (например, белки покровных тканей).
1. Денатурация – разрушение вторичной, третичной структуры белка под действием различных факторов: температура, действие кислот, солей тяжёлых металлов, спиртов и т. д.
2. Качественные реакции на белки:
Данная презентация может быть использована на любом этапе урока при изучении темы "БЕЛКИ".
| Вложение | Размер |
|---|---|
| Презентация для уроков химии 10 класс | 2.94 МБ |
Предварительный просмотр:
Подписи к слайдам:
Белки Урок химии для 10 класса Автор: Сентякова Елена Аркадьевна Учитель химии высшей квалификационной категории МБОУ СОШ № 76 г. Ижевска Удмуртской Республики
Белки – высшая ступень развития вещества в природе Белки – это природные полимеры, обладающие высокими значениями молекулярной массы, молекулы которых построены из остатков аминокислот, соединенных пептидной связью.
Содержание Понятие о белках Историческая справка Состав и строение белков Классификация белков Структура белков Химические свойства белков Значение белков Выводы Первичное закрепление знаний
Понятие о белках Белки – основа жизни на Земле. Содержание белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень - 57%, мозг – 15%, жировая ткань, костная и ткань зубов – 14-28%.
Историческая справка Яконо Бартоломео Беккари в 1728 году впервые выделил белок (в виде клейковины) из пшеничной муки. Это событие принято считать рождением химии белка.
Историческая справка 1903 году Э. Фишер предложил пептидную теорию строения белка: Белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH – CO
Н. Д. Зелинский ставил проблему познания внутренней структуры белка в один ряд с проблемой использования внутриатомной энергии. Историческая справка
Строение белков было доказано в 1888 году А. Я. Данилевским. Он указал на то, что в молекулах белков содержатся повторяющиеся пептидные группы атомов.
Состав и строение белков В состав белковых веществ входят: углерод – 50-55%, водород – 6,5-7,3%, кислород – 19-24%, азот – 15-19%, сера – 0,2-2,4%. Молекулярная масса белков колеблется от нескольких тысяч до нескольких миллионов. Mr (белка яйца) = 36000; Mr (белка мышц) = 1500000 В настоящее время известны свыше 150 природных аминокислот и только 20 из них входят в состав белков
Некоторые а-аминокислоты, встречающиеся во всех животных и растительных белках Название аминокислоты Сокращенное обозначение аминокислотных остатков Строение молекулы аминокислоты Глицин Gly (Гли) NH 2 – CH 2 - COOH Аланин Ala (Ала) CH 3 – CH NH 2 - COOH Валин Val (Вал) (CH 3 ) 2 CH - CH NH 2 - COOH Лейцин Leu (Лей) (CH 3 ) 2 CHCH 2 - CH NH 2 - COOH Серин Ser ( Сер) HO – CH 2 - CH NH 2 - COOH Цистеин Cys (Цис) HS – CH 2 - CH NH 2 - COOH Фенилаланин Phen (Фен) C 6 H 5 CH 2 - CH NH 2 - COOH
Каждый организм имеет собственный набор белков, т.е. индивидуален. На Земле нет двух одинаковых людей по белковому веществу, за исключением однояйцовых близнецов
Классификация белков По составу По функциям По структуре
По составу Простые ( протеины) – состоят только из аминокислот Сложные (протеиды) – состоят из глобулярных белков и небелкового материала
По функциям Строительная – белки участвуют в образовании оболочки клетки, органоидов и мембран клетки. Из белков состоят кровеносные сосуды, сухожилия, волосы . Каталитическая – все клеточные катализаторы – белки. Двигательная – сократительные белки вызывают всякое движение. Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям . Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ. Энергетическая – 1 г белка эквивалентен 17,6 кДж. Рецепторная – реакция на внешний раздражитель .
По структуре Фибриллярные. Наиболее важна вторичная структура, нерастворимые в воде, отличаются механической прочностью. К ним относятся коллаген и миозин . Глобулярные. Наиболее важна третичная структура, полипептидные цепи свернуты в компактные глобулы, растворимы, легко образуют коллоидные суспензии. К ним относятся ферменты, гормоны . Промежуточные. Фибриллярной природы, но растворимы. К ним относится фибриноген .
Структура белков Первичная структура Вторичная структура Третичная структура Четвертичная структура
Первичная структура Представляет собой вытянутую нить; определяется тремя факторами: природой аминокислот, входящих в состав белков; количеством аминокислот; последовательностью аминокислот .
Вторичная структура Вторичной структурой обладает большая часть белков. Полипептидные цепочки во вторичной структуре могут быть по – разному расположены в пространстве .
Третичная структура В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие.
Четвертичная структура Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.
Химические свойства белков Гидролиз белков Денатурация белков Цветные реакции белков
Гидролиз белков Гидролиз белков сводится к расщеплению полипептидных связей
Значение белков Отдельные белки применяются в народном хозяйстве (белки шерсти, шелка, кожи и рогов животных) Выяснение структуры белков позволяет понять механизм наследственности Изучение белков помогает понять природу многих заболеваний Лечение с помощью белков некоторых заболеваний (инсулин используется при лечении сахарного диабета)
Вывод Понятие “белок” и “жизнь” неразрывно связаны друг с другом. Что такое жизнь? Откуда она появилась на Земле? Эти вопросы волновали людей всегда. Белок – вот самая высшая ступень развития вещества, обусловившая появление человека и жизни вообще на Земле .
Первичное закрепление знаний 1. Белки в организме выполняют различные функции. Отметьте наиболее важные: А) гормональная; Б) ферментативная; В) токсикологическая; Г) энергетическая; Д) покровная 2. Качественной реакцией на белки является: А) биуретовая; Б) денатурация; В) гидролиз белка; Г) синтез белка 3. Первичная структура белка это: А) последовательность аминокислотных звеньев в линейной полипептидной цепи: Б) образование многочисленных водородных связей; В) образование водородных связей и дисульфидных мостиков.
По теме: методические разработки, презентации и конспекты
Методическая разработка урока химии в 11 классе "Белки - природные полимеры"
Данный материал будет полезен как учителям химии, так и преподавателям биологии. Можно смело применить в качестве интергированного материала, предварительно его переработав.
Белки — природные высокомолекулярные вещества Химические свойства белков
Материал урока формирует знания о составе и строении белков как высшей ступени развития вещества.

Методическая разработка урока по биологии "Белки - природные высокомолекулярные вещества"
Методическая разработка урока по биологии "Белки - природные высокомолекулярные вещества".
План- конспект урока в 10 классе "Белки - природные полимеры"
План - конспект и презентация к уроку в 10 классе "Белки - природные полимеры". Базовый учебник О.С. Габриелян Химия 10 класс М.:Дрофа 2007г.
План- конспект урока в 10 классе "Белки - природные полимеры"
План - конспект и презентация к уроку в 10 классе "Белки - природные полимеры". Базовый учебник О.С. Габриелян Химия 10 класс М.:Дрофа 2007г.
Белки – природные полимеры. Состав и строение белков.
Белки – природные полимеры. Состав и строение белков.

Белки – природные полимеры. Состав и строение белков.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, спо.
Читайте также:

