Атом сложная частица кратко
Обновлено: 04.07.2024
Создателем атомно-молекулярного учения считают М.В. Ломоносова, он различал в строении вещества две ступени: элементы (атомы, в нашем понимании) и корпускулы (молекулы). Ломоносов утверждал, что простые вещества состоят из атомов одного вида, а сложные – из различных атомов.
Всемирное признание атомно-молекулярная теория получила благодаря Дж. Дальтону, который, в отличии от древнегреческих философов при формулировании своих утверждений опирался только на экспериментальные данные. Дж. Дальтон ввел одну из важнейших характеристик атома – атомную массу, относительные значения которой были установлены для ряда элементов. Но, несмотря сделанные им открытия атом считали неделимым.
После получения экспериментальных доказательств (конец XIX начало XX века) сложности строения атома: открытие фотоэффекта (испускание носителей электрического заряда с поверхности металлов при их освещении), катодных (поток отрицательно заряженных частиц – электронов, в трубке, в которой имеется катод и анод) и рентгеновских лучей (испускание веществами сильного электромагнитного излучения, подобного видимому свету, но более высокочастотного, при действии на эти вещества катодных лучей), радиоактивности (самопроизвольное превращение одного элемента в другой, при котором происходит испускание электронов, положительно заряженных и других частиц, а также рентгеновского излучения) было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой. Эти открытия дали толчок к созданию первых моделей строения атома.
Модели строения атома
Ещё одну модель предложил немецкий физик Филипп фон Ленард, согласно которой атом состоит из нейтральных частиц крайне малых размеров (вследствие чего, большая часть атома – пустота), каждая из которых – электрический дуплет (рис. 1г).

Рис. 1. Модели строения атома: а – У. Томсона; б – Дж.Томсона; в – Х. Нагаока; г – Ф.Ленарда
После опытов с -частицами, в 1911г. Резерфорд предложил так называемую планетарную модель строения атома, похожую на строение солнечной системы (маленькое положительно заряженное ядро в центре атома, в котором заключена почти вся масса атома, вокруг которого по орбитам движутся электроны). Планетарная модель подверглась дальнейшему развитию в работах Н. Бора, А. Зоммерфельда и др.
Современная модель строения атома основана на знаниях квантовой механики, главный тезис которой – микрочастицы имеют волновую природу, а волны — свойства частиц. Квантовая механика рассматривает вероятность нахождения электрона вокруг ядра. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Изотопы
Изотопы – атомы, обладающие одинаковым зарядом ядра, но разной массой. Такие атомы обладают практически одинаковым строением электронной оболочки и принадлежат одному элементу. Исследование природных соединений разных элементов показывает существование устойчивых изотопов у большинства элементов периодической системы. Для всех элементов периодической системы число изотопов, встречающихся в природе, достигает 280.
Самым ярким примером изотопии можно назвать изотопы водорода –водород, дейтерий и тритий. В природе встречаются водород и дейтерий. Тритий получается искусственно.
Неустойчивые изотопы, т.е., обладающие способностью самопроизвольно распадаться называют радиоактивными изотопами. Они также могут встречаться в природных соединениях некоторых элементов.
Состав ядра атома. Ядерные реакции
В ядре атома содержится множество элементарных частиц, самые важные из которых – протон (p) и нейтрон (n). Масса протона 1,0073 а.е.м., заряд +1, в то время как нейтрон электронейтрален (заряд 0) и обладает массой 1,0087 а.е.м.
Согласно протонно-нейтронной теории строения ядра (Д.Д. Иваненко, Е.Н. Гапон, 1932) ядра всех атомов, исключая водород, состоят из Z протонов и (А-Z) нейтронов (Z – порядковый номер элемента, А – массовое число). Число электронов равно числу протонов.
где N – число нейтронов.
Свойства ядра определяются его составом (чиcлом p и n). Так, например, в атоме кислорода 16 8О 8 протонов и 16-8=8 нейтронов, что кратко записывается 8p, 8n.
Внутри ядер p и n могут превращаться (при определенных условиях) друг в друга:
![]()
![]()
![]()
— нейтрино и антинейтрино, элементарные частицы с массой и зарядом равными нулю, отличающимися только спином.
Ядерные реакции – превращения атомных ядер, в результате их взаимодействия с элементарными частицами или друг с другом. При написании уравнений ядерных реакций необходимо учитывать законы сохранения массы и заряда. Например: 27 13Al + 4 2He = 30 14Si + 1 1H.
Особенность ядерных реакций – выделение огромного количества энергии в форме кинетической энергии образующихся частиц или излучения.
Задания:
1. Определите число протонов, нейтронов и электронов в атомах S, Se, Al, Ru.
2. Закончите ядерные реакции: 14 7N + 4 2He = ; 12 6C + 1 0n =.
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX и начале XX в. в результате изучения природы катодных лучей (Дж. Томсон, 1897 г.), открытия явления фотоэффекта (А. Г. Столетов, 1889 г.), открытия радиоактивности химических элементов (А. Беккерель, М. Склодовская-Кюри, 1896—1899 гг.), определения природы α-частиц (эксперименты Э. Резерфорда, 1889—1900 гг.). Ученые пришли к заключению о том, что атомы обладают собственной структурой, имеют сложное строение.
Как же развивалась классическая теория строения атома?
В 1911 г. Э. Резерфорд предложил планетарную модель атома.
В 1913 г. Н. Бор внес в планетарную модель атома Э. Резерфорда квантовые представления.
В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
| Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов. |
Электроны, протоны и нейтроны называют элементарными частицами.
Каковы же свойства этих частиц?
Корпускулярно-волновые свойства микромира. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют ничтожно малые массы и размеры и поэтому обладают своими особыми свойствами, непохожими на те, которые имеют объекты окружающего нас макромира. Они образуют свой, специфический мир — микромир, описываемый законами квантовой механики, которые в значительной степени применимы для частиц с очень маленькими массами и очень большими скоростями.
Квантовая механика характеризует частицы микромира как объекты с двойственной природой — корпускулярно-волновым дуализмом: они являются одновременно и частицами (корпускулами), и волнами.
Корпускулярно-волновой дуализм объектов микромира подтвержден и экспериментально знакомыми вам из курса физики интерференцией и дифракцией электронов, протонов, нейтронов, атомов и т. д.
Электрон — частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственная природа электрона может быть подтверждена на опыте. Если электроны, испускаемые источником — катодом — пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают ее почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и темных колец, т. е. дифракционную картину (рис. 1).

Рис. 1.
Электронограммы газов (слева) и кристаллов (справа). Центральное пятно обусловлено нерассеянным пучком электронов, а кольца — электронами, рассеянными под разными углами
Дифракционная картина включает в себя как дифракцию — огибание волной препятствия, так и интерференцию, т. е. наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, так как только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой, электрон дает почернение лишь в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку.
Вследствие дифракции электрон, пройдя отверстие, может в принципе попасть в любую точку фотопластинки, но с разной вероятностью, т. е. можно говорить о вероятности обнаружения электрона в той или иной области фотослоя, а в общем случае — в той или иной области пространства. Поэтому движение электрона и в атоме нельзя рассматривать как движение точечного заряда по строго определенной замкнутой траектории.
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью.
(А.Беккерель, 1896 г.). Последовавшее за этим установление природы α-, β- и γ-лучей, образующихся при радиоактивном распаде (Э.Резерфорд, 1899—1903 гг.), открытие ядер атомов (Э.Резерфорд, 1909—1911 гг.), определение заряда электрона (Р.Милликен, 1909 г.) позволили Дж. Томсону и Э.Резерфорду предложить одну из первых моделей строения атома.
Атом в целом электронейтрален. Модель атома Дж. Томсона не была подтверждена экспериментальными фактами и осталась гипотезой.

Суть планетарной модели строения атома можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.
В 1913 г. датский физик Н. Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени Дж. Франк и Г. Герц (1912 г.) доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Н. Бор внёс квантовые представления в строение атома, но использовал при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определённой скоростью по строго определённым траекториям.
В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице.
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
Атомное ядро каждого химического элемента характеризуется строго определённым числом протонов Z (т. е. определённым положительным зарядом) в нём, равным порядковому номеру химического элемента в Периодической системе Д. И. Менделеева.
Число нейтронов N в атомах одного и того же химического элемента может быть различным. Следовательно, различными будут и массовые числа А (А = Z + N) у этих атомов. Такие разновидности атомов называют изотопами.


Масса атома сосредоточена в ядре- это сумма масс протонов и нейтронов. Массой электронов пренебрегают, так как она очень незначительна.
Зная массу атома и число протонов можно вычислить число нейтронов, частиц, имеющих массу, но не имеющих заряда.

Так как масса частиц, составляющих ядро атома принята за единицу, можно вычислить число нейтронов в атоме по формуле:
n=A-p, где n- число нейтронов, A- массовое число, p- число протонов.
Например, известно массовое число алюминия (27) и число протонов в ядре(13).
Вычисляем число нейтронов в ядре атома алюминия: 27-13=14.
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью.
(А.Беккерель, 1896 г.). Последовавшее за этим установление природы α-, β- и γ-лучей, образующихся при радиоактивном распаде (Э.Резерфорд, 1899—1903 гг.), открытие ядер атомов (Э.Резерфорд, 1909—1911 гг.), определение заряда электрона (Р.Милликен, 1909 г.) позволили Дж. Томсону и Э.Резерфорду предложить одну из первых моделей строения атома.
Атом в целом электронейтрален. Модель атома Дж. Томсона не была подтверждена экспериментальными фактами и осталась гипотезой.

Суть планетарной модели строения атома можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.
В 1913 г. датский физик Н. Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени Дж. Франк и Г. Герц (1912 г.) доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Н. Бор внёс квантовые представления в строение атома, но использовал при этом традиционные классические понятия механики, рассматривая электрон как частицу, движущуюся со строго определённой скоростью по строго определённым траекториям.
В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице.
Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
Атомное ядро каждого химического элемента характеризуется строго определённым числом протонов Z (т. е. определённым положительным зарядом) в нём, равным порядковому номеру химического элемента в Периодической системе Д. И. Менделеева.
Число нейтронов N в атомах одного и того же химического элемента может быть различным. Следовательно, различными будут и массовые числа А (А = Z + N) у этих атомов. Такие разновидности атомов называют изотопами.


Масса атома сосредоточена в ядре- это сумма масс протонов и нейтронов. Массой электронов пренебрегают, так как она очень незначительна.
Зная массу атома и число протонов можно вычислить число нейтронов, частиц, имеющих массу, но не имеющих заряда.
Так как масса частиц, составляющих ядро атома принята за единицу, можно вычислить число нейтронов в атоме по формуле:
n=A-p, где n- число нейтронов, A- массовое число, p- число протонов.
Например, известно массовое число алюминия (27) и число протонов в ядре(13).
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX и начале XX в. в результате изучения природы катодных лучей (Дж. Томсон, 1897 г.), открытия явления фотоэффекта (А. Г. Столетов, 1889 г.), открытия радиоактивности химических элементов (А. Беккерель, М. Склодовская-Кюри, 1896—1899 гг.), определения природы а-частиц (эксперименты Э. Резерфорда, 1889—1900 гг.).
Ученые пришли к заключению, что атомы обладают собственной структурой, имеют сложное строение.
Как же развивалась классическая теория строения атома?
Представления о составе атома и движении электронов в нем вошли в модель атома Э.Резерфорда.
Планетарная модель атома Э. Резерфорда (1911 г.), согласно которой атом состоит из положительно заряженного ядра и электронов, вращающихся вокруг ядра по замкнутым орбитам подобно движению планет вокруг Солнца. Э. Резерфорд — основоположник современного учения об атоме — построил наглядную теоретическую модель атома, которой формально мы пользуемся и сейчас.
Классическая теория Резерфорда не могла объяснить излучение и поглощение энергии атомом.
Квантовые постулаты Н. Бора (1913 г.) внесли в планетарную модель атома Э. Резерфорда квантовые представления. Постулаты Н. Бора опирались на теоретические идеи М. Планка (1900 г.) и А. Эйнштейна (1905 г.).
Его теория была построена на противоречиях. В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов (11р) и нейтронов (01n).
Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Электроны, протоны и нейтроны называют элементарными частицами.
Корпускулярно-волновые свойства микромира. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют ничтожно малые массы и размеры и поэтому обладают своими особыми свойствами не похожими на те, которые имеют объекты окружающего нас макромира. Они образуют свой, специфический мир — микромир, который живет по особым законам, диктуемым квантовой механикой — наукой о строении и свойствах элементарных частиц, ядер, атомов и молекул, об их превращениях и явлениях, сопровождающих эти превращения.
Квантовая механика характеризует частицы микромира как объекты с двойственной природой — корпускулярно-волновым дуализмом, они являются одновременно и частицами (корпускулами), и волнами.
Корпускулярно-волновой дуализм объектов микромира подтвержден и экспериментально знакомыми вам из курса физики интерференцией и дифракцией электронов, протонов, нейтронов, атомов и т. д.
Электрон — частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственная природа электрона может быть подтверждена на опыте. Если электроны, испускаемые источником, например катодом, пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают ее почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и темных колец, то есть дифракционную картину (рис. 1).

Рис. 1. Электронограммы газов (слева) и кристаллов (справа). Центральное пятно обусловлено нерассеянным пучком электронов, а кольца — электронами, рассеянными под разными углами
Дифракционная картина включает в себя как собственно дифракцию — огибание волной препятствия, так и интерференцию, то есть наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, так как только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой, электрон дает почернение лишь в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку.
Вследствие дифракции электрон, пройдя отверстие, может в принципе попасть в любую точку фотопластинки, но с разной вероятностью, то есть можно говорить о вероятности обнаружения электрона в той или иной области фотослоя, а в общем случае — в той или иной области пространства. Поэтому движение электрона и в атоме нельзя рассматривать как движение точечного заряда по строго определенной замкнутой траектории.

Видеоурок построен таким образом, что позволяет повторить сложное строение атома, его ядра и характеристику элементарных частиц (протонов, нейтронов и электронов). Рассматриваются теории и модели атомов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Атом – сложная частица"
В античные времена считалось, что атомы – это неделимые частицы. Еще древний философ Демокрит утверждал, всё окружающее нас состоит из неделимых частиц или атомов.

Благодаря важнейшим открытиям физиков конца XIX – начала XX века было доказано обратное. Так в 1895 году Вильге́льм Ко́нрад Рентге́н — немецкий физик, работавший в Вюрцбургском университете, открыл электромагнитное излучение с различными длинами волн. Их так и называют рентгеновские лучи в честь фамилии выдающегося учёного.

В 1897 году английский ученый Джозеф Джон Томсон при Кембриджском университете доказывает, что все частицы, которые образуют катодные лучи сходны и из них состоят вещества, и открывает электрон.

Годом ранее французский физик Антуан Анри Беккерель, исследуя соли урана, открывает явление радиоактивности.

Его работу по изучению явления радиоактивности продолжают дальше физики-химики Пьер Кюри и Мария Склодовская-Кюри. Это открытие принесло им вместе с Анри Беккерелем в 1903 году Нобелевскую премию.


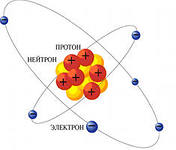
Эрнест Резерфорд в 1907 году разрабатывает ядерный или планетарный вид атома. По центру располагается положительно заряженное ядро, вокруг него движутся электроны, которые заряжены отрицательно. Но, почему атом испускает и поглощает энергию, это теория не объясняла.
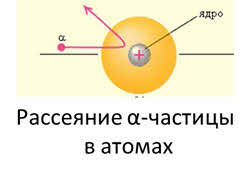
В 1913 году датский физик – Нильс Бор разработал квантовый вид строения атома, выдвинув следующие постулаты. Электроны передвигаются по замкнутым орбитам в соответствии значения своей энергии, которая не выделяется и не поглощается при этом. Электрон может переходить из одного в другое разрешенное энергетическое состояние, испуская или поглощая при этом энергию.

Эта теория носила противоречивый характер, так как рассматривала атом как частицу, движущуюся по строго определенным траекториям и с определенной скоростью.
В 1932 году независимо друг от друга русский физик Дмитрий Дмитриевич Иваненко и немецкий физик-теоретик Ве́рнер Карл Ге́йзенберг выдвинули протонно - нейтронную теорию, что ядра атомов — это положительно заряженные протоны и нейтрально заряженные нейтроны.
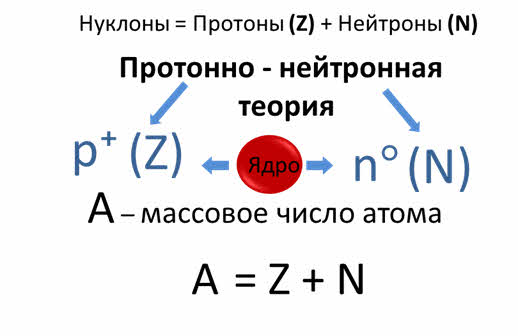
Эти частицы называют нуклонами. Было доказано, что масса атома сосредоточена именно в ядре. Сумма чисел протонов и нейтронов — это массовое число атомов. Теория тем самым объяснила существование разновидности атомов химических элементов, которые имели одинаковый атомный номер, но разные массовые числа, то есть изотопов. Из всего выше сказанного, следует, что атом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательных электронов. Порядковый номер элемента в Периодической системе равен заряду ядра, числу протонов и электронов.
Число нейтронов определяется как разница числа протонов от массового числа атома.
Состав ядра фосфора: заряд ядра фосфора плюс пятнадцать.

Соответственно, протонов и электронов у него по пятнадцать. Массовое число равно тридцати одному.

Найдём число нейтронов как разницу числа протонов от массового числа.

Тогда число нейтронов в ядре атома фосфора равно шестнадцати. Изменение числа протонов в атоме приводит к образованию нового химического элемента, потому что изменяется заряд ядра атома.

Что же произойдет, если в атоме уменьшить число нейтронов. Ответ прост. Изменение числа нейтронов в атоме приводит к изменению атомной массы элемента. Таким образом, образуется изотоп.

Свойства изотопов одного и того же элемента одинаковы, так как имеют одинаковый заряд ядра, хотя относительная атомная масса разная, так они содержат разное число нейтронов; изменение атомной массы элементов незначительное – оно имеет долевое значение.
Например, у водорода три изотопа, у каждого из которых есть свое название.
Это протий, дейтерий и тритий.

Так протий имеет заряд плюс один и массу атома один, а нейтронов в ядре вообще нет.
Дейтерий имеет заряд атома плюс один и массу атома два, нейтронов всего один. Тритий имеет заряд атома плюс один, массу атома три, нейтронов содержится два. Итак, изотопы водорода отличаются по своим свойствам, так как они имеют изменение массы весьма существенное – в кратное значение раз.
Значит химический элемент – это совокупность атомов с одинаковым зарядом ядра, то есть с одинаковым числом протонов в нем.
В Периодической системе Дмитрия Ивановича Менделеева под знаком химического элемента записывают среднее значение относительной атомной массы всех его природных изотопов.
Известны следующие способы существования химических элементов: свободные атомы, простые вещества, сложные вещества.



Свободные атомы содержат одинаковое число протонов в атомном ядре, в форме нуклидов одного и того же элемента. Например, изотопы водорода.

Простые вещества содержат один и тот же химический элемент, могут встречаться в аллотропных модификациях. Например, у атома кислорода это простое вещество кислород о два и простое вещество озон о три, которые состоят из одного химического элемента, но из разного числа его атомов.

Сложные вещества могут иметь одинаковый качественный и количественный состав, но отличаться строением. Например, межклассовые изомеры в органических соединениях этанол и диметиловый эфир.
Читайте также:

