Аммиак интересные факты кратко
Обновлено: 05.07.2024
Американский экспериментальный самолёт-ракетоплан, построенный в 1959 году, в качестве топлива использовал смесь, состоящую по большей части из аммиака. Это был первый пилотируемый гиперзвуковой летательный аппарат-самолёт, который совершил суборбитальные пилотируемые космические полёты.
Ещё в XIX веке были предложены двигатели, работающие на аммиаке. Аммиачные двигатели использовались экспериментально в XIX веке в Британии. В 1870-1880-х гг. в Новом Орлеане функционировал трамвай, работающий на аммиаке. В 40-х годах XX века некоторые автобусы Бельгии работали на аммиаке.
Аммиак и цветы
Пары нашатырного спирта способны изменять окраску цветов. К примеру, голубые и синие лепестки становятся зелеными, ярко-красные цветы меняют окрас на чёрный.
Некоторые цветы, которые изначально не имеют запаха, после обработки аммиаком начинают благоухать. Например, невероятно нежный аромат приобретают астры.
Аммиак в космосе
Облака Юпитера состоят из аммиака.
Аммиак был впервые обнаружен в межзвездном пространстве в 1968 году.
Предварительные планы терраформирования Венеры и Марса предполагают бомбардировку планет астероидами для насыщения их аммиаком и водой.
Другие факты об аммиаке
Крупнейшим производителем аммиака является Китай. На эту страну приходится треть мирового производства аммиака. В тройку лидеров входят также Индия (9%) и Россия (8%).
Аммиак является важным сырьём при производстве удобрений. 4/5 всего аммиака перерабатывается в азотные удобрения.

1. Факт — функция аммиака в организме
В организме человека аммиак вырабатывается естественным путем. Он используется для производства белка и других молекул в организме в качестве строительного блока. Кроме того, это может быть опасно, если портятся клетки организма.
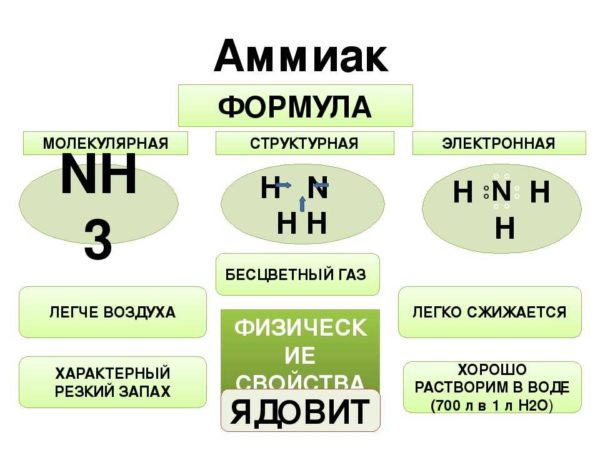
Формула аммиака
Форма молекулы NH3 — тригонально-пирамидальная. Азот обозначается буквой N, а водород — буквой H. Химические связи, соединяющие атомы, показаны линиями в формуле.
Соединенные Штаты Америки
Соединенные Штаты Америки — крупнейшая страна по производству и производству химикатов. Аммиак используется фермерами для выращивания своих растений, потому что он производится в качестве удобрения.
Использование аммиака
Аммиак имеет много преимуществ. Его можно использовать как бытовой чистящий растворитель, при производстве удобрений, хладагентов, пластмасс и взрывчатых веществ. Однако около 80% производится в удобрения. Кроме того, он может быть опасен, поскольку содержит токсичные и едкие вещества. Иногда это также вызывает отравление аммиаком.
Что нужно для производства аммиака?
Как мы знаем, аммиак можно получить из азота и водорода. Кроме того, нам нужен источник энергии для его изготовления. Для производства аммиака необходимы воздух (азот), вода (водород) и установка для синтеза зеленого газа (энергия).
Жидкость или газ
На самом деле аммиак можно превратить в газ и жидкость. Под воздействием воздуха он превращается в газ и может быть жидкостью в резервуарах низкого давления при 150 фунтах на квадратный дюйм.
Способ лечения отравления аммиаком
Промывание глаз и кожи водой — один из способов уменьшить отравление аммиаком. Однако больница необходима людям, получившим серьезные травмы, такие как ожоги в горле или постоянный кашель.
Процесс Габера
В 1913 году процесс Габера был открыт Карлом Бошем. Это производство соединения азота и водорода при высоких температурах.
Преимущества процесса Габера
У гибер-процесса есть преимущества, например, в том, что он помогает кормить популяцию. Он также используется в качестве химикатов, пластмасс и фармацевтических препаратов.
Свойства
У аммиака много свойств. Имеет резкий резкий запах. Относится к бесцветному газу, основанию и акали. Кроме того, когда его едят или вдыхают, он может быть опасен для организма.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.

Описание презентации по отдельным слайдам:

Аммиак: состав, строение, свойства, применение


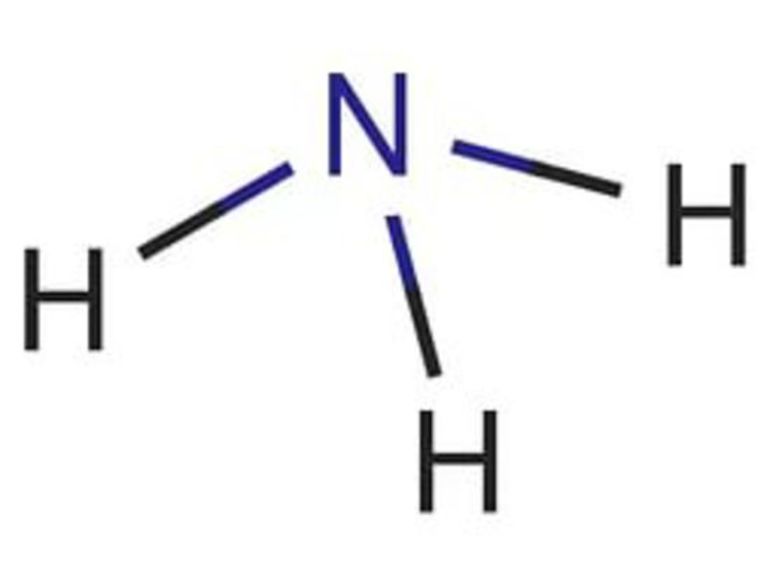
Состав молекулы NH3 или H3N

Строение молекулы Хим. связь - ?

Жидкий аммиак Водородные связи

Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха (М=17 г/моль) хорошо растворяется в воде (1200 объёмов (при 0 °C) и 700 объёмов (при 20 °C) в объёме воды Температура плавления-77.73 °C Температура кипения-33.34 °C Токсичен!

Токсикология Относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы, вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.

Биологическая роль Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Большая часть аммиака конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.

Химические свойства Взаимодействие с водой: NH3 + H2O↔NH4 + OH ↔ NH3· H2O − ион аммония Гидрат аммиака N H H H H H : … + + ОН - Донор (электронов) Акцептор (электронов) H H H H N + ОН - Гидроксид аммония H H H H N О + + - -
Аммиак (от латинского Ammonia) — химический элемент в виде газа без цвета, обладающий неприятным запахом в естественных условиях. Он легче воздушного потока, ядовит для живых организмов, отличается высоким коэффициентом растворимости в воде. Молекулярная формула представляет собой строение в виде тригональной пирамиды с тремя микрочастицами азота, расположенными вверху. За счет неспаренных частиц азота связь полярная с водородом и неопределенная — с четвертой парой электронов.

Описание элемента

В жидкой форме аммиака молекулы соединены водородной связью. Температура, вязкость и плотность аммиака по сравнению с водой значительно ниже. Процесс кипения начинается от 33 градусов, а процесс горения или плавления — от 77 градусов по Цельсию. Показатели проводимости и диэлектрической проницаемости аммиака низкие. Следовательно, прочность связей в состоянии жидкости низкая.
Аналогично воде, аммиак в жидком состоянии ассоциирован из-за наличия водородной связи. Переход химического состава в состояние жидкости, не имеющей цвета, с плотностью 681 килограмм на метр кубический, быстрый. Проводимость тока в этом состояние практически отсутствует.
Химические свойства
По свойствам аммиак замечательный растворитель для разнообразных органических и неорганических составов. В твёрдом состоянии представляет собой кристаллы, не имеющие цвета. Может взаимодействовать с кислородом, хлоридом, серной кислотой, а также реагировать на водные и соляные растворы.
Аммиак обладает следующими химическими свойствами:
- Играет роль нуклеофила или комплексообразователя в химических реакциях. При присоединении протона образовывает аммоний: NH3 + H + → NH4 + .
- В жидком растворе происходит слабая щелочная реакция из-за протекающего процесса: NH 3 + H2О → NH4 + +ОН - .
- При воздействии кислот получается соль аммония, что демонстрирует уравнение: NH3 + HNO3 → NH4NO3.
- В соединении с металлами за счет кислотных свойств образует амиды: 2NH3 +2К →2КNH2 +Н2.
Состав амида, имида и нитрида металла образуют за счет реакции с аммиаком в жидком состоянии. Нитрид получают посредством прогревания металла в азотной атмосфере.
Амиды имеют идентичные свойства гидроксидам (за счет неэлектронных ионов ОН, NH2 и молекулы воды). Основание амида сильнее гидроксида, поэтому он подвержен гидролизу, который необратим.
Растворы амидов на основе аммиака проводят ток и подвержены диссоциации: MNH2 → M + + NH2.
Фенолфталеин в составе раствора приобретает красный оттенок, но после добавления кислот наступает процесс нейтрализации.
Аммиаку в жидком состоянии свойственны ионизирующие функции растворителя, который способен растворить щелочные металлы и щелочноземельные. При этом он приобретает синий цвет. Концентрированный раствор отличается блеском металла. Во время испарения металлы из щелочи получают в целом виде, а щёлочноземельные образуют с аммиаком комплексы со свойствами проводимости металлов.

В результате происходит распадение металлических атомов на ионы, которые положительно заряжены и электроны, сульфатированные в окружении молекул NH 3. Растворы с наличием свободных электронов имеют свойства сильнейших восстановителей.
За счет электронодонорного свойства частицы аммиака могут присутствовать в комплексных соединениях в виде лигандов. Для образования аминокомплексов вводят избыточное количество аммиака в солевой раствор металла.
Химическая реакция вызывает изменение цвета реагентов. Прочными связями комплекса обладают соединения с наличием хрома и кобальта, степень окисления которого +3.
Физическое воздействие
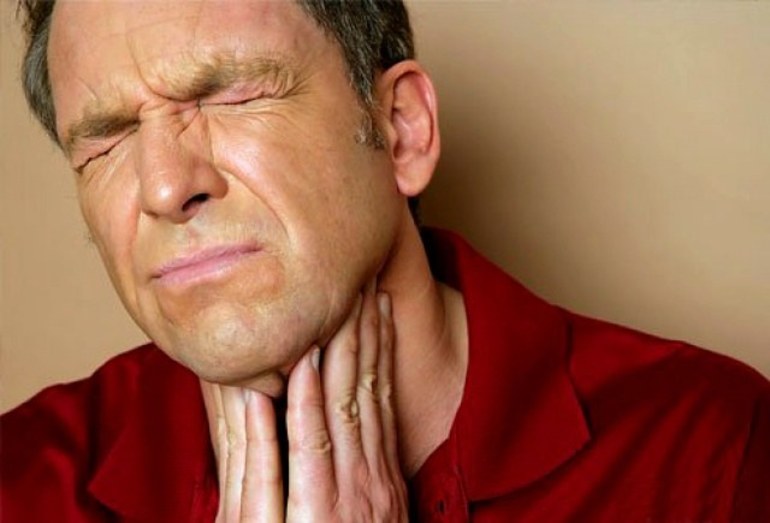
По физическим свойствам аммиак относится к веществам, обладающим удушающими характеристиками и действием на нервную систему. При попадании в область дыхательных путей способен токсинами поразить легкие и вызвать отек с поражением разных систем живого организма. По виду действия может быть местного применения и резорбтивного.
Аммиачные пары раздражает слизистую оболочку глаза и кожные покровы. Процесс протекает с сильным неприятным запахом. Вследствие воздействия пара происходит обильное выделение слез и боли в области лица. В результате появляется ожог роговицы глаза. Зрение человека ухудшается или происходит полная его потеря. Следом наступает приступ кашля, изменение цвета кожного покрова с сильным раздражением.
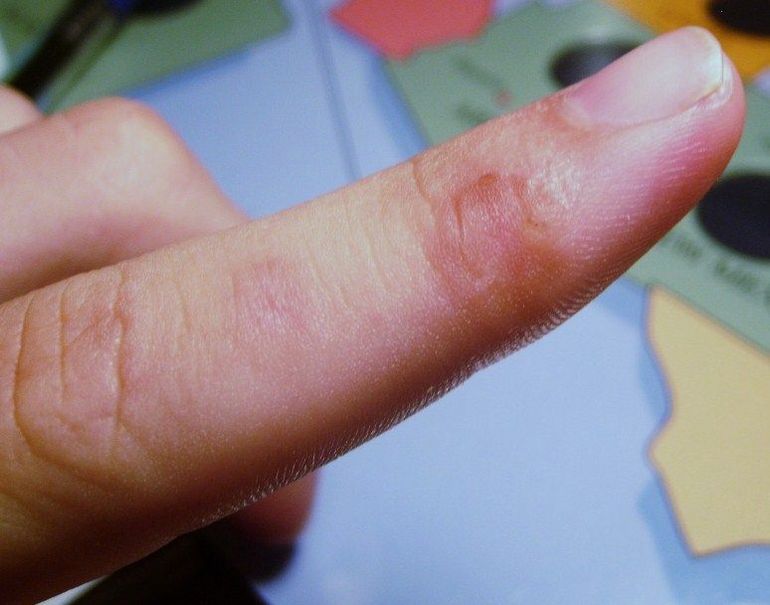
Во время попадания раствора на кожу происходит жжение пораженной поверхности и образование пузырей и изъязвлений. По своим свойствам в сжатом состояние во время процесса испарения поглощает тепло. Попадая на кожу, химический элемент способен вызвать отморожение разной степени. Наличие запаха ощущается при концентрации 37 миллиграмм на метр кубический.
Норма концентрации аммиака на рабочем месте не должна превышать 20 миллиграмм на метр кубический. Работать при более тяжелых условиях без средств индивидуальной защиты запрещено.
Раздражение глаз проявляется при 490 миллиграммах концентрации в воздухе, а зева — 280. Токсичное отравление и лёгочный отек происходит при концентрации состава в 1,5 грамма на метр кубический (если находиться в области облака испарений в течение двух часов).
Применение и использование
Аммиак входит в большое количество веществ в промышленности. Объемы изготовления этого химического элемента достигают 150 миллионов тонн. Чаще всего производят:

- азотные удобрения (аммоний и мочевина);
- вещества на взрывчатой основе;
- азотные кислоты.
Возможно применение аммиака в роли растворителя. В холодильной промышленности встречается в виде холодильного агента (R 717).
В области медицины аммиак или нашатырный спирт (более привычное название — нашатырь) выводит человека из состояния обморока, стимулирует рвотный рефлекс. Для наружного применения используют в качестве обеззараживания укусов насекомых и при обрабатывании рук врачей. При неосторожном использовании возможно получить ожог органов пищеварения, остановку работы легких.

Применение при дерматите, кожных заболеваниях, а также повреждениях кожи в результате травмы категорически запрещено. Местное использование разрешено на здоровой области кожи. При неаккуратном применении и попадании раствора на слизистую часть глазного яблока следует обработать пострадавшую область водой или борной кислотой. Обработку необходимо повторять каждые 10 минут.
Применять вещества на масляной основе и различные мази нельзя. При попадании на область носа следует промыть ее лимонной кислотой или соком из натуральных фруктов. При попадании в область рта рекомендуется обильное употребление воды, фруктового сока.
Способы получения
Аммиак производят при водородном и азотном взаимодействии молекул в промышленности. Техника производства называется процессом Габера. Вся реакция протекает с выбросом тепла и уменьшением объема. Таким образом, реакция проводится при пониженной температуре окружающей среды и повышенном давлении. Равновесие смещается вправо. В этих условиях скорость прохождения реакции маленькая, а при повышении показаний температуры скорость начинает увеличиваться. Для безопасного проведения реакции требуется специальное оборудование, поддерживающее повышенное давление.
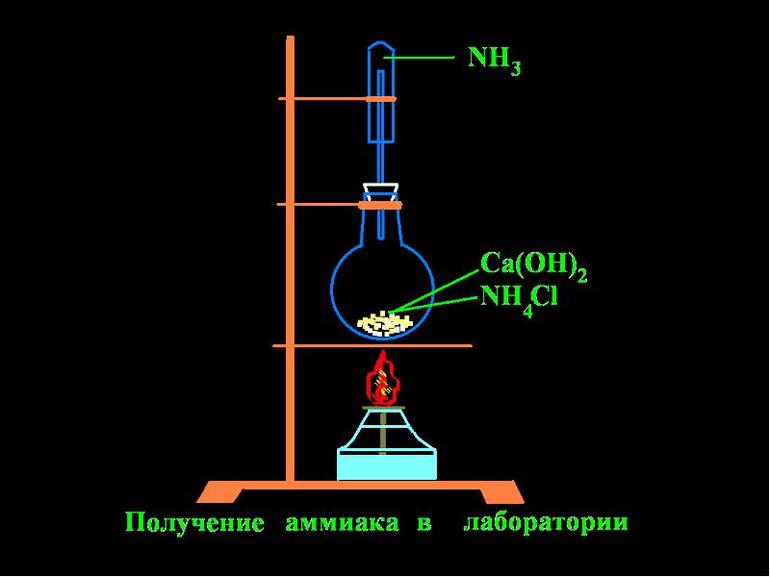
Для ускорения получения состояния равновесия используют катализаторные материалы — железо с пористым составом и некоторым процентом добавок.
По всем свойствам процесс получения аммиака происходит при температуре в 500 градусов по Цельсию и при наличии высокого давления, достигающего 350 атмосфер. Процент добычи при соблюдении этих факторов составит 30 процентов. В промышленности процесс зациклен. Происходит охлаждение состава и удаление аммиака, а непрореагировавший азот и водород возвращают для повторного синтеза обратно. Этот способ добычи аммиака в промышленности считается самым экономичным.
В условиях лаборатории аммиак добывают за счет действия щелочей. Химический элемент получают путем нагревания аммония с известью. Для сушки аммиака используют известь с натром.
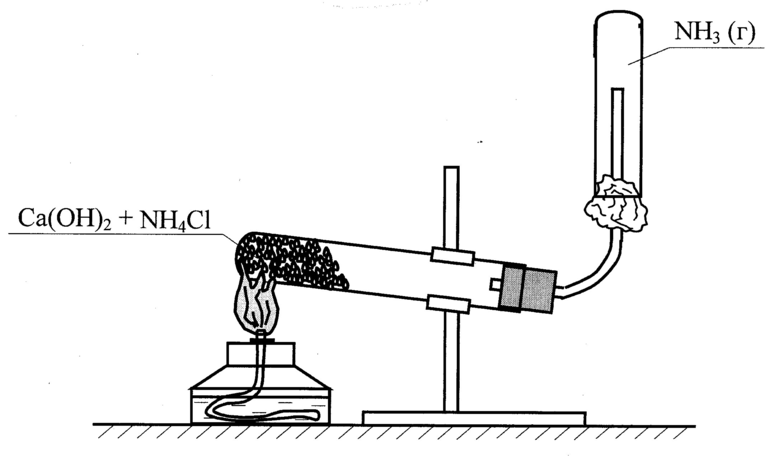
Благодаря физическим и химическим свойствам аммиака его успешно используют в промышленности, производстве, медицине, химии и многих других областях человеческой деятельности.
Читайте также:

